绵羊Follistatin基因表达及其结构域的功能分析
张宁,张雪梅,刘明军,谭立新
1 新疆维吾尔自治区动物生物技术重点开放实验室,乌鲁木齐 830000
2 新疆畜牧科学院 农业部草食家畜繁育生物技术重点开放实验室,乌鲁木齐 830000
动物及兽医生物技术
绵羊Follistatin基因表达及其结构域的功能分析
张宁1,2,张雪梅1,2,刘明军1,2,谭立新1,2
1 新疆维吾尔自治区动物生物技术重点开放实验室,乌鲁木齐 830000
2 新疆畜牧科学院 农业部草食家畜繁育生物技术重点开放实验室,乌鲁木齐 830000
为研究羊Follistatin基因的功能,提取了绵羊卵巢总RNA,通过RT-PCR方法获得羊Follistatin cDNA的完整开放阅读框 (1 038 bp)。去除信号肽序列后与原核表达载体pET41a连接,构建重组表达质粒pFSsig−,经大肠杆菌诱导表达获得FS sig−蛋白 (66 kDa)。通过RT-PCR克隆了包含N端和结构域1的Follistatin突变体 (FS N+D1),将FS N+D1片段插入慢病毒载体 (pLEX-MCS) 构建了pFS-N+D1慢病毒重组表达质粒。在293T细胞中进行慢病毒的包装,再感染绵羊肌肉原代细胞,得到稳定表达FS N+D1的肌肉细胞系,通过细胞生长曲线结果显示稳定表达FS N+D1的肌肉细胞明显比正常肌肉细胞增殖快,且差异极显著 (P<0.01),表明绵羊FS N+D1结构域有促进肌肉细胞生长的功能。
绵羊Follistatin基因,原核表达,慢病毒,细胞生长曲线
Abstract:In order to study ovine follistatin function, we amplified the total of 1 038 base pair of ovine complete follistatin cDNA and cloned into pGEM-T vector by RT-PCR from ovine ovary RNA. After removal of the signal peptide it was subcloned into the pET41a to construct the prokaryotic expression vector, named pFSsig−. SDS-PAGE and Western blotting identified the 66 kDa product of the expression of follistatin cDNA. Based on the complete CDS sequence, we cloned follistatin N-terminal domain and domain 1 with PCR and inserted into pLEX-MCS lentiviral vector, named pFS-N+D1. After package and passage of lentivirus in 293T cells, and then infected sheep primary muscle cells (SPMC). The expression of FS N+D1 in SPMC was assayed by Western blotting. The cell growth curve of the infected SPMC and noninfected control cells displayed that FS N+D1 stablly transfected SPMC proliferated significantly faster than the control cells (P<0.01). Our data inferred that ovine FS N+D1 domain had the function to stimulate sheep muscle cell growth.
Keywords:ovineFollistatingene, prokaryotes expression, lentivirus, cell growth curve
卵泡抑素 (Follistatin,FS) 是1987年自卵泡液 中分离的一种前垂体细胞分泌的对卵泡刺激素(Follicle stimulating hormone,FSH) 起拮抗作用的单链多肽,富含半胱氨酸,又名垂体促卵泡素抑制蛋白 (FsH-suppressing protein,FsP),随后发现FS能与激活素 (Activin) 结合,对卵母细胞的成熟和卵泡的发育[1]、精子的生成[2]、胚胎发育与分化、催产素的释放等起着重要的调节作用。FS基因敲除小鼠研究表明FS基因的缺失能引起肌肉、皮肤等生长发育的异常[3]。FS对TGF-β超家族许多成员具有拮抗作用,因此对不同细胞如神经细胞[4]、成骨细胞[5]、肌肉细胞、红细胞生成[6]等有广泛的调节作用,具有多方面的生物学功能[7]。肌肉抑制素基因(Myostatin,简称MSTN) 属转化生长因子-β超家族(Transforming growth factor-β super family,TGF-β)成员,是一种抑制肌肉细胞生长增殖的负调控基因[8],也是目前已知的最强的骨骼肌生长抑制物[9-10]。该基因的突变失活,能阻断MSTN对肌细胞生长增殖的抑制作用,引起所谓的“双肌性状”。最近研究表明 FS与畜禽骨骼肌发育有密切的关系。FS能与MSTN C-端竞争性结合,抑制MSTN跟受体结合,阻断下游信号传导,减弱MSTN对肌肉生长的抑制作用,引起转基因小鼠肌肉异常增生肥大,肌纤维的直径增长28%,单位面积肌纤维数量增长66%[10]。
对人FS晶体结构研究发现FS由3个结构域、N端及C端区组成,1~63位氨基酸为N端区,64~136位氨基酸为结构域1 (D1),137~211位氨基酸为结构域 2 (D2),212~288位氨基酸为结构域 3 (D3),288~315位氨基酸为C端区[11]。FS的每个结构域都有不同的配体结合活性,FS结构域2与Activin结合能力强,结构域1是与MSTN结合的最小区域,且结合能力在3个结构域中最强,删除FSD2或用D1替代D2后仍然表现出与MSTN强有力的结合能力[12]。目前对人及小鼠FS各结构域功能的研究已有很多,但在家畜方面的研究还未见详细报道,为进一步研究绵羊FS对肌肉细胞生长的调节作用,本研究克隆了绵羊 FS全长 ORF,并在大肠杆菌中进行了表达,在此基础上克隆了N端及结构域1 (N+D1)片段并构建了慢病毒表达载体。通过慢病毒载体转化绵羊肌肉细胞在绵羊肌肉细胞上研究了FS N+D1结构域对绵羊肌肉细胞生长的调节功能,为今后研制促肌肉生长制剂及转基因动物打下了基础。
1 材料与方法
1.1 材料
1.1.1菌种、试剂、质粒
载体 pET41a为本实验室保存;pLEX-MCS由美国克罗拉多大学李川源教授实验室赠送;TRIzol、大肠杆菌感受态菌株 BL21 (DE3)、DH5α、鼠抗HIS、HA单抗均购自北京天根公司;IRDye®800CW 标记的羊抗鼠 IgG抗体购自美国 LI-COR Biosciences公司;限制性内切酶、T4 DNA连接酶、IPTG等试剂均购自大连TaKaRa公司;反转录酶、小量质粒提取试剂盒、胶回收试剂盒购自杭州博日公司;中量质粒提取试剂盒购自 QIAGEN公司;LipofectamineTM2000购自 Invitrogen公司;高糖DMEM、Opti-MEM购自GIBCO公司;胎牛血清购自HYCLONE公司;其他试剂均为国产分析纯产品。
1.1.2动物材料
实验中所用的绵羊卵巢取自天鹰屠宰厂;293T细胞、绵羊肌肉原代细胞由本实验室保存。
1.2 方法
1.2.1RNA的提取、全长cDNA及N+D1结构域的克隆
取新鲜绵羊卵巢置于液氮中冷冻并进行研磨后提取总 RNA,按反转录酶说明书进行 RT-PCR。参照牛 (GenBank Accession No. NM_175801)、羊FS基因序列 (GenBank Accession No. M63123) 进行特异性引物设计。去除信号肽的FS (FS sig−) 上游引物为:5′-GTAAGCTTTAGGAAATTGCTGGCTCCG-3′,下游引物为5′-GGCTCGAGAGGGTTTACCACTCTA GAATG-3′,分别引入了Hind Ⅲ、XhoⅠ酶切位点。FS N+D1结构域上游引物为:5′-AAGGATCCCTCA GGATGGCCCGTCCTA-3′,下游引物为:5′-TTCTCGAGTTAAGCGTAGTCTGGGACGTCGTATGGGTAT TTACATTTGCCCTGGT-3′,分别引入了BamH I、XhoI酶切位点,下划线部分为血球凝集素 (HA) 序列。去除信号肽后的FS PCR扩增程序为:95℃预变性5 min;95℃变性30s,58℃退火30s,72℃延伸80s,35个循环;最后72℃延伸5 min。FS N+D1结构域PCR扩增程序为:95℃预变性5 min;95℃变性30s,57℃退火40s,72℃延伸60s,35个循环;最后72℃延伸7 min。PCR产物进行1%琼脂糖凝胶电泳并观察结果。
1.2.2原核及慢病毒表达质粒的构建
FS全长片段PCR产物经胶回收后,用Hind III/XhoI酶切,与同样酶切处理的pET41a载体进行连接,FS N+D1片段PCR产物经胶回收用BamH I/XhoI酶切,与同样酶切处理的pLEX慢病毒载体进行连接,热击法转化 DH5α,挑选克隆进行 PCR、酶切鉴定,挑选阳性克隆送上海生工生物有限公司进行DNA测序分析。重组质粒分别命名为pFSsig−、pFS-N+D1。
1.2.3Fs sig−的原核表达及鉴定
将鉴定后的原核重组表达质粒 pFSsig−和空载体质粒pET41a分别转化宿主菌大肠杆菌BL21。分别挑选单菌落接种到3 mL含Kan+的LB培养基中,于37℃剧烈摇动培养12 h,取上述培养物按1∶100的比例接种到2个5 mL含Kan+的新鲜LB培养基中,37℃剧烈摇动培养1.5 h,使菌液的OD600达到0.6~0.8。取1 mL作为诱导前对照,加入终浓度为1 mmol/L的IPTG,37℃继续培养4 h。收集培养液,6 000 r/min离心10 min,弃上清。用PBS漂洗菌体沉淀,加入适量PBS重悬菌体沉淀,再加入2×SDS上样缓冲液混匀,煮沸10 min后,按常规方法进行SDS-PAGE电泳并以考马斯亮蓝染色。同时进行Western blotting免疫印迹,使用的His标签为载体自带,具体方法如下:将凝胶放入电转缓冲液中,湿转法35 V转印110 min后5%脱脂奶粉室温封闭2 h,一抗为鼠抗HIS单抗1∶8 000稀释,4℃过夜孵育,PBST洗涤5次,每次10 min,二抗为IRDye®800CW标记的羊抗鼠IgG抗体1∶12 000稀释,室温孵育50 min,PBST洗涤5次,每次10 min,最后用PBS洗涤1次,Odyssey近红外双色激光成像系统 (Li-COR Biosciences) 扫描成像。
1.2.4绵羊原代肌肉细胞培养
将2月龄胎羊用Hanks液清洗3次,剪开皮肤用摄子剪下肌肉组织,去除结缔组织及脂肪,剪碎至2~3 mm3的小块,加入0.2%的Ⅱ型胶原酶8 mL,移至15 mL离心管中,37℃消化1.5 h,每隔20 min取出用吸管吹打,取出消化液镜下观察至消化成单个细胞,用不锈钢网过滤消化液至15 mL离心管中,1 000 r/min离心10 min,弃上清,用含10%血清及1%双抗的DMEM 8 mL重悬细胞,调整细胞密度至1.5×105个/mL,放入细胞瓶中37℃、5% CO2培养箱培养72 h,按常规方法传代培养。
1.2.5FS N+D1重组慢病毒的包装及稳定表达细胞系的建立
用DMEM (含10% FCS) 培养液培养293T细胞,待汇合度达到90%时用0.05%胰蛋白酶消化传代,取5×105个细胞铺入6孔培养板中,37℃、5%CO2培养箱培养,待细胞汇合度达到70%~80%时将pFS-N+D1 重组质粒 2 μg,包装质粒 pSPAX2 1.5 μg,包膜质粒pMD2.G 0.5 μg,按 LipofectamineTM2000说明书进行共转染,37℃、5% CO2培养箱孵育3 h后换为正常DMEM (含10% FCS) 培养液,次日上午移至 32℃、5% CO2培养箱,同时正常细胞作对照。48 h后收集上清液,用0.45 μm过滤器过滤,收集滤过液保存于−70℃。
将培养好的绵羊肌肉原代细胞用 0.05%胰蛋白酶消化后取5×105个细胞铺入6孔培养板中,37℃、5% CO2培养箱培养24 h后进行病毒感染,移出正常培养液,加入解冻的病毒液 1 mL,按终浓度为10 μg/mL加入聚凝胺 (Polybrene),细胞置于32℃、5% CO2培养箱孵育过夜,次日上午移回37℃、5% CO2培养箱孵育,8 h后更换正常培养液,37℃、5% CO2培养箱继续培养。病毒感染48 h后,按常规方法将细胞转入10 cm培养皿中,待细胞贴壁后加入600 ng/mL的puromycin进行加压筛选,3 d后更换含同样浓度的 puromycin选择性培养液,同时设置正常细胞对照组,待 7 d后即可得到稳定转染的细胞。将稳定转染的绵羊肌肉细胞在10 cm培养皿中进行扩大培养,取细胞裂解物后进行 Western blotting免疫印迹检测。
1.2.6绵羊肌肉细胞生长曲线的绘制
将稳定转染的细胞更换正常培养液后,培养至90%汇合,消化计数铺入24孔培养板,每孔细胞数为 1×104个,分 7组,每组 3孔,同时设置正常细胞对照组。培养1周,期间3 d换液1次,逐日检测一组,计数。最后把7 d的细胞数值绘成图,即为细胞生长曲线,上述实验重复 3次后获得数据用SPSS12.0软件进行统计学分析。
2 结果
2.1 FS sig−及FS N+D1结构域的克隆
通过RT-PCR及PCR扩增,获得1 038 bp的FS ORF序列及948 bp的去除信号肽的FS序列 (图1),经PCR、酶切及测序鉴定,与GenBank中牛FS cDNA进行 Blast比对,结果表明序列一致性为 98%。在此基础上扩增的FS N+D1结构域,获得495 bp的DNA片段,大小与预期结果一致 (图2)。
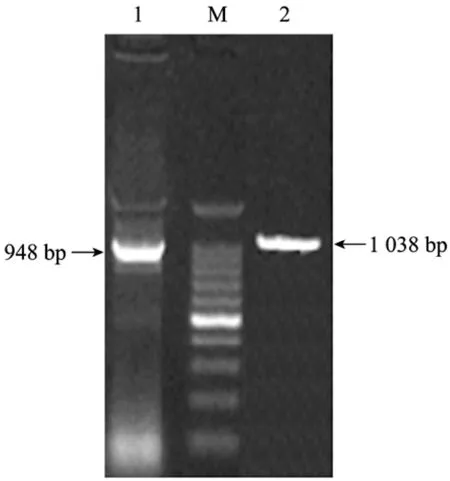
图1 Follistatin ORF及sig−的PCR扩增Fig.1 PCR products of Follistatin ORF and Follistatin sig−. 1:PCR products of FS sig−; 2: PCR products of FS ORF; M:100 bp marker.
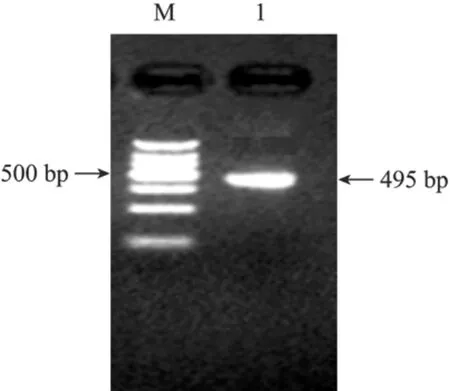
图2 FS N+D1的PCR扩增Fig.2 PCR products of Follistatin N+D1. 1: PCR products of FS N+D1; M: 150 bp marker.
2.2 Fs sig−在大肠杆菌中的表达及鉴定
从SDS-PAGE结果 (图3) 可以看出,诱导后的样品有明显的蛋白表达条带,其表达产物的分子量约为66 kDa,与理论推算值一致。Western blotting免疫印记实验显示:经诱导后的表达产物在66 kDa处呈现阳性结果 (图4),说明克隆的FS sig−在大肠杆菌得到了高效表达。
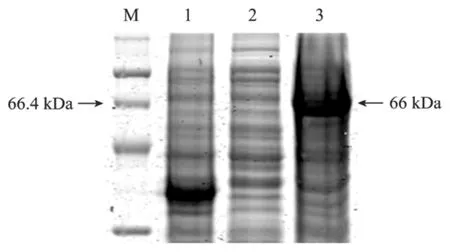
图3 pFS sig−的SDS-PAGE检测Fig.3 SDS-PAGE analysis of FS sig−expression products inE. coli. M: prestained protein ladder; 1: pET41a after IPTG induction; 2: pFS sig−His before IPTG induction; 3: pFSsig−His after IPTG induction.

图4 pFSsig−的Western blotting检测Fig.4 Western blotting analysis of FS sig−expression products inE. coli. M: prestained protein ladder; 1: pET41a after IPTG induction; 2: pFSsig−His before IPTG induction; 3:pFSsig−His after IPTG induction.
2.3 绵羊原代肌肉细胞培养、重组慢病毒的包装及稳定表达细胞系的建立
37℃、5% CO2培养箱培养72 h后传代培养的绵羊原代肌肉细胞在镜下观察可见形态为长梭形均匀生长,状态良好 (图 5)。重组质粒 pFS-N+D1转染293T细胞48 h后,收集并裂解细胞后用HA单克隆抗体做Western blotting免疫印迹检测,可见在18 kDa处有特异性条带出现,说明病毒包装成功并能表达FS N+D1重组蛋白,且与预期大小一致 (图6)。用包装病毒感染绵羊肌肉原代细胞加压筛选7 d后,正常细胞对照组全部死亡,而经感染的绵羊肌肉原代细胞生长良好;收集并裂解细胞进行Western blotting免疫印迹检测,结果显示在18 kDa处有特异性条带出现,说明在绵羊肌肉原代细胞中可以稳定表达FS N+D1重组蛋白,即得到稳定表达的绵羊肌肉细胞系 (图7)。
图5 绵羊原代肌肉细胞 (100×)Fig.5 Sheep primary muscle cells (100×).

图6 pFS-N+D1转染293T细胞Western blotting检测Fig.6 Western blotting analysis of 293T cell by pFS-N+D1 transfection. 1: 293T cell; 2: pLEX-MCS transfected 293T cell;3: pFS-N+D1 transfected 293T cell; M: prestained protein ladder.
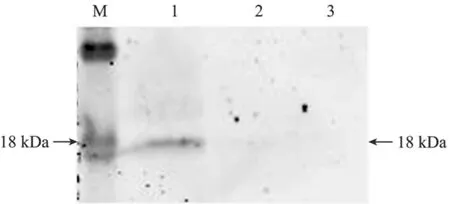
图7 pFS-N+D1感染绵羊原代肌肉细胞Western blotting检测Fig.7 Western blotting analysis of sheep primary muscle cell by pFS-N+D1 infection. 1: pFS-N+D1 infected sheep primary muscle cell; 2: pLEX-MCS infected sheep primary muscle cell;3: sheep primary muscle cell; M: prestained protein ladder.
2.4 绵羊肌肉细胞生长曲线的绘制
将稳定表达肌肉细胞系与正常肌肉细胞传至24孔培养板,其起始细胞数量一致,将 7 d的计数结果绘制成图,细胞生长曲线结果显示表达了 FS N+D1蛋白的肌肉细胞在第 3~7天增殖较正常肌肉细胞快,在细胞对数生长期中第3天差异显著 (P<0.05),第 4~7天均差异极显著 (P<0.01),说明在FS N+D1过量表达的情况下能显著促进绵羊肌肉细胞生长(图8)。
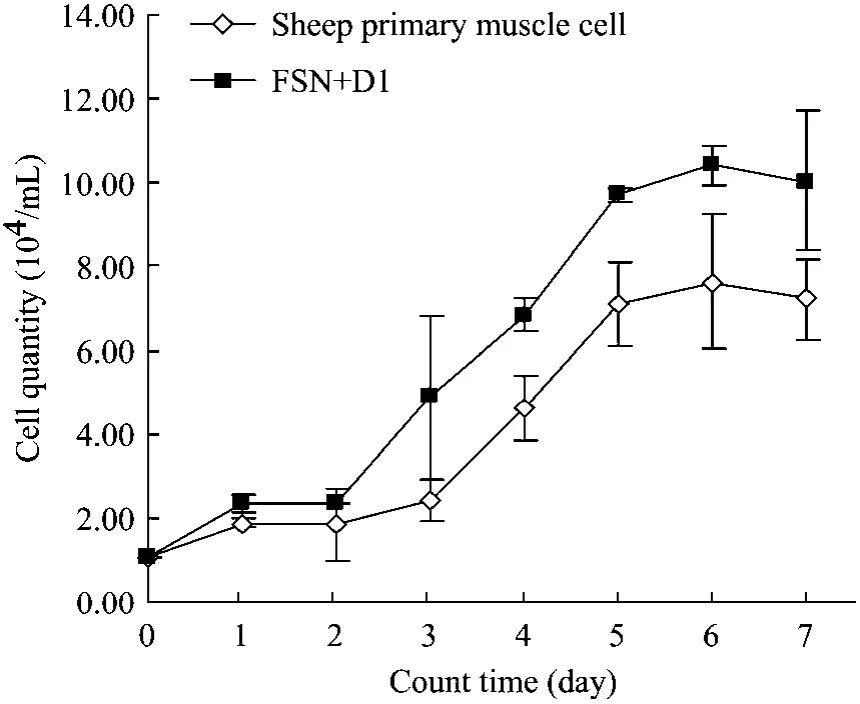
图8 绵羊肌肉细胞生长曲线Fig.8 Growth curve of sheep primary muscle cell.
3 讨论
MSTN是目前已知的最强的骨骼肌生长抑制物[10],通过生物技术手段阻断MSTN对肌细胞的抑制作用来促进肌肉的生长、减少脂肪的生成已成为目前动物生物技术的研究热点,国内目前只对猪、牛等动物的FS进行了克隆,何新等[13]克隆了全长1 038 bp猪FS cDNA的完整开放阅读框,在大肠杆菌表达了63 kDa的GST-FS融合蛋白,该表达产物可作为饲料添加剂,以期达到促进猪肌肉持续增长的目的。赵振春等[14]克隆了牛FS cDNA并在大肠杆菌中表达44 kDa的HIS-FS融合蛋白,为促进家畜肌肉的生长提供了一定的实验基础。本实验首次克隆了绵羊FS cDNA,与人、牛、鼠的标准序列进行比对,同源性分别为93%、98%、90%。信号肽去除后构建重组表达质粒 pFSsig−进行原核表达得到了66 kDa的融合蛋白,并以包涵体形式存在,为后续在体外研究FS各结构域的功能做好前期准备。
本研究为在短时间内筛选到稳定表达细胞系,选择使用的pLEX慢病毒载体是第2代慢病毒表达系统,该载体系统由包装质粒、包膜质粒及载体质粒组成。将慢病毒载体分成 3个质粒,使其共同重叠序列最小化,降低了产生具有复制能力病毒的可能性,同时可获得较高滴度的慢病毒[15],因其缺乏HIV-1增强子及启动子序列,即使存在所有的病毒蛋白也不能转录出病毒RNA,因此该载体系统比第一代载体更安全可靠。慢病毒颗粒感染细胞快速、稳定并且效率可高达 90%以上,筛选时间一般在7~10 d左右,可保证细胞的稳定表达及良好状态。基于以上慢病毒系统的优点,本实验将FS N+D1片段克隆至 pLEX载体的多克隆位点上,构建重组表达质粒与其包装质粒、包膜质粒一起共转染293T细胞48 h,得到病毒颗粒。因为原代细胞不能无限传代,筛选时间长短决定细胞状态的好坏,细胞代次高会导致细胞核型发生改变,无法进行后续转基因研究,因此我们用病毒颗粒感染绵羊原代肌肉细胞,筛选7 d即得到了稳定表达的绵羊肌肉细胞系,大大缩短筛选时间,提高筛选效率,避免细胞核型变化及细胞老化。
国外对 FS的研究开始于 20世纪 90年代,用FS进行了小鼠的转基因研究,Lee[16]于2007年在肌肉专一性启动子的调控下将 FLRG (Follistatin related protein)及FS分别进行小鼠转基因实验,在转基因小鼠肌肉组织都能检测到 FLRG或 FS的表达,而在非肌肉组织中无表达,且肌肉明显增重,说明FS或FLRG都有抑制MSTN的功能。由于FS有多种多样的生物学功能,为了避免FS对其他生物学功能和繁育能力的影响,国外大多学者开始了FS结构域的功能研究。Nakatani等[17]克隆了小鼠 FS的各个结构域,比较了FS结合Activin和MSTN的活性,根据FS的晶体结构发现结合MSTN最小结构域为 FSD1。而 Schneyer等[12]分析 FS-ACT复合体,发现 FSD2与 ACT结合力强,另外还证实了FSD1与 MSTN结合能力强。而在牛、羊等大动物上至今仍没有对FS的各个结构域进行研究的报道,因此本实验利用慢病毒系统建立了稳定表达 FS N+D1绵羊原代肌肉细胞系,在此基础上绘制了正常细胞与稳定表达FS N+D1细胞系的生长曲线,根据生长曲线,第1、2天细胞增殖缓慢,第3天开始进入对数生长期并快速增殖,第 5天后趋于稳定,符合细胞生长规律。比较FS N+D1稳定表达肌肉细胞系与正常肌肉细胞,结果显示第1天与第2天没有明显差异。在细胞对数生长期,转化细胞系的细胞增殖速度比正常肌肉细胞明显加快,从第3天开始差异显著 (P<0.05),到第 4~7天差异变为极显著(P<0.01),说明FS N+D1的表达对细胞增殖有明显的促进作用,证明了绵羊FSD1的功能与小鼠FSD1功能相似,能与MSTN结合并对细胞增殖起到促进作用。但对于结合能力的强弱没有与其他结构域进行比较,有待于进一步研究。本项研究为下一步在绵羊上分析 FS各结构域的功能和转基因动物的研究打下了基础。
REFERENCES
[1] Silva CC, Knight PG. Modulatory action of activin A and follistatin on the developmental competence ofin vitromatured bovine oocytes.Biol Reprod, 1998, 58: 558–565.
[2] Boitani C, Tefanini M, Fragale A,et al. Activin stimulates sertoli cell proliferation in a defined period of rattestis development.Endocrinol, 1995, 136: 5438–5444.
[3] Matzuk MM, Lu N, Vogel H,et al. Multiple defects and perinatal death in mice deficient in follistatin.Nature,1995, 374: 360–363.
[4] Hashimoto M, Nakamura T, lnoue S,et al. Follistatin is developmentally regulated cytokine in neural differentiation.J Biol Chem, 1992, 267: 7203–7206.
[5] Hashimoto M, Shoda A, Inous S,et al. Functional regulation of osteobalastic cells by the interaction of activin-A with follistatin.J Biol Chem, 1991, 267:4999–5004.
[6] Shiozaki M, Sakai R, Tabuchi M,et al. Evidence for the participation of endogenous activin-A/erythroid differentiation factor in the regulation of erythro-poiesis.Proc Natl Acad Sci USA, 1992, 82:1553–1556.
[7] DePaoloLV, Biasak TA, Eriskson GF,et al. Follistatin and activin: a potent intrinsic regulatory system within diverse tissue.Prco Sco Exp Biol Med, 1991, 198: 500–512.
[8] Nakatani M, Takehara Y, Sugino H,et al.Transgenic expression of a myostatin inhibitor derived from follistatinincreases skeletal muscle mass and ameliorates dystrophic pathology in mdx mice.FASEB J, 2008, 22: 477–487.
[9] Wehling M, Cai B, Tidball JG. Modulation of myostatin expression during modified muscle use.FASEB J, 2000,14: 103–110.
[10] Lee SJ, McPherron AC. Regulation of myostatin activity and muscle growth.Proc Natl Acad Sci USA, 2001, 98:9306–9311.
[11] Keutmann HT, Schneyer AL, Sidis Y. The role of follistatin domains in follistatin biological action.Mol Endocrinol, 2004, 18(1): 228–240.
[12] Schneyer AL, Sidis Y, Gulati A. Differential antagonism of activin, myostatin and growth and differentiation factor 11 by wild-type and mutant follistatin.Endocrinology,2008, 149: 4589–4595.
[13] He X, Qi B, He LQ,et al. Porcine Follistatin cDNA cloning and expression inEscherichia coli.Chin JBiotech, 2006, 22: 677–681.
何新, 齐冰, 何立千, 等. 猪Follistatin cDNA克隆及在大肠杆菌中的表达. 生物工程学报, 2006, 22: 677–681.
[14] Zhao ZC. Cloning and prokaryotic expression of the bovine follistatin cDNA gene [D]. Beijing: China Agricultural University, 2004.
赵振春. 牛卵泡抑素 cDNA的克隆及其原核表达[D].北京: 中国农业大学, 2004.
[15] Higashikawa F, Chang L. Kinetic analyses of stability of simple and complex retroviral vectors.Virology, 2001,280: 124–131.
[16] Lee SJ. Quadrupling muscle mass in mice by targeting TGF-ß signaling pathways.PLoS ONE, 2007(8): e789.
[17] Nakatani M, Takehara Y, Sugino H,et al. Transgenic expression of a myostatin inhibitor derived from follistatin increases skeletal muscle mass and ameliorates dystrophic pathology in mdx mice.FASEB J, 2008, 22: 477–487.
OvineFollistatingene expression and functional analysis of follistatin domains
Ning Zhang1,2, Xuemei Zhang1,2, Mingjun Liu1,2, and Lixin Tan1,2
1Key Laboratory of Animal Biotechnology of Xinjiang,Urumqi830000,China
2Key Laboratory of Livestock Reproduction & Biotechnology of Ministry of Agriculture,Xinjiang Academy of Animal Science,Urumqi830000,China
Received:February 9, 2010;Accepted:May 13, 2010
Supported by:Project of High Technology Research and Development of Xinjiang (No. 200611106).
Corresponding author:Mingjun Liu. Tel: +86-991-4813258; Fax: +86-991-4841417; E-mail: xjlmj2004@yahoo.com.cn
新疆维吾尔自治区高技术研究发展计划 (No. 200611106) 资助。

