基于主要化学成分变化建立的海参自溶评价指标
郑 杰, 吴 海 涛, 董 秀 萍,, 张 爽, 张 毛 毛, 朱 蓓 薇,
( 1.江苏大学 食品与生物工程学院, 江苏 镇江 212013;2.大连工业大学 食品学院, 辽宁 大连 116034 )
0 引 言
海参属棘皮动物门(Echinodermata)海参纲(Holothuroidea)。我国约有可食用海参20多种[1],以渤海海域所产的仿刺参(Stichopusjaponicus)为主。海参富含蛋白质、黏多糖及海参皂苷等多种生理活性物质,具有极高的营养价值和药用价值[2]。然而,海参具有极强的自溶能力,在外界环境及化学因子的刺激下,海参首先发生“吐肠”,体壁部分会发生“溶解”,甚至溶为液态[3]。这种独特的生理现象给海参的保鲜、贮藏、运输和加工带来诸多不便,造成极大的营养损失。目前,我国海参年产量已超过9万吨,海参的自溶问题不容忽视。
一直以来,研究学者将海参的自溶视为其对外界刺激所产生的应激效应,所以从动物学角度分析了海参自身的神经传导及自我修复能力[4-5]。对于水产保鲜及加工领域来讲,通过调控海参自溶,避免不必要的营养损失,并提升产品质量显得尤为重要。目前,海参自溶过程的评价体系还不完善,尚未建立海参自溶的评价指标。基于此,本研究旨在从主要化学成分变化的角度出发,从宏观上分析海参的两大化学成分——蛋白质和糖分在自溶过程中的变化规律,以期建立海参自溶的评价指标,为海参自溶的调控和机理研究奠定理论基础。
1 材料与方法
1.1 原料与试剂
鲜活海参,购于大连长兴水产品市场;牛血清蛋白,Fluka(Switzerland)产品;葡萄糖,购于天津博迪化工有限公司。试验所用其他试剂均为分析纯。
1.2 主要仪器
UV-2100型分光光度计,UNIC,USA;PHS-3型精密pH计,上海雷磁仪器厂;Z323K型冷冻离心机,HERMLE,GERMANY;JJ 200Y型精密电子天平,美国双杰兄弟集团有限公司;202232S型电热恒温干燥箱,上海跃进医疗器械厂;HH-6型数显恒温水浴锅,江苏金坛荣华仪器制造有限公司。
1.3 试验方法
1.3.1 自溶海参样品的制备
鲜活海参杀死后,分别取体壁和肠两部分,洗净后匀浆。紫外线(30 W,0.5 m)照射30 min后,取5 g样品,在不同温度(4~70 ℃)、pH(2~8)、NaCl质量浓度(0~30 mg/mL)和液料比(1~14 mL/g)的条件下,使其自溶4 h,即可分别得到相应条件下的自溶样品。匀浆后未经紫外线照射诱导自溶的海参命名为“正常海参”。
1.3.2 TCA可溶性寡肽质量分数的测定
自溶过程采用McIIvaine’s缓冲体系。自溶时间结束后取样,加入2倍体积的10%TCA,室温静置20 min,13 500 r/min离心10 min,取上清液,采用福林-酚法[6]测定,并根据牛血清蛋白标准曲线计算TCA可溶性寡肽的质量分数(mg/g)(干基)。
1.3.3 溶出总糖及还原糖质量分数的测定
自溶过程均采用去离子水体系。自溶完毕后取样,13 500 r/min离心10 min,取上清液,分别采用苯酚-硫酸法测定总糖和3,5-二硝基水杨酸法测定还原糖[7],并根据葡萄糖标准曲线计算二者的质量分数(mg/g)(干基)。
1.3.4 数据分析
为了避免海参个体差异所引起的各成分的组间差别,更好地反映各主要化学成分的变化情况,在分析海参自溶过程中主要化学成分的溶出情况时,以各组正常海参中TCA可溶性寡肽和总糖为1,计算各自溶样品主要化学成分的溶出倍数。此外,由于还原糖为总糖的一部分,计算还原糖的溶出倍数时以相应的正常海参总糖质量分数为基数。在分析各因素对海参主要化学成分变化的影响时,以主要化学成分的相对溶出率表示,即TCA可溶性寡肽相对溶出率、总糖相对溶出率及还原糖相对溶出率。计算公式为
化学成分相对溶出率=
式中,化学成分分别指TCA可溶性寡肽、总糖及还原糖。
2 结果与分析
2.1 海参自溶过程中主要化学成分的溶出情况
本研究分别考察了紫外线诱导的海参体壁和海参肠在自溶过程中其主要化学成分的变化情况,目的在于比较二者的不同之处,为海参加工提供必要的理论依据。由图1可见,随着自溶过程的进行,与新鲜海参相比,体壁和肠中的TCA可溶性寡肽、总糖及还原糖的溶出量逐渐提高,至4 h时达到平台期。其中,TCA可溶性寡肽的溶出量分别提高至正常组水平的(2.02±0.16)和(4.16±0.07)倍,总糖的溶出量分别提高了33.3%和36.5%。此外,海参体壁在自溶中溶出还原糖的量极低;而海参肠在自溶中溶出的糖类主要以还原糖为主,且还原糖质量分数提高了55.2%(4 h)。由此可见,在自溶过程中,海参体壁和肠的蛋白质均发生显著降解,海参体壁总糖溶出率较高,海参肠内多糖降解显著。因此,在进一步研究中,分别考察这些方面的变化情况。

自溶条件:TCA可溶性寡肽:McIIvaine’s缓冲体系,50 ℃、pH 7.0(A)或pH 5.0(B)、25 mg/mL NaCl(A)或0 NaCl(B)及液料比3∶1;溶出总糖和还原糖:去离子水体系,50 ℃(A)或40 ℃(B)、液料比8∶1及0 NaCl
2.2 不同pH下海参自溶过程中主要化学成分的溶出情况
pH对海参体壁和肠自溶过程中蛋白质的降解、总糖溶出和多糖的降解有显著的影响(图2)。海参体壁在不同pH条件下自溶时,TCA可溶性寡肽和总糖溶出量的变化趋势基本一致,均在pH 6.0时相对较高。对于海参肠自溶来讲,在酸性条件下TCA可溶性寡肽溶出量相对较高,而还原糖的变化趋势恰好相反,二者分别于pH 5.0和7.0时达到最大值。
2.3 不同温度下海参自溶过程中主要化学成分的溶出情况
海参体壁和肠自溶过程中大分子蛋白质的降解程度均受温度变化的影响,且TCA可溶性寡肽溶出量变化趋势相似,均在温度为50 ℃时达到最大值(图3)。同时,海参肠自溶过程中还原糖的溶出也随温度的升高而发生变化,温度为40 ℃时溶出量最大。然而,海参体壁中总糖的溶出基本不受温度变化的影响。

自溶条件:TCA可溶性寡肽:McIIvaine’s缓冲体系,50 ℃、4 h、25 mg/mL NaCl(A)或0 NaCl(B)及液料比3∶1;溶出总糖和还原糖:去离子水体系, 50 ℃(A)或40 ℃(B)、4 h、液料比8∶1及0 NaCl

自溶条件:TCA可溶性寡肽:McIIvaine’s缓冲体系,pH 6.0(A)或pH 5.0(B)、4 h、25 mg/mL NaCl(A)或0 NaCl(B)及液料比3∶1;溶出总糖和还原糖:去离子水体系,4 h、液料比8∶1及0 NaCl
2.4 不同NaCl质量浓度下海参自溶过程中主要化学成分的溶出情况
NaCl能激活某些蛋白酶,从而促进大分子蛋白质的降解。虾肉在自溶过程中TCA可溶性寡肽的质量分数受NaCl质量浓度的影响,质量浓度为25 mg/mL时,蛋白质的降解相比NaCl质量浓度为0时更加明显[8]。本研究发现,NaCl对海参体壁蛋白质降解有一定影响,在20 mg/mL时,TCA可溶性寡肽的溶出量相对较高,但对海参肠却无影响(图4),海水中NaCl约为30 mg/mL,这可能与海参的生长环境有关。NaCl对自溶过程中体壁总糖的溶出无明显影响,但肠还原糖的溶出却随NaCl质量浓度的不断增加而逐渐降低。
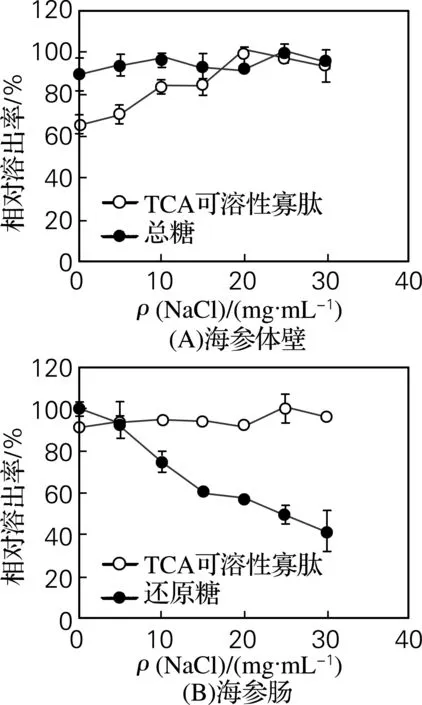
自溶条件:TCA可溶性寡肽:McIIvaine’s缓冲体系,50 ℃、pH 6.0(A)或pH 5.0(B)、4 h及液料比3∶1;溶出总糖和还原糖:去离子水体系,50 ℃(A)或40 ℃(B)、4 h及液料比8∶1
2.5 不同液料比条件下海参自溶过程中主要化学成分的溶出情况
随着液料比的提高,海参体壁TCA可溶性寡肽和海参肠还原糖的溶出率先增大后减小,说明在一定的液料比条件下,体壁蛋白质和肠大分子糖类的降解程度最大(图5)。体壁自溶过程中总糖的溶出不受液料比变化的影响,而肠自溶过程中蛋白质的降解程度却随着液料比的增大而逐渐减小。说明在利用自溶产业化开发海参肠多肽类产品时,可不必添加过多的溶剂,利用其自身的水分即可。

自溶条件:TCA可溶性寡肽:McIIvaine’s缓冲体系,50 ℃、pH 6.0(A)或pH 5.0(B)、4 h及25 mg/mL NaCl(A)或0 NaCl(B);溶出总糖和还原糖:去离子水体系,50 ℃(A)或40 ℃(B)、4 h及0 NaCl
3 讨 论
一般来讲,水产品的自溶与内源酶关系密切,海参内源酶可能也参与到海参的自溶过程中。自溶体系的pH对内源酶和底物的结构、解离状态及结合状态都会产生影响[9]。研究发现,海参体壁组织蛋白酶B和L的最适反应pH分别为5.5和5.0[10-11];海参肠道β-1,3-葡聚糖酶的最适反应pH为5.0~6.0[12-13],接近海参自溶过程中体壁TCA可溶性寡肽及肠还原糖相对溶出率达到最大时的pH。温度对内源酶的活力也有重要影响,海参体壁半胱氨酸蛋白酶、组织蛋白酶B和L的最适反应温度均在50 ℃左右[10-11,14],接近海参自溶过程中体壁TCA可溶性寡肽相对溶出率达到最大时的温度;而海参肠β-1,3-葡聚糖酶的最适反应温度为40 ℃[12-13],也接近于自溶过程中海参肠还原糖相对溶出率达到最大时的温度。此外,自溶过程中海参肠还原糖的溶出随着NaCl质量浓度的不断增加而逐渐降低,这可能由于NaCl可降低海参肠中可降解多糖的糖苷酶的活性所引起的。另外,海参自溶过程受液料比的影响,是因为适宜的液料比决定着自溶过程中可能起作用内源酶的浓度[15]。液料比小,酶分子不能自由移动;液料比大,酶浓度小,这两种条件下,酶均不能与大分子蛋白质和碳水化合物充分接触,从而得不到充分的降解。关于各种内源酶与海参自溶的关系还有待于进一步的系统研究。
4 结 论
在海参体壁和肠自溶过程中,两大营养成分——蛋白质和糖类均发生不同程度的变化。总结海参自溶过程中(4 h)主要成分的变化规律如下:①不论海参体壁还是海参肠,自溶中TCA可溶性寡肽的溶出率均提高,并且受温度、pH的影响;②海参体壁的自溶过程中,总糖的溶出率增加,但仅受pH的影响;③海参肠的自溶中,还原糖溶出率提高,并且受温度、pH和NaCl浓度的影响。因此,可以利用TCA可溶性寡肽溶出率作为海参自溶过程的评价指标,同时,还可采用还原糖溶出率作为海参肠自溶过程的评价指标。
综上所述,在海参加工、贮运过程中,要保证海参的鲜活状态时,需要控制自溶,应限制在较低的温度,pH可以控制在偏碱性范围内,而且要尽量避免阳光的照射,避免紫外线对海参体壁和海参肠自溶产生诱导作用。在加工即食海参等制品时,温度要超过60 ℃以上,以抑制海参自溶酶活性,进而保证产品具有良好的形态。利用自溶时,可采用紫外线诱导,温度应控制在37~60 ℃,pH应控制在4~7,这常作为多种活性成分开发的前处理工序,再辅以不同的外源酶可制备海参多肽、海参黏多糖等。利用海参自身内源酶系的作用,可大大提高生物活性物质的提取率,并节约生产成本。
[1] 廖玉麟. 我国的海参[J]. 生物学通报, 2001, 35(9):1-4.
[2] 杨阳. 海参的食疗价值[J]. 山东食品科技, 2003(7):18.
[3] ZHU Beiwei, ZHENG Jie, ZHANG Zongshen, et al. Autophagy plays a potential role in the process of sea cucumber body wall “melting” induced by UV irradiation[J]. Wuhan University Journal of Natural Sciences, 2008, 13(2):232-238.
[4] SAN MIGUEL-RUIZ J E, GARCA-ARRARS J E. Common cellular events occur during wound healing and organ regeneration in the sea cucumberHolothuriaglaberrima[J]. BMC Developmental Biology, 2007, 7(1):115.
[5] MURRAY G, GARCIA-ARRARAS J E. Myogenesis during holothurian intestinal regeneration[J]. Cell and Tissue Research, 2004, 318(3):515-524.
[6] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the folin phenl reagent[J]. The Journal of Biological Chemistry, 1951, 193(1):265-275.
[7] 张惟杰. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社, 1999:10-12.
[8] EAKPETCH P, BENJAKUL S, VISESSANGUAN W, et al. Autolysis of pacific white shrimp (Litopenaeusvannamei) meat: characterization and the effects of protein additives[J]. Journal of Food Science, 2008, 73(2):S95-S103.
[9] 孔美兰,吉宏武,章超桦. 罗非鱼下脚料自溶条件的初步探讨[J]. 湛江海洋大学学报, 2005, 25(4):27-31.
[10] 赵露露,董秀萍,于蕾,等. 海参体壁组织蛋白酶B酶学性质的研究[J]. 食品研究与开发, 2008, 29 (8):5-9.
[11] ZHU Beiwei, ZHAO Lulu, SUN Liming, et al. Purification and characterization of a cathepsin L-like enzyme from the body wall of the sea cucumberstichopusjaponicus[J]. Bioscience Biotechnology Biochemistry, 2008, 72(6):1430-1437.
[12] 赵军岗,董秀萍,朱蓓薇,等. 海参肠道β-1, 3-葡聚糖酶的提取条件及其酶学性质[J]. 大连轻工业学院学报, 2007, 26(4):289-293.
(ZHAO Jun-gang, DONG Xiu-ping, ZHU Bei-wei, et al. Extraction and properties of β-1,3-glucarase from gut of sea cucumber[J]. Journal of Dalian Institute of Light Industry, 2007, 26(4):289-293.)
[13] ZHU Beiwei, ZHAO Jungang, YANG Jingfeng, et al. Purification and partial characterization of a novel β-1, 3-glucanase from the gut of sea cucumber stichopusjaponicus[J]. Process Biochemistry, 2008, 43(10):1102-1106.
[14] QI Hang, DONG Xiuping, CONG Lina, et al. Purification and characterization of a cysteine-like protease from the body wall of the sea cucumberstichopusjaponicus[J]. Fish Physiology and Biochemistry, 2007, 33(2):181-188.
[15] 曹文红,章超桦,洪鹏志,等. 响应面法优化南美白对虾虾头自溶工艺的研究[J]. 中国食品学报, 2009, 9(1):158-164.
——细胞生长因子

