红麻原生质体分离条件的优化
王 丽 爽,张 宗 申,郑 来 久
( 1.大连工业大学 生物与食品工程学院, 辽宁 大连 116034;2.大连工业大学 纺织轻工学院, 辽宁 大连 116034 )
0 引 言
红麻(HibiscuscannabinusL.)是锦葵科木槿属一年生纤维植物,其优点是生长周期短,植株高大粗壮,干物质积累快,单位面积的生物学产量大(为树木的3~4倍),具有耐旱、耐贫瘠、耐盐碱、易栽培、纤维产量高等特性,广泛应用于麻纺、造纸、建材、麻塑、吸污、饲料、食用等领域[1]。红麻综合利用潜在市场巨大,被发达国家视为21世纪优势作物。近10年来,尽管我国育成的红麻新品种数量较多,但大部分新品种的经济寿命只有4~6 年,限制了种植面积的扩大;另外,红麻为异花授粉作物,异交率低,很难利用传统的育种方法在短时间内得到优良种质资源。因此,利用现代生物技术对红麻种质扩增、改良和创新,以解决目前红麻育种与生产中的急迫问题具有重要意义[2]。
原生质体融合是转移基因组、获得遗传重组的一种新方法,也是实现胞质基因重组的途径,可以克服传统育种技术的周期长、远缘不亲和等缺点[3]。分离高质量原生质体是进行原生质体融合的前提,而原生质体产量和活力在很大程度上取决于材料来源、水解酶组合、酶解时间等因素[4-5]。目前,国内外对植物红麻原生质体的制备、纯化及融合的研究很少。本文对影响红麻原生质体产量、活力的因素进行了初步探讨,旨在确定红麻原生质体分离的适宜条件,为进一步利用细胞融合技术改良红麻种质提供理论依据。
1 材料与方法
1.1 愈伤组织诱导与培养
选取子粒饱满的红麻种子,在75%的酒精中消毒30 s后,用0.1%的升汞处理15~20 min,无菌水冲洗4~5次,然后接种于1 mg/L 2,4-D的MS固体培养基上[6],25 ℃黑暗条件下诱导愈伤组织。诱导出的愈伤组织转入0.5 mol/L 2,4-D+0.1 mol/L 6-BA+40 g/L蔗糖+8 g/L琼脂的MS培养基上继代培养,用作原生质分离的材料。
1.2 原生质体的分离、纯化
参考文献[7]方法,略有改动。取继代12 d质地疏松的白色愈伤组织,用CPW-13M (组成为130 g/L甘露醇,1.48 g/L CaCl2·2H2O,5 mmol/L MES等,pH 5.8) 处理0.5 h,使植物细胞发生轻微质壁分离,再投入一定含量的纤维素酶Cellulase R-10 (Japan) 和果胶酶Pectolase Y-23 (Japan)的酶液中(均用CPW-9M甘露醇溶液配制,pH 5.8,见表1、2),置于50 r/min的水平摇床上,在(28±1) ℃黑暗条件下酶解。以原生质体的产量和细胞碎片为指标,筛选最佳的酶解条件。将分离后的原生质体用50 μm(300目)孔径的丝网过滤,滤液在500 r/min离心5 min,弃上清液。原生质体悬浮于CPW-9M洗涤液中,用21%蔗糖(pH 5.8)溶液离心(500 r/min,5 min)漂浮纯化原生质体。漂浮的原生质体吸至新管中,用CPW-9M洗涤液洗涤1次,再用原生质体培养液(MS+0.6 mol/L甘露醇+ 0.5 mg/L 2,4-D,pH 5.8)洗涤1次,即可获得纯化的红麻原生质体。
1.3 原生质体活力测定
采用荧光素二醋酸酯(FDA)染色法测定原生质体的活力。取“1.2”制备的原生质体悬浮液0.5 mL,置于1 mL的小试管中,加入FDA溶液使其最终质量分数为0.01%,混匀,室温孵育5 min,然后在荧光显微镜(Motic AE31,中国厦门)下观察、计数。以原生质体存活率代表原生质体活力,按式(1)计算原生质体存活率。每个样品重复观测3次,最后取其均值。
原生质体活力(%)=(存活的原生质体数÷原生质体总数)×100%
(1)
1.4 原生质体产量测定
将“1.2”收集得到的原生质体稀释2~5倍后,用血球计数板法计数[8]。按式(2)、(3)计算原生质体密度和原生质体产量,每个样品重复3次。
原生质体密度(个/mL)=(5大格内原生质体总数/5)×104×稀释倍数
(2)
原生质体产量(个/g)=[原生质体密度(个/mL)×稀释后体积(mL)]÷细胞总质量(g)
(3)
2 结果与分析
2.1 酶液组合对原生质体分离效果的影响
将在培养基上继代培养12 d,白色、组织疏松的红麻愈伤组织分别置于表1所示的(1)~(6)水解酶液中。在质量分数分别为1%、2%和3%的纤维素酶液中,以2%纤维素酶的水解效果最好,得到的原生质体比较完整、产量较多。在2%纤维素酶的基础上添加果胶酶,从表中可以看出两种酶共同作用更有利于红麻原生质体的分离,其中以2%纤维素酶+1.0 %果胶酶组合的水解效果为好。在上述组合的基础上添加1.0 %半纤维素酶,原生质体的产量有所降低,并有少数的原生质体破碎。因此,在后面的实验中,采用纤维素酶+果胶酶的组合来制备红麻的原生质体。
表1 水解酶组合对原生质体分离的影响
Tab.1 Effects of combination of lytic enzymes on isolation of protoplasts

酶液原生质体产量原生质体状态(1)1%纤维素酶(2)2%纤维素酶(3)3%纤维素酶(4)2%纤维素酶+0.5%果胶酶(5)2%纤维素酶+1.0%果胶酶(6)2%纤维素酶+1.0%果胶酶+1.0%半纤维素酶++++++++++++++++完整完整较多破碎完整基本完整少数破碎注:“+”表示原生质体少,“++”表示较多,“+++”表示非常多,“++++”表示极多。
2.2 酶浓度对原生质体分离效果的影响
在确定了酶液组合的基础上,采用不同浓度的纤维素酶和果胶酶组合酶解红麻愈伤组织,其游离原生质体的产量明显不同(表2)。原生质体产量随着纤维素酶浓度的提高而增加,但细胞碎片也相应增多;当纤维素酶质量分数达到3.0%时,原生质体产量下降,细胞碎片明显增多。在相同的纤维素酶质量分数下,1.0%的果胶酶明显高于0.5%的果胶酶。综合考虑,水解红麻细胞壁的最佳水解酶组合为2.0%纤维素酶+1.0%果胶酶。
表2 酶液质量分数对原生质体分离的影响
Tab.2 Effects of enzyme concentration on isolation of protoplasts
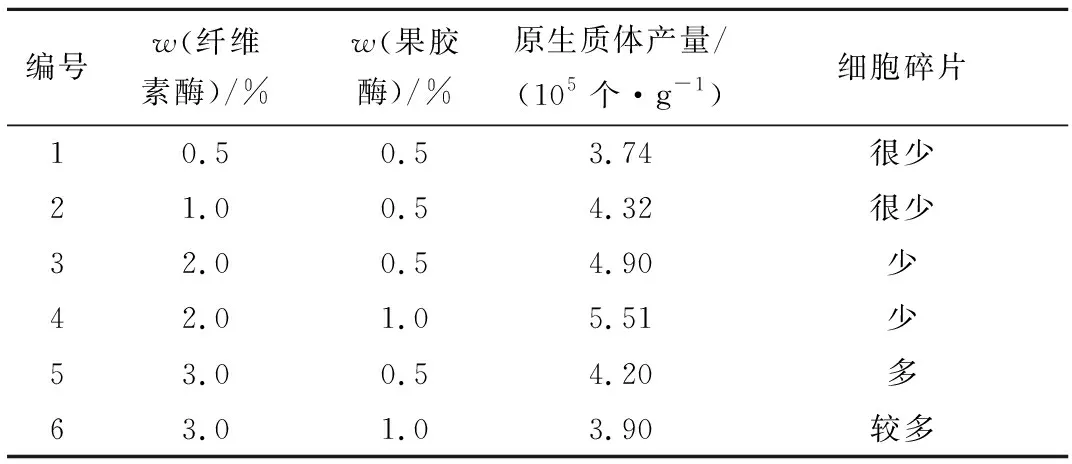
编号w(纤维素酶)/%w(果胶酶)/%原生质体产量/(105个·g-1)细胞碎片10.50.53.74很少21.00.54.32很少32.00.54.90少42.01.05.51少53.00.54.20多63.01.03.90较多
2.3 酶解时间对分离原生质体的影响
在2%纤维素酶和1%果胶酶组成的酶解溶液中,将红麻愈伤组织经过3、4、5、6、7和8 h等不同时间的酶解处理,然后观察原生质体产量和活力。由表3可知,随着酶解时间的增加,原生质体产量先增加后降低;当酶解6 h时,能够释放大量原生质体,原生质体产量最高;超过6 h后,悬浮液中原生质体破裂加速,细胞碎片显著增加。在原生质体活力方面,酶解时间过长会降低其活力,酶解3~6 h所得到的原生质体活力下降速度较慢,超过6 h则显著下降。综合考虑酶解时间对原生质体产量和活力的影响,认为在此试验条件下水解6 h是制备大量红麻原生质体的最佳时间,其产量为5.51×105个/g,活力为63.6%(图1)。
表3 不同酶解时间对原生质体分离的影响
Tab.3 Effects of different enzymolysis time on isolation of protoplasts

t(酶解)/h原生质体产量/(105个·g-1)原生质体活力/%30.8975.342.6773.153.8669.765.5163.673.6746.981.2135.8
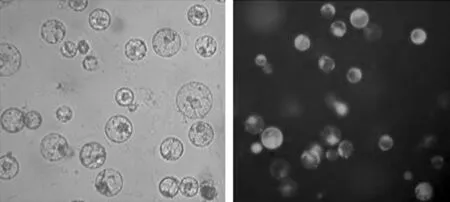
图1 红麻愈伤组织经过酶解6 h获得的原生质体
2.4 pH值对原生质体产量的影响
不同pH值的水解酶液对红麻愈伤组织制备高活力原生质体的影响很大。当pH值为5.8时,产量最高,细胞碎片很少;pH值高于或低于5.8时,制备的原生质体数量和活性均有下降;当pH小于5.0时,很难分离出完整的原生质体;pH升至6.4以上,由于pH值过高导致酶活性降低,虽然细胞碎片较少但产量很低。因此pH值为5.8是分离红麻愈伤组织原生质体最适pH值(图2)。
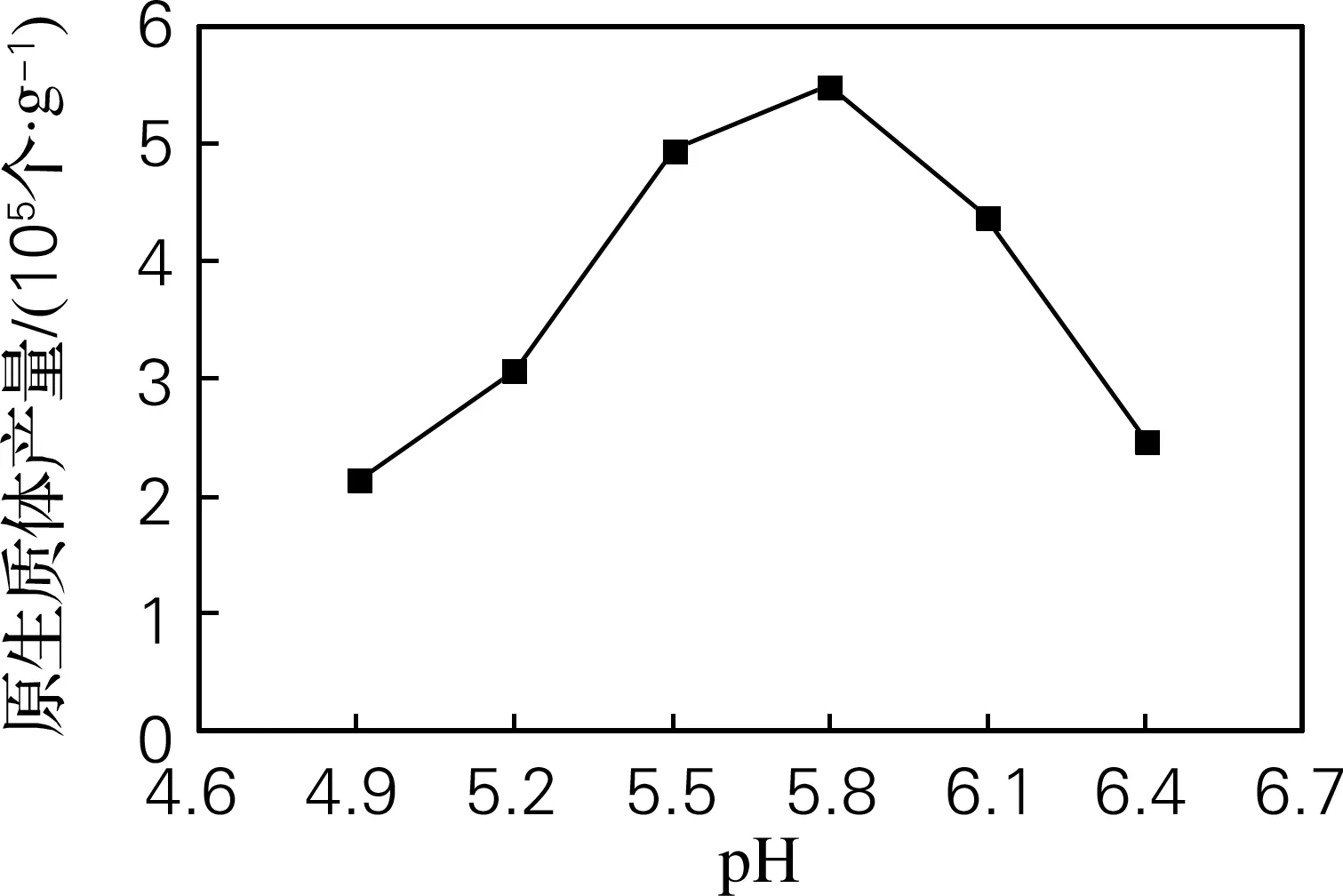
图2 酶解液pH对红麻原生质体产量的影响
Fig.2 Effects of digesting solution pH on the yield of protoplasts isolated fromHibiscuscannabinusL.
2.5 不同甘露醇浓度对原生质体产量的影响
植物细胞除去细胞壁后,如果酶液中的渗透压和细胞内的渗透压不平衡,会导致原生质体涨破或收缩。因此,在配制水解酶液、洗液和培养液中,加入一定浓度的渗透压稳定剂,使胞外渗透压大致与原生质体内的渗透压相同或相近。广泛使用的渗透压调节剂有甘露醇、山梨醇、蔗糖、葡萄糖或麦芽糖,其浓度在0.4~0.6 mol/L,都具有相似的稳定渗透压的作用。另外,在上述溶液中加入CaCl2、KH2PO4、MES、葡聚糖硫酸钾等物质有助于提高原生质膜的稳定性。
本研究选择甘露醇作为渗透压稳定剂。结果表明,当甘露醇浓度为0.55 mol/L时,原生质体的产量最高,并且获得的原生质体形状、大小基本一致,边缘清晰,内含物多,细胞碎片少。高于或低于这一浓度原生质体产量均有所下降,故甘露醇浓度为0.55 mol/L时制备红麻愈伤组织原生质体较适宜(图3)。
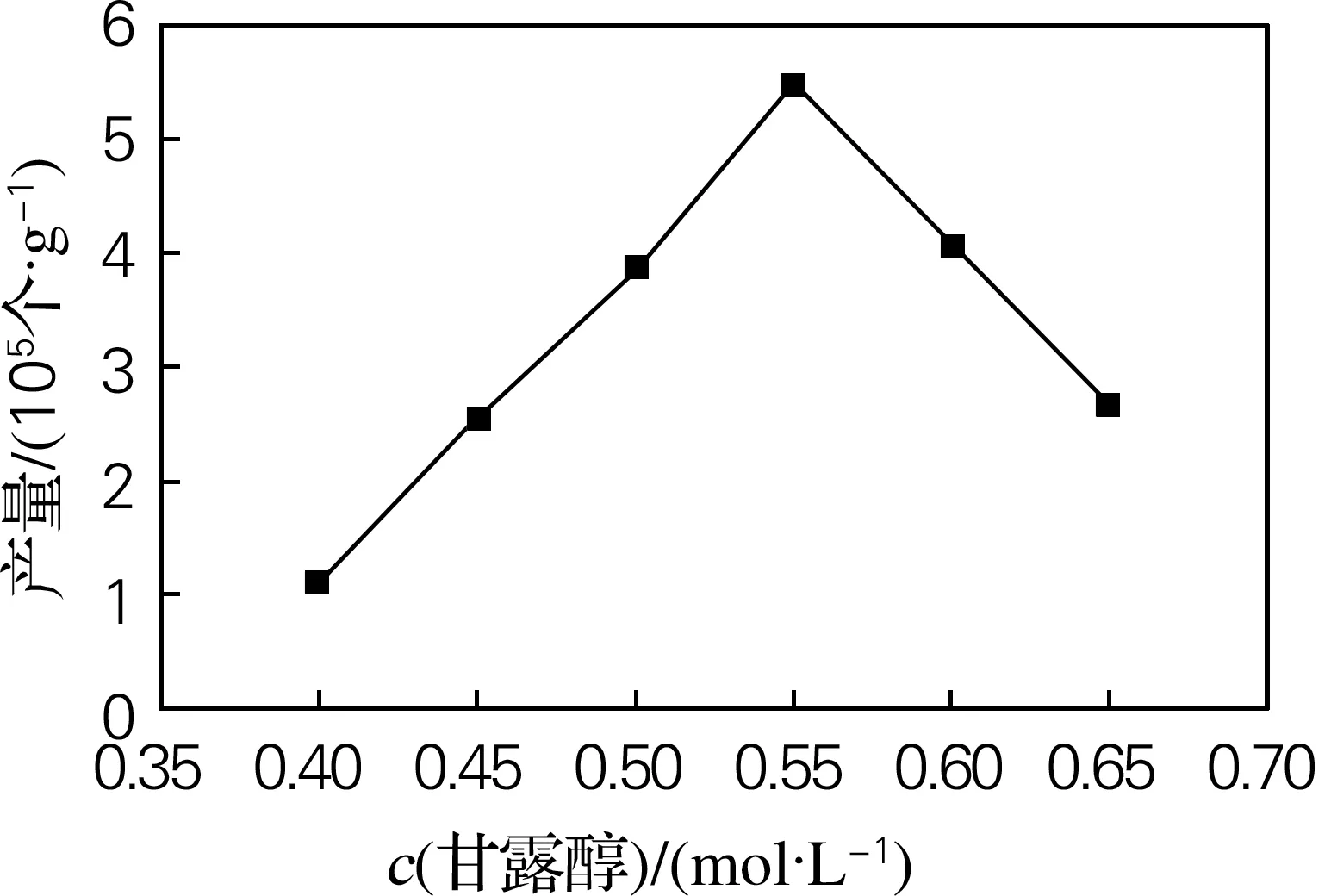
图3 甘露醇浓度对红麻原生质体产量的影响
Fig.3 Effects of mannitol concentration on the yield of protoplasts isolated fromHibiscuscannabinusL.
3 结 论
水解酶组合是影响红麻原生质体分离效果的最直接因素;采用继代5~10 d的红麻愈伤组织,在pH 5.8的2.0%纤维素酶+1.0%果胶酶+0.55 mol/L甘露醇的混合水解酶液中水解6 h,得到高产量(5.51×105个/g)和高活力(63.6%)的原生质体,达到了原生质体培养和细胞融合的密度标准。
[1] 程舟,鲛岛一彦,陈家宽. 日本红麻研究、加工利用[J]. 中国麻业, 2001, 23(3):16-24.
[2] 粟建光,戴志刚,龚友才,等. 我国红麻种质资源的遗传多样性与评价利用[J]. 中国麻业, 2004, 26(1):5-9.
[3] 邢朝斌,沈海龙,赵星宇. 刺五加幼叶原生质体的分离法[J]. 植物生理学通讯, 2006, 42(2):288-290.
[4] TIAN Zhihong, MENG Jinling. Plant regeneration from cultured protoplasts ofMoricandianitens[J]. Plant Cell, Tissue and Organ Culture, 1998, 55(3):217-221.
[5] TALLMAN G. Guard cell protoplasts:isolation, culture, and regeneration of plants[J]. Methods in Molecular Biology, 2006, 318:233-252.
[6] 杨芳,张宗申,孙磊,等. 促进丹参悬浮培养细胞生长和水溶性酚酸含量的因素[J]. 昆明理工大学学报, 2008, 33(3):96-97.
[7] 刘强,张宗申,丛丽娜,等. 黄芪原生质体分离技术[J]. 广西植物, 2008, 28(3):411-413.
[8] 赖呈纯,赖钟雄,黄浅,等. 荔枝转基因悬浮细胞再生松散性胚性愈伤组织的原生质体分离与初步培养[J]. 亚热带农业研究, 2007, 3(2):138-139.

