东北矮紫杉体细胞胚的诱导
孙 筱 筠,张 宗 申
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
东北红豆杉(TaxuscuspidateSieb.etZucc)又名紫杉[1],是红豆杉科红豆杉属常绿针叶乔木[2]。矮紫杉(Taxuscuspidate“Nana”)是东北红豆杉的一种变种。近年来,人们从东北红豆杉根、茎、叶中分离出抗癌活性成分——紫杉醇[3-5]。世界许多国家的医学专家研究表明,紫杉醇对食道癌、肺癌、卵巢癌、结肠癌及急性白血病有特殊的防治效果,特别是对晚期卵巢癌和转移性乳腺癌治愈率达33%,总有效率在75%以上。但是红豆杉属植物在自然条件下种子成熟后有长达2年的休眠期,种子萌发率低;再加上属于雌雄异株,自然结种率低,种质资源少[6-7],并且树木分布星散,生长缓慢,因此东北红豆杉的繁殖途径亟待改善。尽管目前有一些关于东北红豆杉组织培养的研究报告[8-9],但国内尚未有利用体细胞胚胎发生途径来实现东北红豆杉的快速繁殖。本文建立了矮紫杉体细胞胚发生和培养体系,以期为制备人工种子以大量生产矮紫杉植株提供理论依据,达到保护珍稀物种和为园林绿化提供优质种子的目的。
1 材料与方法
1.1 材 料
东北矮紫杉种子,采自大连工业大学校园内。
1.2 方 法
剥去种子的假种皮并在自来水下冲洗干净,于200 mg/L赤霉素溶液中浸泡24 h之后剥离外种皮。在超净工作台中将种子于75%酒精中处理30 s后用0.1% HgCl2灭菌12 min,无菌去离子水冲洗4~5次,在无菌纸上切开一条长2 mm的小口后,分别接种到附加3种植物生长调节剂的MS、B5、mB5[10]培养基上,于(24±1) ℃黑暗培养。待种子完全裂开后,将露出的种胚转接到相应的培养基上诱导愈伤组织。
将诱导出的愈伤组织分别转移至含有mB5+2 mg/L NAA+0.2 mg/L KT (A)、mB5+3 mg/L ZT (B)和mB5(C)的培养基上,于(24±1) ℃继续黑暗培养,研究不同植物生长调节剂组合对东北矮紫杉体细胞胚产生的影响。
以上所有培养基的pH均为5.6,并添加3%蔗糖、0.7%琼脂。
2 结果与分析
2.1 不同培养基对东北矮紫杉种胚愈伤组织诱导率的影响
将处理好的矮紫杉种子分别接种到MS、B5和mB53种培养基中。这3种培养基中均添加0.5 mg/L 2,4-D、4 mg/L NAA和0.2 mg/L KT。接种60 d后分别统计矮紫杉愈伤组织的诱导率。
mB5培养基中的种子在接种2 d后开始膨胀;4 d后种子的一端开始裂开(图1-b);接种15 d后种子完全裂开并露出种胚(图1-c);20 d后种胚开始膨胀(图1-d);27 d后种胚开始形成愈伤组织(图1-e)。B5培养基中的种子在接种7 d后开始膨大,15 d后种子的一端才开始裂开,40 d后种胚开始形成愈伤组织。而MS培养基中的种子在接种20 d后开始膨大,40 d后种子的一端才开始裂开,并且种子褐变严重,60 d后种胚开始形成愈伤组织。
a,东北矮紫杉种子;b,培养4 d后种子裂开;c,培养15 d后种子完全裂开并露出种胚;d,培养20 d后种胚开始膨胀;e,培养27 d后种胚开始形成愈伤组织;f,生长迅速的愈伤组织;g,白色颗粒状愈伤组织;h,生长迅速的白色颗粒状愈伤组织;i,球状胚性细胞团 (bar=25 μm)
图1 从种子中诱导体细胞胚
Fig.1 Initation and development of somatic embryo from the seeds ofTaxuscuspidateSieb.etZucc
由表1可以看出以mB5+0.5 mg/L 2,4-D+4 mg/L NAA+0.2 mg/L KT为培养基的种子愈伤组织诱导率最高,达66.7%。
表1 不同基本培养基对东北矮紫杉种胚愈伤组织诱导的影响
Tab.1 The effects of basic medium on the induction of callus from the mature embryo ofTaxuscuspidate
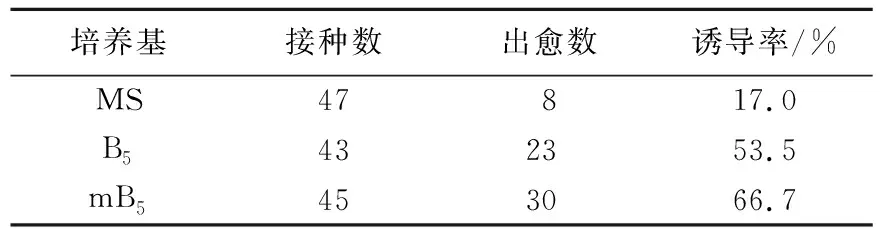
培养基接种数出愈数诱导率/%MS47817.0B5432353.5mB5453066.7

2.2 植物生长调节剂对东北矮紫杉种胚愈伤组织诱导率的影响2.2.1 生长素类植物生长调节剂的影响
根据“2.1”的结果,选用mB5作为实验植物生长调节剂效果的基本培养基。在其中添加不同质量浓度的2.4-D和NAA以及它们的组合,培养30 d后统计其愈伤组织诱导率,结果如表2、3所示。
表2 单因素植物生长调节剂对东北矮紫杉种胚愈伤组织诱导的影响
Tab.2 The effects of single plant growth regulator on the induction of callus from the mature embryo ofTaxuscuspidate
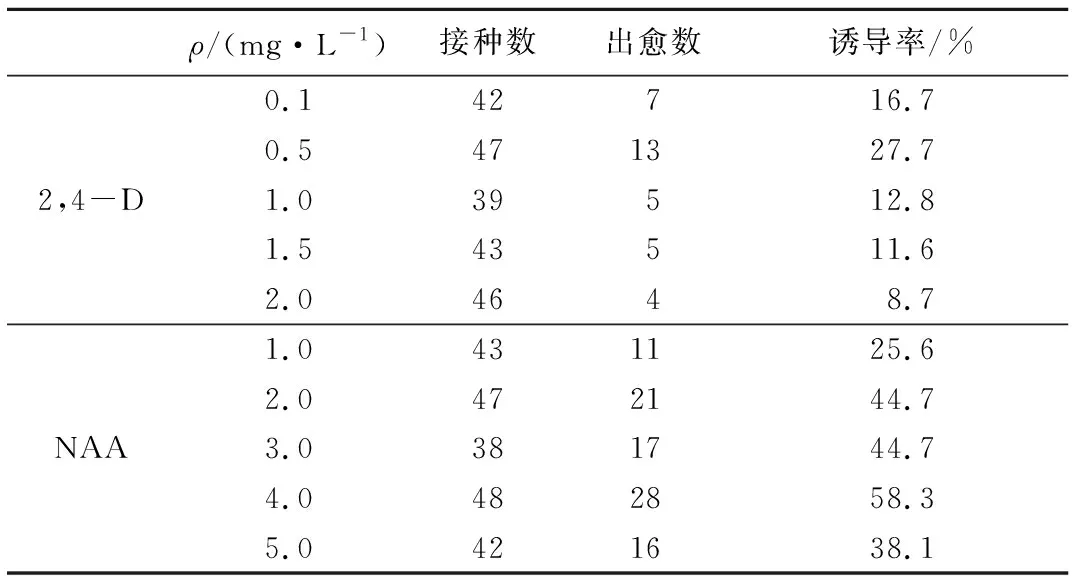
ρ/(mg·L-1)接种数出愈数诱导率/%0.142716.70.5471327.72,4-D1.039512.81.543511.62.04648.71.0431125.62.0472144.7NAA3.0381744.74.0482858.35.0421638.1
由表2可以看出,在培养基中添加NAA比较适合诱导愈伤组织,随着NAA质量浓度的增加,愈伤组织的诱导率也明显提高。当NAA质量浓度达到4 mg/L时,愈伤组织的诱导率达到最高,为58.3%;但是当质量浓度升高到5 mg/L时诱导率明显下降,并且种子褐变严重。而单独添加2,4-D对愈伤组织的诱导率影响不明显。步营等[13]在研究盆栽膜荚黄芪愈伤组织生长中也发现NAA在诱导愈伤组织的过程中起着决定性的作用,但单独添加2,4-D对其愈伤组织生长的影响并不显著,本文结果与之一致。
表3 双因素植物生长调节剂对东北矮紫杉种胚愈伤组织诱导的影响
Tab.3 The effects of double factors on the induction of callus from the mature embryo ofTaxuscuspidate
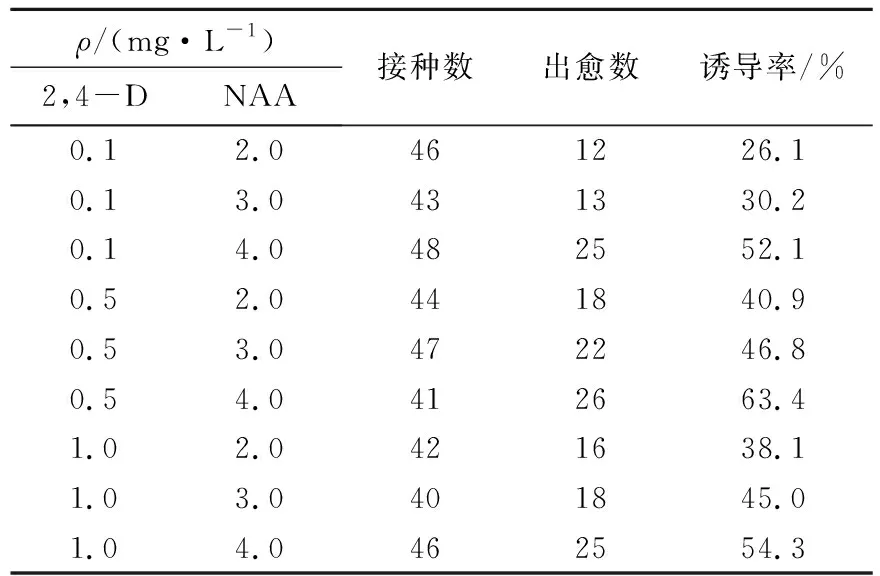
ρ/(mg·L-1)2,4-DNAA接种数出愈数诱导率/%0.12.0461226.10.13.0431330.20.14.0482552.10.52.0441840.90.53.0472246.80.54.0412663.41.02.0421638.11.03.0401845.01.04.0462554.3
由表3可以看出,同时添加2,4-D和NAA更有助于愈伤组织的诱导,其中mB5+0.5 mg/L 2,4-D+4.0 mg/L NAA的诱导率最高为63.4%。
2.2.2 KT对诱导率的影响
在mB5+0.5 mg/L 2,4-D+4.0 mg/L NAA的培养基中添加不同质量浓度的KT,研究其对矮紫杉种胚愈伤组织诱导率的影响,结果如表4所示。
表4 KT对东北矮紫杉种胚愈伤组织诱导的影响
Tab.4 The effect of KT on the induction of callus from the mature embryo ofTaxuscuspidate
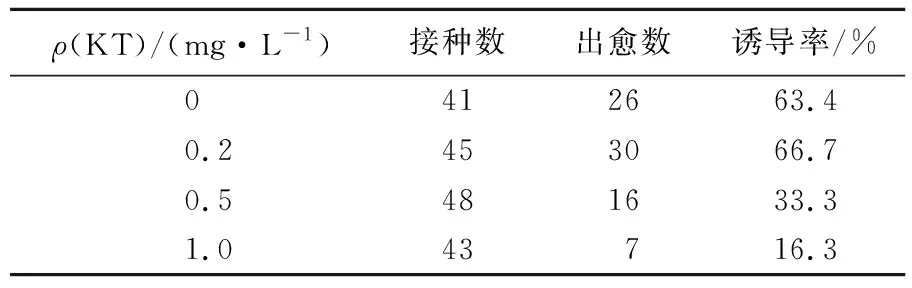
ρ(KT)/(mg·L-1)接种数出愈数诱导率/%0412663.40.2453066.70.5481633.31.043716.3
结果表明,KT的质量浓度对愈伤组织诱导率有一定的影响。其中添加0.2 mg/L KT对愈伤组织的诱导更为有利,但随着KT质量浓度的增加诱导率下降,并且愈伤组织褐变严重。
2.3 植物生长调节剂对东北矮紫杉体细胞胚发生的影响将从种胚中诱导的愈伤组织分别转入到培养基A、B、C上继续培养。培养20 d后,在培养基B上的愈伤组织表面上出现白色的颗粒状培养物(图1-g),且生长迅速(图1-h);而培养基A上的愈伤组织在40 d后才呈现这种状态,并且生长缓慢;培养基C中的愈伤组织始终无此现象发生。经显微观察发现,培养基A和B上的愈伤组织均为胚性组织,可以观察到球状细胞团(图1-i)。
虽然2,4-D作为细胞分裂素对于胚性组织的诱导是不可缺少的,但是大量研究表明在胚性组织的增殖阶段,应该及时的去掉或降低2,4-D浓度,既有利于胚性组织的增殖,也有利于后期的胚胎发生。因此在培养基A中去掉了2,4-D。崔凯荣等[14]对枸杞体细胞胚发育的研究表明,胚性愈伤组织形成后,如不及时转入去除2,4-D的培养基中,则胚性细胞就不能进入体细胞胚胎发育。
3 结 论
mB5(pH 5.6,添加3%蔗糖、0.7%琼脂)培养基较适合诱导东北矮紫杉种子的愈伤组织;而NAA对于东北矮紫杉种子诱导愈伤组织过程中起着决定性的作用,随着NAA浓度的增加,愈伤组织的诱导率也明显提高;在黑暗条件下,mB5+0.5 mg/L 2,4-D+4 mg/L NAA+0.2 mg/L KT培养基上成功诱导出大量的愈伤组织,诱导率达66.7%。
在诱导东北矮紫杉体细胞胚的过程中发现,在mB5培养基上添加3 mg/L ZT适合诱导体细胞胚的发生。这可能是由于玉米素(Zeatin)是原始天然细胞分裂素,能够促进细胞的分裂和扩大、促进生长、解除某些需光种子的休眠。但在本实验中所诱导出的体细胞胚多处于球形期,是胚状体的发育早期阶段,并没有培养出发育成熟的体细胞胚,今后对于如何进一步促进东北矮紫杉体细胞胚的成熟有待于继续探索。本结果为以体细胞胚为繁殖体制备人工种子、从而快速生产出优质的矮紫杉植株提供了重要依据。
[1] 乔艺,郑春雨. 浅谈东北红豆杉[J]. 吉林蔬菜, 2007(5):78-79.
[2] 周志强,胡丹,刘彤. 天然东北红豆杉种群生殖能力与开花结实特性[J]. 林业科学, 2009, 45(5):80-86.
[3] 李伯林,赵群华,卢山,等. 红豆杉植物愈伤组织的培养及其紫杉醇形成初探[J]. 南京大学学报, 1995, 31(3):424-429.
[4] 吴晓庆,奇云. 抗肿瘤新药紫杉醇研究进展[J]. 中国生化药物杂志, 1996, 17(3):131-135.
[5] 梁敬钰. 国外紫杉醇研究进展[J]. 生物工程进展, 1993, 13(4):19-20.
[6] ZHIRI A, JAZIRI M, HOMES J, et al. Factors affecting the in vitro rapid germination of Taxus embryos and the evaluation of taxol content in the plantlets[J]. Plant Cell Tissue and Organ Culture, 1994, 39(3):261-263.
[7] 陈庆红,陈庆瑛,黄利亚,等. 东北红豆杉开发研究进展[J]. 中国野生植物资源, 2005, 24(1):41-42.
[8] 浩仁塔本,赵颖. 东北红豆杉的组织培养技术研究[J]. 内蒙古林业科技, 2004(3):11-13.
[9] 刘铁燕,刘昀,赵彩凤,等. 东北红豆杉愈伤组织诱导及组织培养研究[J]. 东北师大学报:自然科学版, 2002, 34(2):67-71.
[10] LEE B S, SON S H. A method for the producing taxol and taxanes from embryo cultures of Taxus species: European Patent, WO 9502063[P/OL]. 1995-07-12[2009-10-09]. http://www.wipo.int/pctdb/en/wo.jsp?IA=KR1994000088&DISPLAY=DESC.
[11] 翟晓巧,翟翠娟,刘新凤. 木本植物体细胞胚胎发生及植株再生研究现状[J]. 河南林业科技, 2004, 24(2):7-10.
[12] 张宗申,王子茜. 培养基成分和培养条件对黄芪愈伤组织中黄芪皂苷积累的影响[J]. 大连工业大学学报, 2009, 28(3):174-177.
(ZHANG Zong-shen, WANG Zi-qian. Effects of culture conditions on the saponin accumulation inastragalusmembranaceuscallus[J]. Journal of Dalian Polytechnic University, 2009, 28(3):174-177.)
[13] 步营,陈显化,王子茜,等. 正交法优化植物生长调节剂在黄芪愈伤组织生长中的应用[J]. 时珍国医国药, 2008, 19(4):872-874.
[14] 崔凯荣,邢更生,周功克,等. 植物激素对体细胞胚胎发生的诱导与调节[J]. 遗传, 2000, 22(5):349-354.

