一种碘代二肽胺的体内外评价
何佳恒 罗军益 蹇 源 王关全 刘国平
(中国工程物理研究院核物理与化学研究所 绵阳 621900)
放射性碘标记的单克隆抗体(McAb)作为靶向药物具有许多的优点,但单克隆抗体作为诊断和治疗癌症的载体的多数研究,都建立在动物模型的基础上,用于治疗肿瘤病人的放射性碘标记的 McAb很多是不成功的。主要原因有[1]:肿瘤对药物的吸收率低;药物全身活动性高;药物在血液中清除慢;药物在肿瘤内部扩散受到限制;McAb与肿瘤结合不均匀。
解决放射性核素标记单克隆抗体存在问题的途径,是选择与单克隆抗体相似、而分子量低的分子,当与抗体作用后,能被肿瘤细胞中的一种特定的酶(端粒体酶)吸附在肿瘤表面。拟合成的放射性药物具有以下性质:a) 对正常细胞具有低毒性;b) 肿瘤中细胞毒素的高专一吸收性;c) 增加肿瘤中细胞毒素的分布;d) 能够实现放射性药物向高细胞毒素的高转化率;e) 旁观效应。
小分子肽类放射性药物对受体有特异亲和力,既满足上述要求且具有以下一些优点[2]:a) 肽是许多基本生物功能所必须的物质;b) 在许多情况下,小分子肽与受体的亲和力比抗体和抗体片段更强;c) 小分子肽易于合成,易于结构修饰;d) 很少引起免疫反应;e) 快速的血清除可以提供高的靶/本底比(T/B),特别适于短半衰期核素。
端粒体酶是能以自身 RNA为模板合成端粒重复序列的酶,主要存在于生殖细胞和癌细胞中,在90%癌细胞中呈阳性,而在其他细胞中呈阴性或没有。含有这种酶的细胞可逃避进行性端粒缩短,从而获得无限制生长能力,于是形成肿瘤[3,4]。虽然在末梢淋巴细胞、肠管上皮细胞、造血干细胞等具有自我增殖能力的细胞中,也存在阳性端粒体酶,但其量远不及肿瘤中的阳性端粒体酶的量。因此,可选择一种能亲和端粒体酶的化合物与之反应,使其失活,以达到治疗肿瘤的目的。因此,首先要用能与端粒体酶亲和力较强的化合物作为放射性标记的载体,二肽就是这样一种化合物,并且肽的性质在很多方面与蛋白质有相似之处[2]。此外,肽和蛋白质的放射性标记技术也较成熟;考虑到肿瘤中的相关特定酶,选择适当的氨基酸合成肽也是比较重要的;另外应当增加一些辅助结构,使碘不处于整个目标分子的中心位置,以便进行碘标记。酪氨酸和甘氨酸二肽被认为具有比较好的亲和效果。
前期研究中,我们制备了 p-Boc-Trp-Trp-NH(CH2)6NH-PO(ONH4)-O-Ph131I[5],本工作对它的稳定性、亲脂性、急性毒性以及在正常小鼠体内的分布做了较详细的研究,同时成功建立了VX2肝癌单发肿瘤动物模型,考察了配合物在模型肿瘤部位的分布情况,以探索它作为放射性药物的可能性。
1 材料与方法
1.1 主要试剂及仪器
131I,本所提供;PBS缓冲液,DMEM培养液,10%水合氯醛,安定注射液等生物、化学试剂均为国产分析纯或化学纯。实验所需用水均为二次蒸馏水。
FJ-2021型 γ放射免疫计数器(国营 262厂);CAPINTEC CRC-15R放射性活度测量仪(Denver Instrument Co.);Helix Apex双探头SPECT仪(以色列Elscint Co.);二氧化碳孵化箱,Siemens Sensation 16 CT机,HDI 5000超声仪,Siemens Axiom Artis FA型 DSA(功率 100 kW),MADRAD Mark V Provix 型高压注射器均由华西医院核医学科提供。
新西兰大白兔(一级,体重 3–4 kg,雄性);昆明种小白鼠(一级,体重18±2 g,雌雄各半)均由四川大学华西医学中心动物实验中心提供;VX2种兔购于华中科技大学协和医院,VX2肝癌单发肿瘤动物模型:自行建立。
1.2 配体的合成
通过 7步有机反应合成了二肽分子p-Boc-Trp-Trp-NH(CH2)6NH-PO(ONH4)-O-PhI (化合物7)[6]。合成路线如图1所示:

图1 配体7合成路线图Fig.1 Synthesis of compound 7
1.3 配合物的制备
采用封管法进行了碘的标记。准确称取 8 mg Iodogen溶于8 mL二氯甲烷中,从中取出8 µL涂于 1.5 mL塑料离心管底部,自然风干,可见管底Iodogen铺成一层薄薄的白色沉淀,以此作为反应管。
在反应器中,投入 1 mg p-Boc-Trp-Trp-NH(CH2)6NH-PO(ONH4)-O-PhI和5 mg抗坏血酸,加入 5 µL含有 2.5 µg的乙酸铜溶液和 50 µL的Na131I,置于沸水浴中反应 15 min,冷却之后用KHCO3溶液调pH值到5.5–6.5。再用二氯甲烷萃取,直到水相的放射性不再改变,测定有机相和水相的放射性,从而计算出其标记率约为85%。
将有机相中的有机溶剂蒸干,用生理盐水溶解测定其放射性做动物实验。
1.4 配合物稳定性、亲脂性的考察
将标记好的配合物放置一定时间后,用生理盐水溶解,然后用二氯甲烷溶液萃取,再用等体积的生理盐水进行反萃。如此反复至少3次后,最后比较有机相和无机相中放射性计数的比率。根据放射性碘的脱落情况以考察配合物的稳定性,配合物的脱碘率 K=Cw/Co,Cw为配合物在水相的浓度;Co为配合物在有机相中的浓度。
将标记好的配合物用生理盐水缓冲液(pH≈7)稀释至3 mL,再加入3 mL正辛醇,振荡离心后,取2 mL下层的水相至测量管中放置测量计数。在有机相中再加入3 mL生理盐水振荡离心,弃去水相,再在有机相中加入3 mL生理盐水振荡离心,如此反复不少于5次,最后取2 mL有机相测量计数。分配系数[6]Kow=Co/Cw=No/Nw,Co为配合物在正辛醇相中的浓度,Cw为配合物在水相的浓度,No为正辛醇相中放射性总计数,Nw为水相中放射性总计数。
1.5 配合物对外周血象、肝肾功能影响的考察
由于经典LD50(半致死量)测定耗用动物多,无法对每只动物作仔细检查,实际上药物单次剂量急性中毒,动物多死于中枢神经系统及心血管系统功能障碍,并不能很好地显示出各自的毒性作用特征。再者,急速死亡,各种器质性变化尚未及发展,不能显示出靶器官的病变:如卤代甲烷对小鼠的急性毒性试验,CH3I-碘代甲烷对肝脏毒性很大,比CCl4和 CBr4均大,但动物死于麻醉和急性循环衰竭,而肝脏损伤却表现不出来。相反毒性较小,致死较慢的CCl4和CBr4对肝脏毒性表现明显。所以药物对肝脏功能的影响是对药物进行评价的一个重要指标[7],本工作对配合物对实验动物的肝脏功能、外周血象的影响都作了考察。
取6只大白兔,随机分成两组,每组3只,一组作为对照组,另一组体内种入肝癌细胞株使兔子患有肝癌作为配合物实验组。实验组通过耳缘静脉注射 1 mL相同剂量(~3.56×107Bq)的标记物[p-Boc-Trp-Trp-NH(CH2)6NH-PO(ONH4)-O-Ph131I ]。24 h后直接将两组兔子进行活体心脏取血(注意:由于兔血极易凝固,动作要非常迅速,以免影响实验结果),对血液标本进行检验,考察配合物对动物外周血象、肝肾功能的影响。
1.6 配合物在正常小鼠体内的分布
取25只小白鼠,随机分成五组,每组5只。每组通过尾静脉注射0.1 mL相同剂量(~3.56×106Bq)的标记物。于不同时间将小鼠断头处死,取感兴趣脏器称量,测其放射性,计算每克组织摄入放射性占总注入剂量的百分比(%ID/g)。
1.7 配合物在肿瘤大白兔体内的分布
1.7.1 兔VX2单发肝癌模型建立
种兔麻醉。腹腔注射10%水合氯醛 2.5 mL/kg,安定,5 mg/kg,约10 min动物麻醉。
备皮。用粗剪刀剪短种兔大腿内侧兔毛,8%Na2S涂搽,3 min后用温水清洗,大腿内侧皮肤清洗干净。
分离肿瘤。消毒、切开皮肤,分离肿瘤组织,完整剥离肿瘤。切取肿瘤周边生长旺盛组织,置于PBS缓冲液中,用无菌眼科解剖镊仔细剥除血管、肿瘤坏死组织,用PBS缓冲液冲洗,将干净肿瘤组织置于 DMEM 培养液中,用无菌眼科剪将肿瘤组织剪成1 mm×1 mm×1 mm小块,用2 mL匀浆器将组织匀浆。以上操作在超净工作台完成,以保证无菌。
肿瘤传代。将细胞匀浆离心,吸取细胞并用台盼蓝染色,观察细胞存活情况。用血细胞计数板计数,DMEM 调整细胞浓度,将细胞浓度调整为107/mL。吸取细胞悬液0.2 mL,将细胞悬液注入兔大腿内侧肌肉较厚实处,完成接种。饲养接种后的新西兰大白兔两周,肿瘤生长至直径2–3 cm可供模型制作使用。
单发肝肿瘤模型制作。新西兰大白兔手术前8 h开始禁食。肌注青霉素10万U、庆大霉素5 mg。麻醉(同种兔麻醉),腹部备皮(同上)、消毒、切开皮肤、暴露肝脏。将肝脏左外叶提出体外,用眼科剪在左外叶剪一约1 cm的小口,用解剖镊头插入肝脏约1 cm深,造成一个隧道,用明胶海绵适当止血,选取一块4–5 mm肿瘤组织块用解剖镊小心放入隧道内,用明胶海绵填堵肝脏裂口。将肝脏放入腹腔,缝皮关腹。肌注青霉素10万U、庆大霉素5 mg。观察动物苏醒后送动物室饲养。
肿瘤生长情况影像学观察。肿瘤接种于肝脏后饲养两周后开始行超声检查,如超声不能观察到肿瘤则行CT、MRI检查,CT、MRI扫描行4期扫描(平扫、动脉期、门脉期、实质期扫描),待肿瘤生长至直径2–3 cm可供使用。
1.7.2 分布实验
取15只成功建模的大白兔随机分成五组,每组3只。每组通过耳缘静脉注射 1 mL相同剂量(~3.56×107Bq)的标记物。于不同时间将大白兔处死,取感兴趣脏器称量,测其放射性,计算每克组织摄入放射性占总注入剂量的百分比(%ID/g)。
2 结果与讨论
2.1 配合物稳定性和亲脂性考察
稳定性研究表明配合物的体外稳定性较好,扣除131I自身衰变率,放置两天后的脱碘率为10.7%,放置三天后脱碘率为12.5%。脱碘率较文献[8]报道的其它碘标记肽化合物有所降低。
亲脂性的考察结果为 Kow=738214/20932≈35.27。
脂水分配系数与生物体内肝脏对该配合物的摄取存在正相关[9,10]。Kow≈35.27表明配合物是亲脂性的,这样它不易在骨头上聚集,而倾向于在脂肪组织上浓集,比如说肝、肠等器官。这与我们后面的动物体内分布实验结果一致。

表1 放置48–72 h后的稳定性Table 1 Stability of p-Boc-Trp-Trp-NH(CH2)6NH-PO(ONH4)-O-Ph131I after 48–72 h placement
2.2 配合物对大白兔的外周血象、肝肾功能的影响(表2)
通过直接心脏取血的方式进行的配合物对大白兔肝肾功能、外周血象的影响考察结果表明,配合物对大白兔的外周血象和肝肾功能均无影响,各项指标都在正常范围内,说明配合物的毒性不大。

表2 配合物对肝肾功能的影响和治疗前后外周血象指标Table 2 Effect of the compound on function of liver and kidney and on peripheral hemogram
2.3 配合物在动物体内的分布
单块组织包埋法直接接种是 VX2兔肝癌单发肿瘤造模最为理想的方法,具有简便、成模率高、肿瘤大小及成模时间易于估计的特点。其总体死亡率与正常兔的死亡无差别。3周后肿瘤直径为2.6 cm±0.4 cm,单发成模率为86%。
图2是肿瘤观察情况,图A显示在10×20倍光镜下VX2肿瘤细胞呈巢状,图B中活体解剖显示肝左叶有直径约2.5 cm的肿瘤,肿瘤呈鱼肉样,表面有较多血管分布。根据观察结果,肿瘤的模型建立是成功的。

图2 肿瘤观察图片Fig.2 Photograph of the tumour.
由图3的配合物在正常小鼠体内的分布情况可以看到配合物在血中和肾脏中清除速度较快,这提示配合物的血清除较快,主要经过肾脏排除体外。在肝脏和肺部组织滞留相对较多,但在24 h后分别下降到 0.372%和 0.302%,不会对正常肝脏和肺造成辐射损伤。在其它组织中摄取都偏低。
图4表明配合物在大白兔体内主要通过血液和肾脏代谢,与正常小鼠体内的代谢方式一致。除了代谢器官,配合物主要还是浓集于偏脂肪组织,在我们希望的目标靶向组织—肿瘤中浓集率较高,在48 h时虽然只有3%左右的摄取率,但是相对于所有脏器来说,是最高摄取值,可以做进一步的实验,降低动物体内的脱碘率,提高标记物的体内稳定性,延长标记物在肿瘤组织的滞留时间,以获得更好的治疗效果。
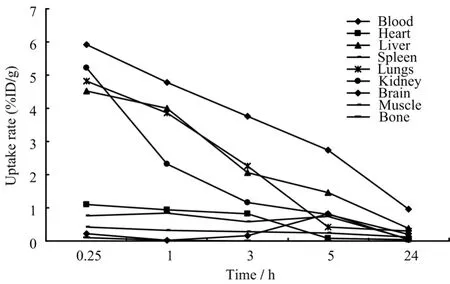
图3 配合物在正常小鼠体内的分布Fig.3 Tissue distribution of compound in normal mice (n=5).
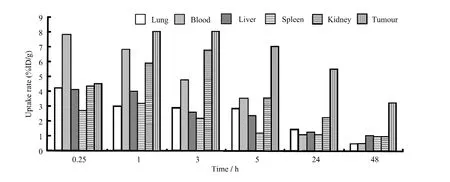
图4 配合物在肿瘤大白兔主要脏器的分布Fig.4 Tissue distribution of compound in tumor rabbit (n=5).
3 结论
对 p-Boc-Trp-Trp-NH(CH2)6NH-PO(ONH4)-OPh131I的生物性质作了详细研究。配合物比较稳定且毒性较低。成功建立了VX2肝癌单发肿瘤动物模型,配合物在动物模型以及在正常小鼠的体内分布趋势比较一致,配合物比较倾向于浓集于脂肪组织,在肿瘤组织中的滞留量相对较高,表现出作为肿瘤治疗药物的潜在可能性,但清除较快,可以作进一步的研究,提高标记物的体内稳定性,以延长配合物在靶向组织中的浓集时间。
1 范我, 强亦忠. 核药学. 北京: 原子能出版社, 1993 FAN Wo, QIANG Yizhong. Nuclear medicine. Beijing:Nuclear Industry Press, 1993
2 杨建权, 李晔, 张现忠. 国外医学·放射医学核医学分册, 2003, (27): 157–161 YANG Jianquan, LI Yie, ZHANG Xianzhong. Int J Radiat Med Nucl Med, 2003, (27): 157–161
3 汤可立, 苗雄鹰. 中国普通外科杂志, 2003, 12(9):700–702 TANG Keli, MIAO Xiongying. China General Surgery,2003, 12(9): 700–702
4 Sasaki S, Ehara T. Bioorg Med Chem Lett, 2001, 11:583–585
5 何佳恒, 陈雅宏, 肖沣峰, 等. 化学研究与应用, 2007,19(8): 886–888 HE Jiaheng, CHEN Yahong, XIAO Fengfeng, et al.Chemical Research and Application, 2007, 19(8):886–888
6 王连生, 韩朔睽. 分子结构、性质与活性. 北京: 化工出版社, 1997 WANG Liansheng, HAN Shuokui. Structure, property and active of molecule. Beijing: Chemical Industry Press,1997
7 朱蓓蕾. 动物毒理学. 上海: 科学技术出版社, 1989 ZHU Beilei. Animal toxicology. Shanghai: Science and Technology Press, 1989
8 朱愉, 多秀瀛. 实验动物的疾病模型. 天津: 科技翻译出版公司, 1997 ZHU Yu, DUO Xiuying. Malady model of experiment animal. Tianjin: Science and Technology Translate Press Inc, 1997
9 Abrams M J, Murrer B R. Advances in metals in medicine.London: JAI Press Inc, 1993. 134–135
10 蒋树斌.99mTc、153Sm和186,188Re-HEDTMP的合成及性质研究. 绵阳: 中国工程物理研究院, 2000 JIANG Shubin. Synthesis and characterization of99mTc(153Sm,186,188Re)-HEDTMP. Mianyang: China Academy of Engineering Physics, 2000

