柠檬醛对绳状青霉抑制作用研究
程婵娟,韦 伟,胡尚勤
(重庆师范大学生命科学学院,重庆 400047)
柠檬醛(Citral)是从樟科(Lauraceae)植物山苍子[Litsea cubeba(Lour)Per]果实、根及叶所提取精油中一种主要成分,具有广谱的抗菌性[1-2]。目前就柠檬醛对白色念珠球菌(Candida albicans)、黄曲霉(Asperillus flavus)的抑菌作用和抑菌机理方面有较深入的研究[3-5]。并报道其对念珠菌、毛癣菌、曲霉菌、金黄色葡萄球菌、淋球菌和大肠杆菌等真菌和细菌均有抑制和杀灭的作用[5-7]。
绳状青霉(Penicillium funiculosum)属半知菌纲(Deuteromycetes),是植物常见病原菌。该菌可以产生纤维素酶,破坏植物细胞壁,引起西红柿茎腐病[8]。在食用菌栽培中也是常见的污染菌。谷物中常见此菌,Lugauskas等报告表明在谷物收获、存储、打粉等整个加工过程中均有发现[9]。P.funiculosum可在木材、皮革制品上生长,对军用篷布、枪套、背包甚至枪弹都有较严重的危害[10-11]。因此,是美国、中国军用标准中霉菌检验的指示菌之一。如何防治包括P.funiculosum等霉菌对工农业产品地侵染以及危害具有重要的意义。然而在防霉研究中,有关P.funiculosum的研究很少。本文采用目前公认对真菌抑制效果较好的柠檬醛作为材料,以P.funiculosum为对象,研究采用不同方式以及不同浓度的柠檬醛对P.funiculosum生长以及孢子萌发的影响。
1 材料与方法
1.1 材料
绳状青霉(Penicillium funiculosum,AS 3.3875),购自中科院菌种保藏中心。柠檬醛(分析纯),购自中国医药集团上海化学试剂公司
1.2 方法
1.2.1 柠檬醛对P.funiculosum生长的抑制作用检测
P.funiculosum菌种活化后采用察氏培养基于28℃培养7 d。制备孢子悬浮液、计数,同时检测孢子活力[11]。
采用两种方法研究柠檬醛对P.funiculosum生长的抑制作用。
1.2.1.1 滤纸片法[12]
将已灭菌直径为1.6 cm的滤纸片浸入2、3、4、5和6 mg·mL-15种浓度的柠檬醛溶液中,以50%甘油溶剂为对照,浸泡2 h后取出晾干。
取0.5 mL孢子悬浮液于装有4.5 mL察氏上层培养基的试管中,使孢子终浓度为105个·mL-1。振荡均匀,倒入准备好的察氏下层培养基平板上。冷却后用无菌镊子夹取滤纸片平放于平板上,用封口胶将平板密闭,于25℃培养,24 h后开始观察霉菌生长情况,用游标卡尺采用十字交叉法量取各试验组抑菌圈直径。每个浓度处理设置3组重复。并按下列公式计算抑菌效果:
抑制率(%)=(试验组抑菌圈直径-对照组抑菌圈直径)/对照组抑菌圈直径×100%
1.2.1.2 挥发性物质活性检测法[13]
取P.funiculosum孢子悬液0.5 mL均匀涂布于直径为9 cm的察氏培养基平板,25℃培养3 d。用灭菌打孔器打孔得到直径为5 mm的菌栓。把菌栓(菌丝面向下)放入新鲜的察式平板中央,然后在培养皿盖(中央)上放置直径1.6 cm,在不同浓度柠檬醛溶液及50%甘油溶剂对照中浸泡2 h的滤纸片,用封口膜密封防止柠檬醛挥发,倒置培养25℃培养24~48 h,观察菌落大小,量取直径,记录结果。
菌落增长率(%)=(试验组菌落直径-0.5)/0.5×100%
抑制率(%)=(对照组菌落直径-试验组菌落直径)/对照组菌落直径×100%
MIC[13-14]:找出菌落直径未增加的平板,去掉封口膜,通风24 h除去柠檬醛后,25℃继续培养24 h,观察菌落生长情况。通风后菌落直径开始增加的浓度为最小抑制浓度(MIC)。每个浓度处理设置3组重复。
1.2.2 柠檬醛处理不同时间对P.funiculosum孢子萌发的影响
在P.funiculosum孢子悬液中加入适量柠檬醛溶液,使柠檬醛终浓度为3.0 mg·mL-1,密闭,振荡摇匀,室温20℃下分别处理10、30、60、90、120 min后于 4℃,5 000 r·min-1离心 10 min,去上清液,再以无菌水离心洗涤2次,去除柠檬醛。以50%甘油为对照,每个时间处理设置3组重复。
处理后的孢子悬液1 mL加入装有20 mL液体培养基的锥形瓶中,28℃,180 r·min-1振荡培养,每2 h取样,采用显微镜观察孢子的萌发,并按下列公式计算其萌发率与抑制率:
孢子萌发率(%)=萌发的孢子数/样品孢子数×100%
1.3 统计方法
利用SPSS统计软件对试验数据进行方差分析(ANOVA)检验差异显著性。
2 结果与分析
2.1 柠檬醛对P.funiculosum抑制作用
采用滤纸片法以及挥发性物质活性检测法对不同浓度柠檬醛抑制P.funiculosum作用结果见表1、2。
从表1中采用滤纸片法检测结果可知,柠檬醛对P.funiculosum具有明显的抑制作用。在较高浓度(6.0 mg·mL-1)下抑制作用明显,抑菌圈直径为2.33 cm,抑制率达到45.83%。而在低浓度条件下(3.0~5.0 mg·mL-1),抑菌圈直径在1.65~1.93之间变化,且据其所得的抑制率为2.29%~20.42%。在此低浓度范围内,抑菌圈直径与对照间无显著性差异。根据试验结果,将6.0 mg·mL-1作为柠檬醛对P.funiculosum的最小抑制浓度(MIC)。
挥发性物质活性检测法对柠檬醛P.funiculosum生长抑制结果见表2。

表1 滤纸片法检测不同浓度柠檬醛对P.funiculosum生长的抑制作用Table1 Effect of different concentration of citral on growth inhibition by filter paper method of P.funiculosum at 25℃

表2 挥发性物质活性检测法检测不同浓度柠檬醛对P.funiculosum生长的抑制作用Table2 Effect of different concentration of citral on growth inhibition by volatile activity test method of P.funiculosum at 25℃
表2结果表明,不同浓度的柠檬醛挥发性成分对P.funiculosum生长具有不同程度的抑制作用。在较低浓度(2.0 mg·mL-1)条件下,P.funiculosum的菌落直径为1.51 cm,明显低于对照(1.82 cm),其增长率(202.67%)也比对照(262.67%)低。柠檬醛对其的抑制率为16.39%。随着浓度增加,P.funiculosum的菌落直径、菌落增长率以及柠檬醛对其的生长抑制率也随之发生变化。在浓度为3.0 mg·mL-1时,菌落直径为0.56 cm,相比对照与2.0 mg·mL-1条件下出现了明显的下降,菌落增长率也由200%以上降低到38.0%。同时抑制率升高,达到61.87%。当浓度为4.0~6.0 mg·mL-1时,菌落基本无生长,直径处于0.50~0.54之间,变化无显著性差异。菌落增长率为0~8.67%,比对照(262.67%)降低约250%。生长抑制率处于69.98%~72.19%之间,相比对照表现出明显的抑制作用。
将浓度为 3.0、4.0、5.0、6.0 mg·mL-1的平板,去掉封口膜,通风24 h除去柠檬醛后,继续培养24 h,观察菌落生长的结果表明柠檬醛挥发性成分对于P.funiculosum的最小抑制浓度(MIC)为3.0 mg·mL-1。
2.2 柠檬醛处理不同时间对P.funiculosum孢子萌发的影响
在柠檬醛抑制P.funiculosum孢子萌发试验中,用3.0 mg·mL-1柠檬醛处理孢子不同时间观察孢子萌发率,结果见图1。
从图1可以看出,柠檬醛处理不同的时间长度,对P.funiculosum孢子的萌发时间以及萌发率都有明显的影响。萌发时间方面,处理10 min,即对其萌发表现出抑制作用,萌发时间从14 h(对照)延至20 h,延迟了6 h。而处理120 min的样品直到24 h开始才有极少量孢子开始萌发,比对照延迟了10 h。另外,处理30~90 min的样品在萌发时间的延迟上与处理10 min的样品一致,都延迟6 h后才开始萌发。
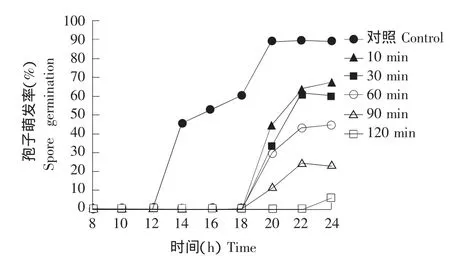
图1 柠檬醛处理不同时间对P.funiculosum孢子萌发率的影响Fig.1 Effect of different treatment time of citral on percent inhibition of spore germination of P.funiculosum at 25℃
从萌发率来看,到24 h柠檬醛10 min处理组的萌发率为67.3%,比对照组(89%)降低了21.7%。30~90 min处理组的萌发率分别为60.3%、44.8%和23.5%。而120 min处理组的萌发率仅为5.2%,比对照降低了83.8%。并且随着柠檬醛处理时间的延长,P.funiculosum孢子萌发率随之下降。
3 讨论与结论
柠檬醛是山苍子精油中一种主要挥发性成分,具有广谱的抗菌性。本文从浓度、作用方式与作用时间三个方面研究柠檬醛对P.funiculosum的抑制作用。以探索采用柠檬醛的运用方式和效果。
防霉剂的运用方法多种多样,根据其种类特性不同可以采用直接与产品混合、表面喷涂、熏蒸和包埋缓释等不同方式。滤纸片法是检测各种直接接触混合型防腐剂抑菌作用的常用方法。本文通过比较抑菌圈直径的方法来比较不同浓度柠檬醛直接喷涂或者混合处理的方式对P.funiculosum的抑制作用。同时,基于柠檬醛的挥发性特点,采用挥发性活性物质检测法检测不同浓度柠檬醛对P.funiculosum的抑制作用,以探索熏蒸和包埋缓释的运用可能性与条件。
试验结果表明,柠檬醛挥发性成分对P.funiculosum的MIC为3.0 mg·mL-1,而滤纸片法所得MIC为6.0 mg·mL-1。二者结果不一致,前者MIC低于后者。类似的结果在其他研究中也有报道[15]。另外,余伯良采用药物平板法得到柠檬醛对A.flavus的最小抑制浓度(MIC)为 1.77 mg·mL-1[1];张文平等采用药敏板液体培养所得的结果为 2.590 μg·mL-1[17];罗曼等的结果表明柠檬醛对A.flavus的MIC为0.5 μg·mL-1、最小致死浓度为 2.0 μg·mL-1[18]。这些结果上的区别,除了检测方法本身的原因之外[15-16],也从另一个角度表现出防霉剂使用剂量、方式对抑菌效果具有很大的影响。结合本文结果,相同低浓度下柠檬醛挥发性成分表现出比直接接触更强的抑制作用。选择采用低浓度熏蒸或包埋的方式,柠檬醛可能对P.funiculosum取得更好的抑制效果。
除了浓度与作用方式之外,作用时间也是防霉中的关键因素之一。根据罗曼等的报道,柠檬醛在低浓度(0.5~2.0 μg·mL-1)条件下处理48 h,A.flavus孢子萌发率随着浓度的增加而下降[18]。Sharma等采用其他植物精油对A.flavus孢子萌发抑制试验也得到类似的结果[15]。本文通过柠檬醛不同时间处理P.funiculosum孢子萌发率的影响,探索柠檬醛抑菌的最佳作用时间与效果。在最小抑制浓度下,处理60 min即可达到超过50%的孢子萌发抑制率,同时延迟萌发6 h。而处理2 h后对孢子萌发起到极大的抑制作用,孢子萌发率仅5.2%,萌发时间延迟10 h。因此,采用熏蒸的方式,柠檬醛作用时间2 h以上即可对P.funiculosum起到较好的抑制效果。当然,在合适的浓度与作用时间之间的选择并非完全不变,必须要根据实际作用方式与环境因素进行选择。
[1]余伯良.山苍子油对霉菌抗菌性及其与黄曲霉产毒关系的研究[J].微生物学通报,1998,25(3):144-147.
[2]周勇,陶君娣,张家俊.山苍子挥发油及其主要成分柠檬醛抗真菌作用的研究[J].中西医结合杂志,1984,4(9):558-559.
[3]罗曼,蒋立科.改进Propy法测定柠檬醛损伤黄曲霉质膜中共轭双烯和丙二醛及作用机制研究[J].中草药,2007,38(10):1506-1507.
[4]罗曼,蒋立科,吴子健.柠檬醛对黄曲霉质膜损伤机制的初步研究[J].微生物学报,2001,4(6):723-728.
[5]周坚,李沛涛.山苍籽油抗金黄色葡萄球菌的机理研究[J].湖南医科大学学报,1992,17(4):329-332.
[6]万力,李志锋.山苍子油对小鼠系统性白念珠菌感染的影响[J].中国真菌学杂志,2006,1(4):211-214.
[7]谢小梅,龙凯,许杨,等.肉桂醛和柠檬醛对黄曲霉及烟曲霉细胞DNA与RNA的影响[J].中草药,2005,36(4):558-560.
[8]Adejuwon A O,Oni A O,Ajayi A A,et al.Cellulase activity in tomato fruits infected with Penicillium funiculosum Thom[J].African Journal of Plant Science,2009(3):113-116.
[9]Lugauskas A,Raila A,Rniliene M,et al.Toxic micromycetes in grain raw material during its processing[J].Annals of Agricultural and Environmental Medicine,2006,13:147-161.
[10]胡尚勤,韦伟.霉菌对枪弹的侵蚀与防治[J].兵工学报,27(4):648-651.
[11]韦伟.军用标准指示菌对不同基质侵蚀作用的研究[J].微生物学杂志,2002,22(2):21-35.
[12]杨楠,陈洪仪.三种食品防腐剂的抑菌效果研究[J].食品工业科技,2007,28(1):189-192.
[13]Soylu E M,Soylu S,Kurt S.Antimicrobial activities of the essential oils of various plants against tomato late blight disease agent Phytophthora infestans[J].Mycopathologia,2006,161:119-128.
[14]Sokovic M,Van Griensven L J L D.Antimicrobial activity of essential oils and their components against the three major pathogens of the cultivated button mushroom,Agaricus bisporus[J].European Journal of Plant Pathology,2006,116:211-224.
[15]Sharma N,Tripathi A.Fungitoxicity of the essential oil of Citrus sinensis on post-harvest pathogens[J].World Journal of Microbiology and Biotechnology,2006,22:587-593.
[16]Delespaul D,Billerbeck V G,Roque C G.et al.The antifungal activity of essential oils as determined by different screening methods[J].Journal of Essential Oil Research,2000,12:256-266.
[17]张文平,傅颖媛,谢小梅.柠檬醛、肉桂醛抗曲霉菌作用机制研究[J].江西医学院学报,2003,13(6):10-13.
[18]罗曼,蒋立科,邹国林.柠檬醛致黄曲霉孢子丧失萌发力的机制[J].中国生物化学与分子生物学报,2002,18(2):227-233.

