鹌鹑沙门菌的分离鉴定*
罗 玲,艾地云,杨 峻,王红琳,温国元,罗青平,张蓉蓉,邵华斌
(湖北省农业科学院畜牧兽医研究所,湖北武汉 430064)
沙门菌病是由沙门菌属引起的消化道传染病,流行广泛,发病率和病死率较高。近年来,随着鹌鹑养殖业的发展,有关鹌鹑疾病的报道也陆续增多,但国内对鹌鹑的细菌性疾病的报道很少。作者对某鹌鹑场进行了流行病学调查及病原微生物分离与鉴定,试图为今后鹌鹑养殖业的防病治病工作提供参考和借鉴。
该场2009年4月从育雏舍到育成舍陆续发病,发病率为20%~30%,死亡率为10%,病鹌鹑表现为精神沉郁,羽毛松乱,排灰白色或绿色稀便。剖检变化表现为肝脏土黄色或绿色,部分肠道胀气。口服环丙沙星,病情有所好转,一旦停药则病情加重。该场疫情不断,造成了很大的经济损失。
1 材料与方法
1.1 材料
40日龄~58日龄病死鹌鹑的肝脏和心血,并在水井、禽舍输水系统采取2份水样。
麦康凯(MacConkey)琼脂购自杭州微生物试剂有限公司;伊蛋白大豆琼脂(TSA)和伊蛋白大豆肉汤(TSB)购自碧迪医疗器(上海)有限公司;普通营养琼脂、普通营养肉汤为自制;生化试验微量发酵管购自杭州微生物试剂有限公司;药敏纸片购自杭州微生物试剂有限公司。
小鼠购自湖北省实验动物研究中心。购买回来后饲养7 d,无任何发病症状,用于后续试验。
1.2 方法
1.2.1 细菌的分离 无菌操作取2份脏器(编号为QS0901、QS0902)直接划线于TSA和麦康凯琼脂平板上,无菌操作分别取水样(编号为 WS0901、WS0902)0.2 mL于 TSA和麦康凯琼脂平板上。37℃培养24 h,观察结果。从其中挑取可疑菌落,进行革兰染色,镜检。
1.2.2 细菌的纯培养 从TSA上挑取灰白色、光滑的菌落在新的TSA上划线,37℃培养24 h,观察结果,再次染色、镜检。若菌体形态和染色特性符合沙门菌的形态和染色特性时,挑取剩余的半个菌落接种于TSA斜面培养基,37℃培养24 h,然后取出置4℃冰箱保存备用。
1.2.3 生化特性鉴定 将分离的4个菌株,接种于TSB,37℃培养24 h后适量地接种于葡萄糖、蔗糖、乳糖、麦芽糖、木糖、卫矛醇、H2S、靛基质微量发酵管,置37℃培养24 h后观察生化反应结果。靛基质滴加靛基质试剂,置37℃培养2 h后观察结果。
1.2.4 小鼠致病性试验 取4株细菌的18 h TSB培养物(菌液浓度为2.0×108cfu/mL),经纯粹检验合格,分别腹腔接种18 g~25 g小鼠,按0.2 mL/只剂量接种,每个菌株接种6只。对照组经相同的途径接种0.2 mL TSB,接种3只。接种后饲养观察7 d,记录小鼠的死亡时间并从死亡小鼠的肝脏、心脏分离致病菌。
1.2.5 药物敏感性试验 按世界卫生组织(WHO)推荐的Kirby-Bauer法对4株分离菌株进行药敏试验[1]。结果判定标准:抑菌圈直径大于15.1 mm为高度敏感,10.1 mm~15 mm为中度敏感,0 mm~10 mm为耐药。
2 结果
2.1 分离菌的培养特性及形态特征
从脏器中分离的细菌经37℃培养 24 h,在TSA上长出圆形、隆起、表面光滑、边缘整齐、直径1.0 mm~2.0 mm的灰白色菌落;在麦康凯琼脂上长出圆形、表面光滑、边缘整齐、直径 0.5 mm~1.0 mm的无色菌落;在TSB中呈均匀混浊,管底有灰白色的沉淀,轻摇试管时,沉淀物呈絮状慢慢升起。取培养物涂片,革兰染色,镜检可见到革兰阴性、无芽孢、中等大小短杆菌,单独或成双存在。水样中的分离菌与脏器分离菌的菌落及形态学特征相同。
2.2 分离菌的生化特性
选择蔗糖、乳糖、麦芽糖、葡萄糖、木糖、靛基质、H2S、卫矛醇微量发酵管对分离出的4株细菌进行生化试验。由表2可知,脏器和水样中分离的细菌均发酵麦芽糖、葡萄糖、木糖,不发酵蔗糖和乳糖,不形成靛基质,不产生H2S,不同的是脏器中分离菌株发酵卫矛醇,而水样中分离的细菌不发酵卫矛醇(表1)。
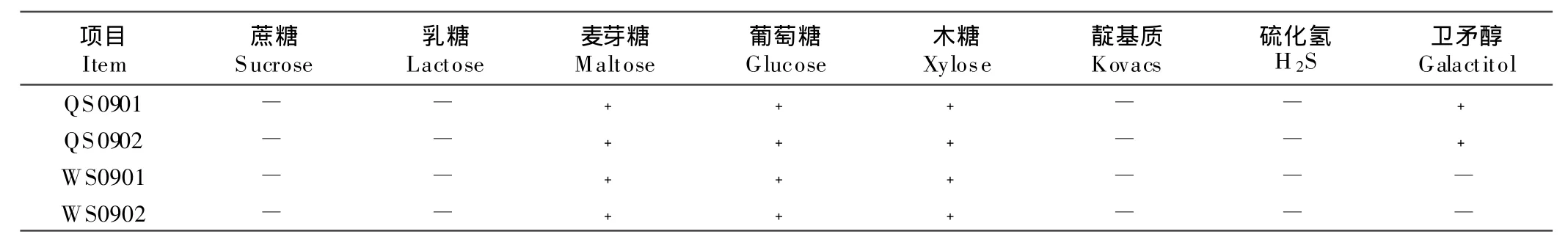
表1 鹌鹑沙门菌分离株的生化试验Table 1 The results of biochemistry test forSalmonella isolate from quail
2.3 小鼠致病性试验
接种分离菌编号为QS0901和QS0902的小鼠12 h后均出现精神不振,18 h开始出现死亡,48 h全部死亡。剖检死亡的小鼠可见肝脏肿大淤血,表面散在针尖大小的出血点,心包膜有不同程度的出血。从死亡小鼠的肝脏、心脏中均可分离到分离菌。接种分离菌编号为WS0901和WS0902的小鼠12 h后均出现精神不振,48 h内各死亡2只,48 h~72 h又各死亡2只,另4只存活小鼠1周后剖杀,从死亡、迫杀小鼠肝脏、心脏中均可分离到分离菌。对照组小鼠健康,剖检无肉眼可见病理变化,肝脏、心脏中未分离出分离菌。
2.4 药敏试验结果
对分离菌株进行了药敏试验,脏器中分离的细菌对强力霉素、多黏菌素B高度敏感,对卡那霉素、环丙沙星中度敏感,对新霉素、氨苄青霉素、万古霉素、头孢肤肟、庆大霉素、头孢噻吩、磺胺异噁唑、恩诺沙星耐药;水样中分离的细菌对卡那霉素高度敏感,对其他药物不敏感(表2)。
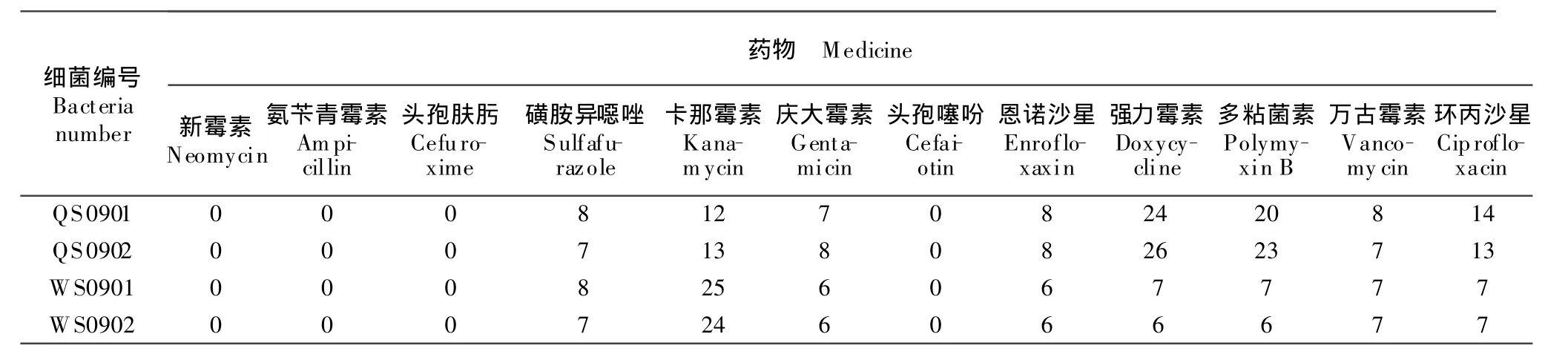
表2 抗菌药敏纸片对鹌鹑沙门菌分离株抑菌圈直径Table 2 The inhibition zone diameter of antibacterial drugs in sensitive slips for Salmonella isolate from quail mm
3 讨论
禽沙门菌病是由沙门菌引起的传染病,沙门菌为条件致病菌。据现场调查和流行病学分析,此次疫病的发生与环境、水源及鹌鹑抵抗力下降有直接关系,在水井、禽舍饮水乳头两处水样中均检出了沙门菌。同时该场从育雏舍到育成舍,均未实行全进全出制,环境卫生不良,通风不佳,饮水更换不勤,加上环境消毒不严,导致病原菌的迅速大量繁殖。通过流行病学调查、症状分析、剖检变化观察、分离病原体的生化试验及动物接种试验,均为沙门菌感染。
随着集约化程度的不断提高,细菌性疾病的增多,抗菌类药物的广泛使用,尤其是低剂量添加入饲料中,使一些致病菌株产生了很强的耐药性,而且细菌可通过质粒把耐药基因传递给其他沙门菌,使得沙门菌的耐药性形成较快,环境中沙门菌的耐药性菌株越来越多[2-8],导致临床上的无效治疗。本次试验对分离鉴定的4株沙门菌进行药敏试验结果显示,从脏器中分离的细菌对强力霉素、多黏菌素B高度敏感,对卡那霉素、环丙沙星中度敏感,对新霉素、氨苄青霉素、万古霉素、头孢肤肟、庆大霉素、头孢噻吩、磺胺异噁唑、恩诺沙星耐药;水样中分离的细菌对卡那霉素敏感,对其他药物不敏感。由此可见,在养殖场中要定期分离病原,进行耐药性监测,监督耐药性的发展和变化,以指导临床正确用药[6-7]。在实际用药中应采取联合、轮换、交叉等用药形式,以减小细菌产生耐药性的几率,达到好的防治效果。同时,食源性动物耐药菌可通过多种途径将耐药基因传递给人类致病菌,危害人类健康[9-11],所以要有法规来规范兽药的使用。该场使用强力霉素对本病进行了治疗,并采用对饮水进行严格消毒等措施,有效地控制了疫病的暴发和流行。
[1]马兴树.禽传染病实验诊断技术[M].北京:化学工业出版社,2006:279-282.
[2]邓树轩,程安春,汪铭书,等.沙门氏菌耐药机制研究进展[J].安徽农业科学,2007,35(23):7205-7207.
[3]陈仗榴,吴聪明,蒋红霞.兽用抗菌药物耐药性研究概况[J].四川生理科学杂志,2005,27(4):177-180.
[4]张永利,万献尧.细菌耐药性研究进展[J].中国医师杂志,2004,6(12):1721-1722.
[5]Mitcheu L.Drug resistant Salmonella in the United States.An epidemiologic perspectile[J].Science,1986,234(21):964-969.
[6]潘志明,焦新安,刘文波,等.鸡白痢沙门氏菌耐药性的监测研究[J].畜牧兽医学报,2002,33(4):377-383.
[7]雷连成.细菌耐药性[J].中国兽药杂志,2002,36(11):41-44,49.
[8]甘孟侯.家禽细菌性疫病的发生与防治对策[J].中国兽医杂志,1996,22(6):40-43.
[9]赵红梅,金升藻.滥用抗生素对人畜的危害及对策研究[J].国外医药:抗生素分册,2003,24(4):164-167.
[10]高 光.畜禽食源性细菌耐药性与食品安全、现状与对策//二十一世纪兽药与食品安全论坛论文集[C].北京:中国兽医药品监察所,2002:57-68.
[11]Baskerville A.Ariborne infection of laying hens with Salmonella enteritidis phage type 4[J].Vet Rec,1992,130(18):395-397.

