小鼠腹腔注射阿霉素诱导骨髓细胞微核率的最佳时间—剂量效应分析
常 征
(1.云南师范大学生命科学院,云南昆明 650092;2.文山学院生化系,云南文山 663000)
小鼠腹腔注射阿霉素诱导骨髓细胞微核率的最佳时间—剂量效应分析
常 征1,2
(1.云南师范大学生命科学院,云南昆明 650092;2.文山学院生化系,云南文山 663000)
目的:寻找一次染毒条件下,腹腔注射阿霉素诱导小鼠骨髓细胞微核率出现峰值的时间 -剂量条件。方法:将 150只小鼠随机分为 5组,每组 30只,雌雄各半。腹腔注射,1次给药,对照组给生理盐水,处理组的阿霉素剂量分别是 2.5 mg/kg、5 mg/kg、10 mg/kg和 20 mg/kg。染毒 18 h、24 h、30 h、48 h和72 h后取小鼠骨髓进行微核分析,评价阿霉素对小鼠的遗传毒性作用。结果:理想的腹腔注射诱导的小鼠骨髓细胞微核率峰值的条件就是:一次染毒,阿霉素剂量在 10%LD50即 2.5 mg/kg至 80%LD50即 20 mg/kg的范围内剂量越大微核率越高,取样时间在 30~48 h间微核率最高。
阿霉素;小白鼠;腹腔注射;微核率;时间 -剂量效应
1 材料与方法
1.1材料与仪器
1.1.1实验动物
昆明种健康小白鼠,150只,体重 18~22 g,雌雄各半,[云南实验动物许可证:SCXK(滇 2005 -0008)]。购于昆明医学院动物试验中心。
1.1.2实验药品
注射用盐酸多柔比星 (阿霉素),10 mg装,深圳万乐药业有限公司生产,产品批号:0808E1,生产日期:20080823。
氯化钠注射液,250 mL装,昆明南疆制药有限公司 生 产,产 品 批 号:B081111h1,生 产 日期:20081111。
1.1.3实验药品的配制
用 1 mL、2.5 mL、5 mL、10 mL的注射器取生理盐水注射到 10 mg装阿霉素中配制成不同浓度,混匀后,用 1 mL的注射器吸取并腹腔注射小鼠。
1.1.4仪器设备
日本奥林巴斯BX51系统荧光显微镜;800型离心机 (金坛市大地自动化仪器厂)。
1.2方法
1.2.1实验方法
将 150只小鼠随机分成 5个组,每组 30只,雌雄各半。对照组 (CK)腹腔注射生理盐水一次,其余四组分别以 10%LD50、20%LD50、40%LD50和80%LD50的阿霉素剂量腹腔注射一次,注射量为0.1~0.2 mL/10 g体重[16]。随后再将每组小鼠随机分为 5个小组,每小组 6只,雌雄各 3只,分别于给药结束后的 18 h、24 h、30 h、48 h和 72 h用颈椎脱臼法处死、取样。
小鼠骨髓细胞微核实验方法参照了肖福英[1]、Makoto Hayashi[6]和汪旭[5,17,18]等的方法,稍加改动。取小鼠股骨,剪去股骨的两端,每条股骨用 1 mL生理盐水冲洗骨髓腔,每只小鼠用一个离心管。将骨髓冲洗液 1 000 r/min离心 5 min,弃大部分上清液,留少许液体 (约 0.2 mL),轻轻震荡使细胞均匀分散开来。用毛细吸管在每个载玻片上滴两滴,用血常规涂片法涂片,自然干燥,甲醇固定 10 min,晾干,Giemsa原液用磷酸缓冲液 (PH6.8)按 1∶20的比例稀释,染色 20 min。自来水轻轻冲去多余染液,充分晾干,中性树胶封片,在油镜下对每只小鼠骨髓细胞分别计数 1 000个,再分别统计其微核发生率。计数细胞要符合以下条件:①细胞结构完整,即必须有细胞质和细胞核,且细胞质和细胞核对比明显;②细胞核着色鲜明、均匀且边缘相对光滑;③部分被污物或其它细胞组织遮盖的细胞不计数,但是如果已经确认是微核细胞则计数。
1.2.2统计学处理
结果以平均数 ±标准差 (x±s)表示,所有数据用 SPSS11.5统计软件进行方差分析,剂量 -反应关系进行直线相关分析,计算相关系数。
2 结果与分析
2.1不同剂量阿霉素注射后对小鼠骨髓细胞微核率的影响
不同剂量阿霉素注射后小鼠骨髓细胞微核统计结果见表1。表1中通过对剂量与微核发生率的相关性分析 (见图1),可以看出:阿霉素的腹腔给药剂量与小鼠骨髓细胞的微核发生率有极显著的正相关性 (p<0.01),即小鼠骨髓细胞的微核发生率随阿霉素的腹腔给药剂量的增大而极显著地增大,它们表现出了极显著的剂量 -反应关系。而通过对各给药剂量间微核发生率 (‰)均数的两两比较 (S -N-K法)可以看出:所有给药组的微核率都极显著地高于阴性对照组 (p<0.01),这说明一次染毒就可造成微核率的显著上升。同时还可以看出20%LD50组的微核率极显著地高于 10%LD50组 (p <0.01),40%LD50组的微核率极显著地高于 20% LD50组 (p<0.01),只有 80%LD50组与 40%LD50组的微核率相比较差异不显著 (p>0.05)。

2.2不同取样时间对小鼠骨髓细胞微核率的影响
表1中通过对各取样时间间微核发生率 (‰)均数的两两比较 (S-N-K法)看出:30 h和 48 h时取样的微核率显著 (p<0.05)甚至是极显著 (p <0.01) (用 p=0.01进行检验结果同样成立)高于 18 h、24 h和 72 h时取样的微核率;而 18 h、24 h和 72 h取样时,微核率差异不显著 (p>0.05), 30 h与 48 h取样时,微核率差异也不显著 (p> 0.05)。但通过图2可以看出:在所有的取样时间里,48h取样时微核率是最高的,48 h后微核率逐渐下降。阿霉素腹腔注射后随取样时间不同,小鼠骨髓细胞微核率统计结果变化见表1。各组小鼠骨髓细胞微核见图3。图中箭头所示为小鼠骨髓细胞微核。
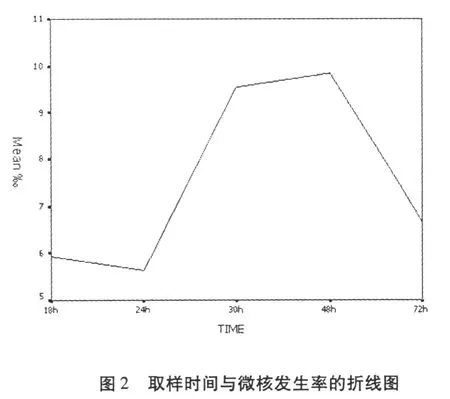
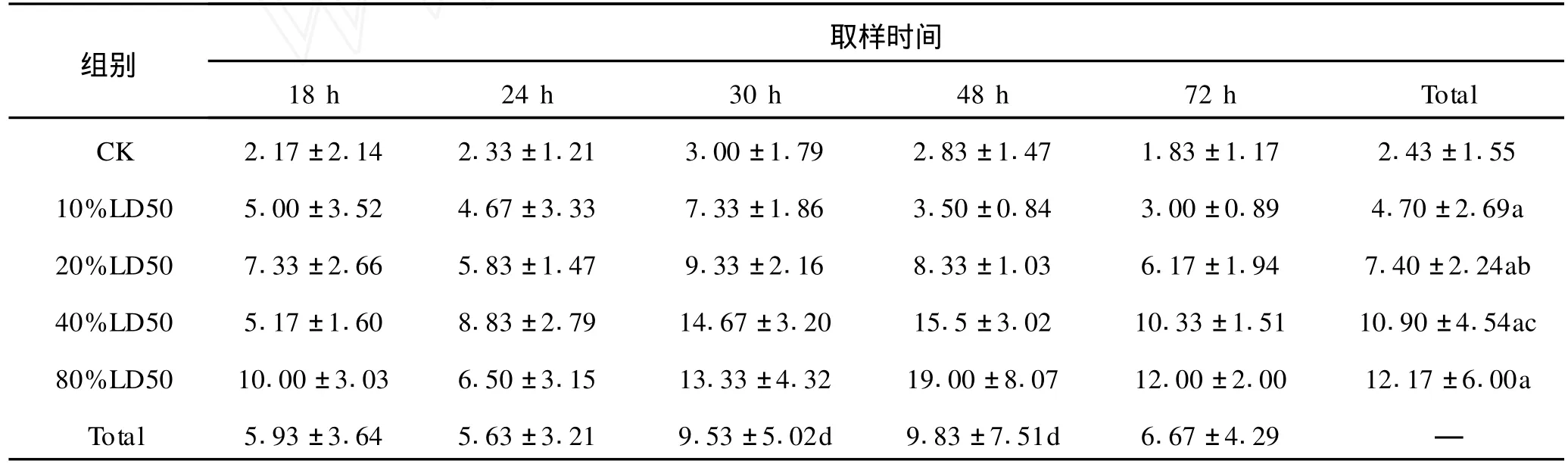
表1 不同剂量、不同取样时间阿霉素对骨髓微核率的影响 (‰)

图3 阿霉素诱发小鼠骨髓细胞形成的微核
3 讨 论
微核作为检测染色体损伤的重要指标之一,其出现峰值的时间因不同化合物而异,波动范围可能在 18~72 h内,大多数化合物诱发形成的微核,其检出峰值在给药后的 24~30 h间,72 h后出现峰值的情况很少见[6]。而且同一化合物,如果给药的剂量与途径不同,动物种属不同,微核率峰值出现的时间也不同[19-21]。因此,合理的选择取样时间和给药剂量对获得较高的微核率显得尤为重要。在本实验中,小鼠一次染毒 18 h后,骨髓细胞微核率就明显升高,直到48 h时出现峰值 (当然,30 h与 48 h时的微核率差异不显著 (p>0.05),或称没有统计学意义),这与付小锁[22],许重洁[23-24]的阿霉素两次染毒得到的小鼠骨髓细胞微核率出现峰值的时间是一致的。这表明,要获得理想的腹腔注射阿霉素诱导的小鼠骨髓细胞微核率峰值,无须进行二次染毒,一次染毒即可得到。这不仅可以节约一定的实验经费,同时也可以节约一定的时间和精力。另外,本实验同样也得出了与付小锁[22],许重洁[23-24]相同的剂量 -反应关系结果,即小鼠骨髓细胞的微核发生率随阿霉素的腹腔给药剂量的增大而极显著地增大,并对它进行了线性相关分析,得到了相关性极显著 (p<0.01)的结果。最后,本实验得到的结果就是:理想的腹腔注射阿霉素诱导的小鼠骨髓细胞微核率峰值的条件为:一次染毒,剂量在 10% LD50即 2.5 mg/kg至 80%LD50即 20 mg/kg的范围内越大微核率越高,取样时间在 30~48 h间微核率最高。
[1] 肖福英,蒋林彬.医学细胞生物学与医学遗传学试验[M].上海:复旦大学出版社,2007:90.
[2] Heddle A.A rapid in vivo test for chromosomal damage [J].M utat Res,1973,(18):187-190.
[3] Schmid W.The micronucleus test[J].M utat Res,1975, (31):9-15.
[4] 郑巧玲,梁丽燕,陈润涛,等.职业小剂量照射对医用 X射线工作者微核产额影响的研究 [J].现代预防医学, 2006,(12):2297-2298.
[5] 汪旭,刘素清,合正基,等.抗着丝点抗体在鉴别微核起源上的应用[J].癌变·畸变·突变,1994,(2):60-63.
[6] Makoto Hayashi.小鼠骨髓红细胞微核试验[A].曹佳,林真 (日本),余争平.微核试验原理、方法及其在人群监测和毒性评价中的应用[M].北京:军事医学科学出版社,2000:42-49.
[7] 余明泽,刘以农,蒋中仁,等.环磷酰胺诱导小鼠骨髓细胞微核的影响因素的研究 [J].现代预防医学,2007, (5):935-936.
[8] MehmetDogan Gulkac,GurlerAkpinar,HasanUstun,et al. Effects of vitamin A on doxorubicin-induced chromosomal aberrations in bone marrow cells of rats[J].M utagenesis, 2004,(3):231-236.
[9] Quiles,J.L.,Huertas,J.R.,Battino,M.,et al.Antioxidant nutrients and adriamycin toxicity[J].Toxicology,2002, (180):79-95.
[10] Ramos,K.S.,Melchert,R.B.,Chacon,E.and Acosta, D.,Jr Toxic response of the heart and vascular systems [A].InKlaassen,C.D.(ed.),Casarett and Doull’s Toxicology:Basic Science of Poisons[M].McGraw-Hill,New York,NY,2001:597-651.
[11] Barber,D.A.and Harris,S.R.Oxygen free radicals and antioxidants:a review[J].Am.phar m.,1994,(34):26-35.
[12] Tavares,D.C.,Cecchi,A.O.,Antunes,L.M.et al.Protective effects of the amino acid glutamine and of ascorbic acid against chromosomal damage induced by doxorubicin in mammalian cells[J].Teratog.Carcinog.M utagen., 1998,(18):153-161.
[13] Antunes,L.M.and Takahashi,C.S.Protection and induction of chromosomal damage by vitamin C in human lympHocyte cultures[J].Teratog.Carcinog.M utagen., 1999,(19):53-59.
[14] Marrazzo J M,Handsfield H H,Whittington W L.Predicting Chla-mydial and Gonococcal Cervical infection:I mplications for management of cervicits[J].Obstet Gynecol,2002,(3):579-584.
[15] 常征.阿霉素对昆明种小白鼠腹腔给药的半致死剂量研究[J].文山师范高等专科学校学报,2009,(4):110 -113.
[16] 孙敬方.动物学实验方法[M].北京:人民卫生出版社, 2001:199.
[17] Wang Xu,B.Miller,U.Kliesch et al.A study of aneuploidy induction by three mitotic arrestants in mouse bone marrow cells[J].Chinese Journal of Genetics,1991,(3): 209-217.
[18] 汪旭,李雯,周汝敏,等.微核直径测试作为非整倍体诱发剂的分析手段[J].遗传,1993,(3):16-19
[19] Tice RR,Erexson GL,Hilliard CJ,et al.Effect of treatment protocol and sample time on the frequencies of micronucleated polychromatic erythrocytes in mouse bone marrow and peripHeral blood[J].M utagenesis,1990, (4):313-321.
[20] Vanparys P,Deknudt G,Ver meiren F,et al.Sampling times in micronucleus testing[J].M utat Res,1992,282: 191-196.
[21] Foy C A,Parkes H C.Emerging homogeneous DNABased Technologies in the Clinical Laboratory[J]. ClinChem,2001,(6):990-1000.
[22] 付小锁,颜宜苣,韩丽.阿霉素对小鼠骨髓和外周血红细胞微核率的影响[J].北京医学,2000,(1):52-53.
[23] 许重洁,张艳芬,杨保胜,等.阿霉素诱导小鼠骨髓细胞微核影响因素研究[J].新乡学院学报:自然科学版,2008. 6,(2):48-50.
[24] 许重洁,张艳芬,杨保胜,等.阿霉素对小鼠骨髓微核和染色体的影响 [J].新乡医学院学报,2008,(4):357 -359.
(责任编辑 刘常福)
AStudy of the Optimal Time-Dose Effect of Doxorubici n on I nducing the Micronucleus Frequency in Mouse Bone Marrow by I ntraperitoneal I njection(i.p.)
CHANG Zheng1,2
(1.School ofLife Science,Yunnan Nor malUniversity,Kunming Yunnan 650092,China; 2.Department ofBiology and Chemistry,Wenshan University,Wenshan Yunnan 663000,China)
Objective to study ti me-dose effect of doxorubicin on inducing the micronucleus frequency in mouse bone marrow by intraperitoneal injection once.Methods 150 mice are divided into 5 groups randomly,30 mice one group,half male and half female.Each mouse is injected once by intraperitoneal injection.The dose is:control group is injected pHysiological saline;the dose of the remaining four groups is 2.5 mg/kg、5 mg/kg、10 mg/kg、20 mg/kg respectively.Micronucleus test were performed in mice after 18 h,24 h,30 h,48 h or 72 h,and the micronucleus frequency in mouse bone marrow and estimating doxorubicin genotoxicity in mice were counted.Results In the range of 2.5~20 mg/kg,with the increasing of dose,the percentage ofmicronucleus is higher,and the optimal sampling time is 48h after treatment.
Doxorubicin;Mice;Intraperitoneal injection;Micronucleus Frequency;Time-Dose Effect
R979.1
A
1674-9200(2010)02-0108-05
微核 (micronucleus,简称 MN),也叫卫星核,是真核类生物细胞中的一种异常结构,是染色体畸变在间期细胞中的一种表现形式。微核往往是各种理化因子,如辐射、化学药剂对分裂细胞作用而产生的。在细胞有丝分裂间期,微核呈圆形或椭圆形,游离于主核之外,大小应在主核 1/3以下。多数学者认为细胞通过两种机制产生微核:一是染色体断裂剂导致染色体断裂,产生无着丝粒断片或环,不能进入子细胞核,被包含在子细胞的胞质内,单独形成一个或几个规则的微核;二是纺锤丝毒性药物能抑制纺锤丝的形成,破坏染色体和纺锤体的连接,阻止细胞分裂中期纺锤丝将染色体拉至细胞的两端,染色单体行动滞后,不能进入子细胞的主核,而形成了一组微核,这样形成的微核体积往往略大于一般典型的微核。由于微核的产生与染色体和DNA损伤有较大关系,故常将微核的检出率作为DNA损伤的一种指标[1]。微核实验创建于 20世纪 70年代中期[2-3],而小鼠微核试验是目前检测化学物质导致染色体损伤方便、快速的方法,是遗传毒理实验常用的细胞遗传学方法之一[4-5]。所以目前许多国家(地区)和国际组织都将其视为评价新药、食品添加剂、农药、化妆品等化合物毒理安全性的必做试验之一[6-7]。
阿霉素——也叫亚德里亚霉素,属蒽环类药物,它被用作一种高效、广谱的抗肿瘤药物已有近 40年的历史,对乳腺癌、食道癌、霍奇金淋巴瘤、非霍奇金淋巴瘤、骨肉瘤、Kaposi肉瘤和软组织肉瘤均有较好的疗效[8]。阿霉素具有抑制 DNA合成的能力[9],还具有引起 DNA链断裂的潜能[10-11];阿霉素的细胞毒性作用可能通过各种各样的机制发生,如DNA的绑定、自由基的形成、膜成分的改变和功能丧失等等。先前的研究显示,阿霉素能诱导正常细胞和肿瘤细胞发生突变和染色体畸变[9,12,13],但在阿霉素的小鼠骨髓细胞微核实验中,微核检出率受到诸多因素影响,如小鼠品系、性别、给药途径、给药次数、剂量以及制片、染色、检测方法等,其中最重要的因素是用药剂量和采样观察时间等[14],因此,笔者设计了本试验来检测阿霉素诱发产生微核的最佳时间和剂量。在笔者[15]前面的实验中,得到了阿霉素腹腔注射昆明种小白鼠的半致死剂量LD50值为 24.941 mg/kg,95%的可信限为 21.241~29.271 mg/kg。而在本实验中,笔者用 10%LD50、20%LD50、40%LD50和 80%LD50等四个剂量和 18 h、24 h、30 h、48 h、72 h等五个取样时间[6]进行交叉试验设计讨论了小鼠腹腔注射阿霉素诱发产生微核的最佳时间和剂量的问题,这将对阿霉素的临床应用提供一定的参考依据,同时本试验的方法和结果又对相关人员具有一定的指导和借鉴意义。
2009-09-25
常 征 (1975-),男,云南马关人,副教授,主要从事生物化学和遗传学方面的教学和研究。

