BDE-47对2种海洋微藻光合特性的影响
李卓娜,孟范平,赵顺顺,于 腾
(中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100)
BDE-47对2种海洋微藻光合特性的影响
李卓娜,孟范平∗,赵顺顺,于 腾
(中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100)
研究了不同浓度的 2,2′,4,4′-四溴联苯醚(BDE-47)对 2种海洋微藻的光合特性的影响. 结果表明, 在试验所设定的浓度范围内(0.1~2.5μg/L),海水小球藻和赤潮异弯藻的PSII最大光能转化效率(Fv/Fm)、光化学淬灭系数(qP)未受到显著抑制,表明2种微藻PSII反应中心在试验过程中未受到损伤.当BDE-47浓度为2.5μg/L时,海水小球藻的PSII潜在活性(Fv/Fo)、PSII实际光能转化效率(φPSII)和光合电子传递效率(ETR)在96h受到显著抑制,而赤潮异湾藻的3个参数在暴露期间均未受到抑制,表明赤潮异湾藻对BDE-47的耐受性强于海水小球藻.各叶绿素荧光参数中, Fv/Fo、φPSII、ETR更适合作为指示海洋环境中BDE-47污染水平的生物标志物.
2,2′,4,4′-四溴联苯醚(BDE-47);微藻;叶绿素荧光
Abstract:Effects of 2, 2′, 4, 4′-tetrabrominated biphenyl ether (BDE-47) on photosynthetic characteristics of two marine microalgae were comprehensively investigated. The results showed that no significant inhibition of maximal photochemical efficiency of PSII(Fv/Fm), photochemical quenching (qP) of Chlorella sp. and Heterosigam akshiwo were determined at the concentration of 0.1~2.5μg/L, which meant that BDE-47 didn′t cause damage to PSII reaction center of the two algae. At the dose of 2.5 μg/L PSII potential fluorescence efficiency (Fv/Fo), actual photochemical efficiency of PSII(φPSII) and electron transport rate (ETR) of Chlorella sp.. were inhibited distinctly after exposed to BDE-47 for 96h. And φPSII, Fv/Foand ETR of Heterosigam akashiwo, weren′t observed inhibition at the BDE-47 concentration of 2.5 μg/L, which revealed that this microalgae was more tolerant than Chlorella sp.. Among all of chlorophyll fluorescence parameters, Fv/Fo, φPSII and ETR are more suitable to be used as biomarkers for evaluation of pollution level of BDE-47 in marine environment.
Key words:2, 2′, 4, 4′-tetrabrominated biphenyl ether (BDE-47);microalgae;chlorophyll fluorescence parameters
植物体内发出的叶绿素荧光信号极易随外界环境的变化而变化,可以灵敏、快速和无破坏性地指示各种逆境对光合作用过程的影响[1].据此可利用植物体内的叶绿素作为天然探针,研究和探测植物光合的生理状况及各种外界因子对光合系统的细微影响,这种植物活体测定和诊断技术被称为叶绿素荧光动力学技术[2].目前,叶绿素荧光分析技术正在逐渐取代传统的分光光度法而成为应用最为广泛的技术,关于利用叶绿素荧光分析技术进行干旱[3]、强光[4]、低温[5]、高温[6]、抗盐[7]、营养盐限制[8]等植物抗逆性生理研究已有较多报道.
20世纪70年代以来,多溴联苯醚(PBDEs)作为阻燃剂广泛应用于石油、纺织品、塑料制品、建筑材料、交通设备和电子产品中[9],随着全球PBDEs消耗量的不断增加,海洋环境中 PBDEs的浓度随之急剧上升[10].PBDEs进入海洋后,可在生物体内大量富集,2,2′,4,4′-四溴联苯醚(BDE-47)是海洋生物体中最主要的PBDEs同系物.现有研究表明,生物对BDE-47的吸收速度大于其它PBDEs[11],对生物和人体具有较强的毒性作用[12],但是关于BDE-47对海洋微藻的光合特性有何影响尚未见报道.本研究选用BDE-47为研究对象[13-14],在受控条件下通过微藻培养试验测定海水小球藻和赤潮异弯藻在暴露于不同浓度BDE-47后的叶绿素荧光参数变化,由此分析PBDEs对海洋微藻光合特性的影响,同时,通过比较各叶绿素荧光参数之间对 BDE-47的响应敏感性差异,确定更适合作为指示海洋环境中BDE-47污染水平的生物标志物.
1 材料与方法
1.1 材料
海水小球藻(Chlorella sp.)和赤潮异弯藻(Heterosigam akashiwo)分别由中国海洋大学和中国科学院海洋研究所提供.
海水取自青岛大麦岛近岸海域,黑暗沉淀后经0.45μm滤膜过滤,煮沸消毒,冷却后配制培养液.
F/2培养液按照陈明耀的方法配制[15].
BDE-47试验溶液:采用纯度 100%的 BDE-47(GC-MS级,AccuStandard公司)配制.由于BDE-47微溶于水,故以N,N-二甲基甲酰胺(DMF,色谱纯,天津市科密欧化学试剂有限公司)为溶剂配制BDE-47母液,4℃下保存备用.试验时用F/2培养液依次稀释成所需浓度的试验溶液.其余试剂均为分析纯.
1.2 藻种的培养
根据急性毒性试验的结果(BDE-47抑制海水小球藻、牟氏角毛藻、中肋骨条藻和赤潮异弯藻生长的 96h EC50分别为 0.79,1.52,1.99,2.25μg/L),设置3个BDE-47处理浓度:0.1,1.0, 2.5μg/L.同时设量对照处理(只加入F/2培养液和等体积的DMF,不含BDE-47).
对于海水小球藻,取12只500mL具塞三角瓶(预先在稀硝酸中浸泡 48h,消毒海水冲洗干净),分成4组,每组3瓶.在每个三角瓶中各加入150mL F/2培养液,分别加入BDE-47储备液,使每组培养液中BDE-47的浓度达到上述设计浓度;再接种处于指数生长期的微藻,使每个处理组的初始藻细胞密度达到 5×106个/mL.将接种微藻后的三角瓶在光照培养箱中培养,培养条件为:温度(25±0.2)℃,盐度28,pH值为8.1~8.4;光暗比12h:12h,光强80μmol/ (m2·s),每天定时人工摇动 3次,并且随机调换三角瓶的位置以尽可能使试验藻液受光均匀.分别在24,48,72,96h取样,使用Water-PAM水样调制叶绿素荧光仪测定各种微藻的叶绿素荧光参数,测定结果以平均值±标准差(n=3)表示.
赤潮异弯藻的试验方法同上,但是初始藻细胞密度控制在5×105个/mL.
1.3 叶绿素荧光参数的测定方法
采用Water-PAM水样调制叶绿素荧光仪测定2种海洋微藻PSII的叶绿素荧光参数.测定前将微藻样品暗适应 15min,先照射弱检测光[0.12μmol/(m2·s)],可测得初始荧光 Fo(PSII反应中心全部开放时的荧光水平),再照射饱和脉冲光[4000μmol/(m2·s),脉冲时间 0.8s],可测得最大荧光Fm(PSII反应中心全部关闭时的荧光水平). PSII最大光能转化效率(Fv/Fm)、PSII实际光能转化效率(φPSII)、光合电子传递效率(ETR)和光化学淬灭系数(qP)各参数通过 Water-PAM水样调制叶绿素荧光仪直接读出,PSII潜在活性(Fv/Fo)可用公式(Fm-Fo)/Fo计算.
1.4 数据分析
试验结果采用单因素方差分析法(One-way ANOVA analysis)对不同BDE-47浓度胁迫下的2种海洋微藻叶绿素荧光参数的差异显著性进行分析.
2 结果
2.1 海水小球藻叶绿素荧光参数随BDE-47浓度的变化
在不同质量浓度BDE-47的培养液中海水小球藻各叶绿素荧光参数随培养时间的变化情况见图1(A)~图 1(E).在不同浓度的 BDE-47暴露期间, Fv/Fm与对照组无显著性差异(P>0.05).在 0.1和2.5μg/L的BDE-47处理组中,暴露48h的海水小球藻Fv/Fo、φPSII、ETR的测定值均显著高于同期的对照组水平(P<0.05),增幅分别为 8.93%、5.56%、5.42%和7.14%、5.56%、4.25%.1μg/L处理组Fv/Fo、φPSII和ETR的测定值在BDE-47暴露期间始终与对照组无显著差异(P>0.05).此外,各处理组的Fv/Fo、φPSII和ETR在96h时已呈现下降趋势,其中,2.5μg/L的BDE-47处理组受到较大的抑制,与对照组差异显著(P<0.05).
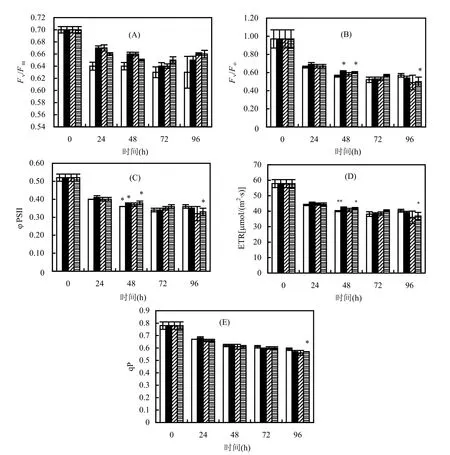
图1 暴露于BDE-47的海水小球藻叶绿素荧光参数的变化Fig.1 Changes of chlorophyll fluorescence parameters of Chlorella sp. exposed to BDE-47数据以3次平行平均值±SD表示, *和**分别表示在P<0.05和P<0.01水平下差异显著
在BDE-47暴露期间,各处理组的海水小球藻qP测定值与对照组之间虽然不存在显著性差异(P>0.05),但是总体上随暴露浓度和处理时间增加略呈下降态势.
2.2 赤潮异湾藻叶绿素荧光参数随BDE-47浓度的变化
在含有不同浓度 BDE-47的培养液中,赤潮异湾藻的各叶绿素荧光参数随培养时间的变化趋势如图2(A)~图2(E)所示.
由图2(A)可见,在0.1μg/L BDE-47的处理组中,暴露培养24h和48h的赤潮异湾藻Fv/Fm显著高于对照组(P<0.05),增幅分别为5.00%和13.46%; 1μg/L处理组中,Fv/Fm24h、48h、72h均显著高于对照组(P<0.05),增幅分别为 6.67%、19.23和37.21%;暴露于2.5μg/L BDE-47时,Fv/Fm变化比较迟缓,24h时没有明显变化,48h和72h时显著高于对照组(P<0.05),增幅分别为21.15%和32.56%.暴露96h时,各浓度处理组Fv/Fm降至与对照组差异不显著的水平(P>0.05).
由图 2(B)~图 2(D)可见,同对照组相比,处理组的Fv/Fo、φPSII和ETR都呈现出先升后降的变化趋势.0.1μg/L BDE-47胁迫下,赤潮异湾藻的Fv/Fo、φPSII和ETR均在24h达到最高值,相比对照组,分别升高16.67%、8.51%和8.31%;随后3个参数虽然出现下降趋势,但是在 48h时仍显著高于对照组(P<0.05),增幅分别为 45.65%、25.00%和27.32%;72h后3个参数的测定值与对照组差异不明显(P>0.05).在1μg/L BDE-47的处理组中,Fv/Fo、φPSII和 ETR的测定值在暴露48h、72h时显著高于对照组(P<0.05),增幅分别为91.30%、46.88%、48.24%和38.89%、22.22%、24.49%,而其他暴露时间与对照组均无明显差异(P>0.05);暴露于2.5μg/L的BDE-47时,3个参数在 48h和 72h相比对照组分别增加 86.96%、43.75%、46.07%和 61.11%、37.04%、38.20%,其他暴露时间则与对照组差别不大(P>0.05).
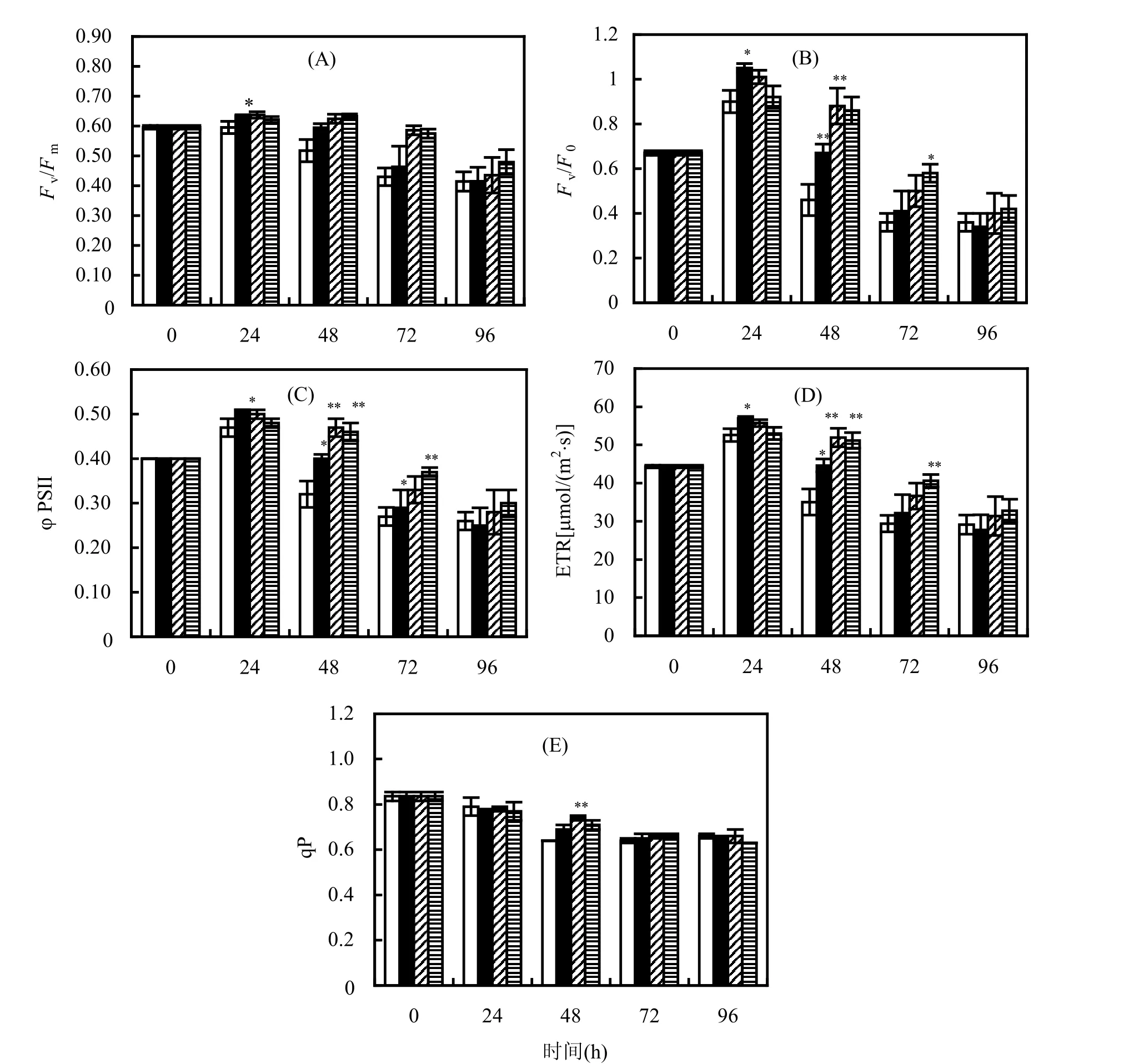
图2 暴露于BDE-47的赤潮异湾藻叶绿素荧光参数的变化Fig.2 Changes of chlorophyll fluorescence parameters of Heterosigam akashiwo exposed to BDE-47注同图1
由图2(E)可见,与对照组相比,各浓度处理组的赤潮异湾藻qP仅在暴露培养48h时显著升高(P<0.05或P<0.01),增幅分别为7.81%、15.63%和10.94%.其他暴露时间均未发现qP值与对照组存在明显差异.
3 讨论
叶绿素荧光动力学技术在测定植物光合作用过程以及表达光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用.借助叶绿素荧光动力学变化,可深入了解污染物对植物光合系统(主要是PSII)的影响及植物对逆境的响应机理[16].
当微藻等植物受到高温[1,17]、汽车尾气污染
[18]、重金属污染[19-20]等逆境胁迫时,反映植物光合作用强度的叶绿素荧光参数都会受到影响,一般表现为Fv/Fm、Fv/Fo、φPSII、ETR的降低,并且下降幅度随着胁迫时间的延长逐步增大;而植物的qP在逆境胁迫下既可能增大,也可能降低.此外,不同种类的植物叶绿素荧光参数对同种逆境胁迫的响应趋势明显不同[1].
Fv/Fm用于度量原初的光能转换效率,可反映PSII反应中心活性大小,并直接衡量植物光合作用能力.正常情况下,该参数很稳定(藻类一般为 0.65)[21],但在逆境下明显下降.本研究中,在BDE-47 3个浓度的暴露期间,并未发现海水小球藻的 Fv/Fm受到抑制,始终与对照组无显著性差异(P>0.05),说明所选用的 BDE-47浓度不足以对海水小球藻的 PSII反应中心造成损伤.BDE-47处理组中赤潮异湾藻的Fv/Fm也未受到抑制,在暴露初期(72h以内)均有显著上升(P<0.05),然后降低到与对照组差异不显著的水平(P>0.05),说明浓度0.1~2.5μg/L的BDE-47能刺激赤潮异湾藻PSII反应中心活性,增强了过剩光能的非光化学耗散,缓解逆境胁迫对叶绿素等大分子的伤害,提高机体的耐受性.
Fv/Fo代表从 Chla/b蛋白复合体 LHCP到PSII的光能传递能力,常用于度量PSII的潜在活性;ETR能够反映高能电子经过电子传递链在PSII和PSI之间的传递效率;φPSII是指PSII所吸收的光量子中用于光化学反应的比例,与碳同化反应的程度密切相关.本研究中,每种微藻的 3个参数对BDE-47暴露的响应均较为一致,呈现出先升后降的变化趋势,说明一定浓度范围内的BDE-47能够提高海洋微藻光合系统的传能效率和碳同化过程.各处理组的海水小球藻在BDE-47暴露后期,3个参数已呈下降态势,其中,2.5μg/L的BDE-47处理组已经受到明显抑制(P<0.05).而赤潮异湾藻的3个参数在BDE-47暴露期间均未受到抑制,这表明赤潮异湾藻对BDE-47的耐受性强于海水小球藻.本研究中, 2.5μg/L的 BDE-47处理组的海水小球藻的Fv/Fo、φPSII和ETR在96h受到抑制(P<0.05),但 Fv/Fm与对照组无显著差别(P<0.05),表明BDE-47能降低海洋微藻的传递效率.苏行[22]和黎明等[23]分别测定城市大气污染物对植物叶绿素荧光特性的影响,发现大气污染物SO2和NOx能够造成植物 Fv/Fm、Fv/Fo的下降,且后者的下降幅度大于前者,表明大气污染能抑制原初光能转化和传能效率,以传能效率受抑更为显著.
qP即激发能被开放的PSII反应中心捕获并转化为化学能而导致的荧光淬灭.该参数反映了PSII天线色素吸收的光能用于光合作用的份额,是对原初电子受体QA(PSII电子传递的原初醌受体,决定着PSII对激发能的捕获速率) 氧化态的一种量度.较低的qP表示PSII中开放的反应中心比例和参与CO2固定的电子减少;qP上升则表明电子由PSII的氧化侧向PSII反应中心的传递加快,即用于进行光合作用的电子增加.本研究中,海水小球藻的qP测定值与对照组之间不存在显著性差异(P>0.05),表明 BDE-47不会显著影响电子由PSII的氧化侧向PSII反应中心的传递速度.马树华等[18]的研究发现,随着汽车尾气熏气时间的延长和熏气浓度的增加,五角槭等 4种植物的 qP逐渐降低.苏行等[22]报道,大叶紫葳和白兰叶片的qP随污染程度的加剧而减少.赤潮异弯藻在暴露于BDE-47后,qP值表现出先上升后下降的趋势,这与梁英等[24]研究 Zn2+胁迫对纤细角毛藻叶绿素荧光参数影响所得到的趋势相同.qP值的增加,意味着电子由 PSII的氧化侧向PSII反应中心的传递速度加快,用于进行光合作用的电子增多,对激发能的利用率提高,这与赤潮异湾藻在BDE-47暴露初期Fv/Fo、φPSII、ETR的增加是一致的,表明赤潮异湾藻经 1~2.5μg/L的BDE-47处理96h期间,光合作用并未受到影响,显示其对BDE-47的耐受性强于海水小球藻.
4 结论
4.1 BDE-47浓度在0.1~2.5μg/L时, 不会损伤海水小球藻PSII反应中心的活性,但能刺激赤潮异弯藻的PSII反应中心活性.
4.2 海水小球藻和赤潮异弯藻对 BDE47具有一定的适应性,赤潮异弯藻对BDE-47的耐受性强于海水小球藻.
4.3 本研究中所选用的5个叶绿素荧光参数中, Fv/Fo、φPSII、ETR更适合作为指示海洋环境中BDE-47污染水平的生物标志物.
[1] 梁 英,尹翠玲,江新琴,等.硅浓度对纤细角毛藻和三角褐指藻生长及叶绿素荧光特性的影响 [J]. 海洋水产研究, 2007,28: 89-94.
[2] Young E B, Beardall J. Photosynthetic function in Dunaliella tertiolecta (Chlorophyta) during a nitrogen starvation and recovery cycles [J]. Phycology, 2003,39:897-905.
[3] Massaccia M, Nabievb S M L, Pietrosantia L, et al. Response of the photosynthetic apparatus of cotton (Gossypium hirsutum) to the onset of drought stress under field conditions studied by gas-exchange analysis and chlorophyll fluorescence imaging [J]. Plant Physiology and Biochemistry, 2008,46:189-195.
[4] Wang Q, Zhang Q D, Zhu X G, et al. PSII photochemistry and xanthophy II cycle in two superhigh-yield rice hybrids during photoinhibition and subsequent restoration [J]. Acta Botanica Sinica, 2002,44:1297-1302.
[5] Rizza F, Pagani D, Stanca A M, et al. Use of chlorophyll fluorescence to evaluate the cold acclimation and freezing tolerance of winter and spring oats [J]. Plant Breeding, 2001,120: 389-396.
[6] Dusan L, Petr I. High temperature induced chlorophyll fluorescence changes in barely leaves [J]. Plant Science, 1997,124: 159-164.
[7] Zribi L, Fatma G, Fatma R, et al. Application of chlorophyll fluorescence for the diagnosis of salt stress in tomato “Solanum lycopersicum (variety Rio Grande)” [J]. Scientia Horticulturae, 2009,120:367-372.
[8] Beardall J, Berman T, Heraud P, et al. A comparison of methods for detection of phosphate limitation in microalgae [J]. Aquatic Science, 2001,63:107-121.
[9] 王 俊,张 干,李向东,等.珠江三角洲地区大气中多溴联苯醚的被动采样观测 [J]. 中国环境科学, 2007,27(1):10-13.
[10] Zegers B N, Lewis W E, Boon J P. Levels of some polybrominated diphenyl ether (PBDE) flame retardants in dated sediment cores [J]. Organohalogen Compounds, 2000,47:229-232.
[11] Stapleton H M, Letcher R J, Li J, et al. Dietary accumulation and metabolism of polybrominated diphenyl ethers by juvenale carps (Cyprinus carpio) [J]. Environmental Toxicology and Chemistry, 2004,23:1939-1946.
[12] 张 明,卫 红,何 平,等.多溴联苯醚对SH-SY5Y细胞氧化应激及凋亡的影响 [J]. 中华劳动卫生职业病杂志, 2007,25(3): 145-147.
[13] Ueno D, Inoue S, Takahashi S, et al. Global pollution monitoring of polybrominated diphenyl ethers using Skipjack tuna as bioindicator [J]. Environmental Science and Technology, 2004,38: 2312-2316.
[14] Kajiwara N, Kamikawa S, Ramu K, et al. Geographical distribution of polybrominated diphenyl ethers (PBDEs) and organochlorines in small cetaceans from Asian waters [J]. Chemosphere, 2006,64:287-295.
[15] 陈明耀.生物饵料培养 [M]. 北京:中国农业出版社, 1995:25.
[16] 武宝玕,韩志国,藏汝波.热胁迫对海洋红藻及绿藻叶绿素荧光的影响 [J]. 暨南大学学报 (自然科学版), 2002,23:108-112.
[17] 孙宪芝,郑成淑,王秀峰.高温胁迫对切花菊“神马”光合作用与叶绿素荧光的影响 [J]. 应用生态学报, 2008,19:2149-2154.
[18] 马树华,王庆成,李亚藏.汽车尾气对四种北方阔叶林叶绿素荧光特性的影响 [J]. 生态学杂志, 2005,24:15-20.
[19] 万雪琴,张 帆,夏新莉,等.镉处理对杨树光合作用及叶绿素荧光的影响 [J]. 林业科学, 2008,44:73-78.
[20] Raua S, Miersch J, Neumann D. Biochemical responses of the aquatic moss Fontinalis antipyretica to Cd, Cu, Pb and Zn determined by chlorophyll fluorescence and protein levels [J]. Environmental and Experimental Botany, 2007,59:299-306.
[21] 陈莲花,刘 雷.叶绿素荧光技术在藻类光合作用中的应用 [J].江西科学, 2007,25:788-790.
[22] 苏 行,胡迪琴,林植芳,等.广州市大气污染对两种绿化植物叶绿素荧光特性的影响 [J]. 植物生态学报, 2002,26:599-604.
[23] 黎 明,马焕成,李复秀,等.城市大气污染对云南拟单性木兰苗期气体交换及叶绿素荧光的影响 [J]. 西北林学院学报, 2005,20:46-50.
[24] 梁 英,王 帅,冯力霞,等.重金属胁迫对纤细角毛藻生长及叶绿素荧光特性的影响 [J]. 中国海洋大学学报, 2008,38:59-67.
Efects of BDE-47 on the chlorophyll fluorescence parameters of two species of marine microalgae.
LI Zhuo-na, MENG Fan-ping*, ZHAO Shun-shun, YU Teng
(Key Laboratory of Marine Environment Science and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China). China Environmental Science, 2010,30(2):233~238
X503.2
A
1000-6923(2010)02-0233-06
李卓娜(1983-),女,山东青岛人,硕士,研究方向为生物监测.
2009-06-01
中国海洋大学引进人才科研启动经费项目(HD 19990016)
* 责任作者, 教授, fanpingmeng@tom.com

