198例胃癌手术标本Her-2蛋白表达与临床病理的相关性和靶向治疗
奚文崎 张本炎 金晓龙 杨卫平 燕敏 王建承
上海交通大学医学院附属瑞金医院肿瘤科,*病理科,▲普外科,上海 200025
胃癌是消化系统最常见的恶性肿瘤,世界范围内,胃癌发病率在常见肿瘤中排名第4位[1],居目前肿瘤死亡的第2位[2]。20世纪90年代以后,化疗新药和新辅助治疗方案的运用使胃癌术后患者的生存率有所改善(30%~50%),但总体疗效仍很差,生存获益有限(<10%)[3]。因此,胃癌研究依然是癌症研究中的重点。胃癌的发生和发展,癌细胞的增殖、浸润和转移与多个基因的异常有关。近年来国内外针对不同的基因异常和细胞通路开展了多个靶向治疗。其中最引人瞩目的是2009年ASCO会议上公布的TOGA临床试验初步结果,结果显示,曲妥珠单抗联合化疗组的总生存期(overall survival,OS)较单纯化疗组显著延长2.4个月(13.5个月 vs 11.1个月,HR=0.74,95%CI:0.60~0.91,P=0.004 8),死亡率降低26%,确立了曲妥珠单抗在胃癌治疗中的地位[4]。曲妥珠单抗通过抑制Her-2介导的信号传导途径,阻断Her-2受体细胞外区域分裂和激活抗体依赖性细胞介导的细胞毒性作用来抑制肿瘤生长。
Her-2基因定位于人17号染色体(17q21-22),毗邻于拓扑异构酶Ⅱa基因旁[5-6]。已在乳腺癌、卵巢癌、肺癌、胃癌和结肠癌的细胞中检测到Her-2基因扩增或蛋白过表达。在乳腺癌研究中已经证实有15%~25%的病例发生Her-2基因的扩增和Her-2蛋白的过表达,这类患者往往是肿瘤恶性程度高、进展迅速的病例,且化疗缓解期短,对标准化疗和内分泌治疗易产生耐药,患者的无病生存和总生存期缩短[7]。因此,在乳腺癌中Her-2已是一个非常有价值的预测化疗和内分泌治疗反应率的指标[8]。
目前,对恶性肿瘤的研究发现[4]:Her-2的过表达与多种实体瘤的侵袭和转移密切相关。至今国内大样本研究Her-2在胃癌侵袭、转移中作用的报道较少,本研究拟用免疫组化方法,检测由198例胃癌病例构建的组织芯片中Her-2蛋白的表达,就其表达状况与临床病理学指标、生存期的相关性进行统计学分析,探讨Her-2与胃癌的发展、转移和预后之间的相互关系,为胃癌的个体化治疗提供基础。
1 资料和方法
1.1 临床资料
选取2002年1月—2005年4月在上海交通大学医学院附属瑞金医院行胃癌外科手术的病理标本260例。所有患者术后每年随访2次,本研究随访工作截止于2010年3月。最长随访时间为98个月,最短随访时间为69个月,随访资料完整病例共198例。所有标本经4%甲醛固定,常规取材,石蜡包埋,并经HE染色确诊。按照2003年WHO消化系统肿瘤病理学和遗传学中胃癌组织学分类标准将进展期胃癌分为腺癌、乳头状腺癌、管状腺癌、黏液腺癌和印戒细胞癌等。根据Lauren胃癌分型将胃癌分为肠型(intestinal type)和弥漫型胃癌(diffuse type)两类[9]。采用AJCC第6版的分类方法进行TNM分期评估和临床分期评估[10]。
1.2 组织芯片的构建
采用组织芯片(tissue microarray,TMA)制作仪(上海芯超公司制作),每例癌组织选2点,另选其中89例正常胃黏膜1点作对照组。
1.3 免疫组织化学染色
采用Ventana全自动免疫组织化学仪(Bench Marker)进行免疫组织化学染色。实验按产品说明书操作。选择Her-2蛋白表达阳性(+++)和阴性的乳腺浸润性癌分别作为阳性和阴性对照组。正常胃黏膜上皮表达情况作正常对照。步骤:⑴脱蜡5 min×5次;⑵抗原修复,pH=6.0,37 ℃,30 min;⑶滴加一抗,37 ℃,32 min;⑷滴加二抗,37 ℃,30 min;⑸DAB显色8 min;⑹苏木精复染细胞核;⑺常规梯度酒精脱水,二甲苯透明,中性树胶封片。一抗:Her-2为即用型鼠抗人Her-2单抗,克隆号4B5 (美国罗氏公司生产)。
1.4 Her-2免疫组织化学标记评判标准
Her-2定位于细胞膜。强度标准采用Hofmann评判法[8]:免疫组织化学阴性(0):不染色或<10%的细胞膜染色;免疫组织化学阴性(1+):>10%的细胞膜染色较浅或仅有部分膜染色;免疫组织化学可疑(2+):>10%的细胞膜或外膜轻到中度染色;免疫组织化学(3+):细胞膜360°强染色或U字形强染色的癌细胞数量>10%。
1.5 统计处理
检测数据用SPSS 13.0统计分析软件进行,计数资料的分析采用χ2检验,使用Kaplan-Meier方法估计生存率,Log-Rank检验方法分析生存率的差异,逐步Cox回归分析筛选生存率的影响因素,进入和剔除方程标准皆为0.05。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况
构建组织芯片的198例胃癌中男性147例,女性51例,男女比例为2.9∶1。中位年龄66.5岁(31~85岁),其中61例患者<60岁,127例患者≥60岁。所有患者术前均经胃镜活检病理学证实为原发性胃癌。其中手术方式以D2根治术者149例,姑息性切除术者24例;肿瘤位于食管胃连接部者49例,胃窦体部者149例;肿瘤最大直径≤5 cm 111例,>5 cm87例;病理类型以Lauren’s分型为标准,其中肠型者169例、弥漫型29例。远处转移12例;切缘阳性8例;肿瘤侵犯神经15例、肿瘤侵犯脉管28例、肿瘤侵犯淋巴管4例、肿瘤侵犯食道8例;临床分期:Ⅰ~Ⅱ期61例(其中Ⅰ期31例,Ⅱ期30例)、Ⅲ~Ⅳ期 137例(其中Ⅲ期95例,Ⅳ期42例);术后死亡92例,存活106例,5年总生存率为53.6%,其中肠型胃癌患者5年生存率为58%,弥漫型胃癌患者为36%。
2.2 免疫组化标记结果

图1 胃癌组织与正常胃黏膜Her-2免疫组织化学标记结果Fig.1 Immunohistochemical staining of gastric carcinomas and normal mucosa with Her-2 antibody(DAB,×100)
在198例胃癌中,Her-2 免疫组织化学标记(0)者82例、免疫组织化学标记(1+)者52例、免疫组织化学标记可疑(2+)者36例、免疫组织化学标记(3+)者29例,其中免疫组织化学标记(3+)和免疫组织化学标记可疑(2+)者共65例,Her-2阳性表达率达32.8%。正常胃黏膜中不表达Her-2(图1)。
2.3 Her-2表达与临床病理学特点的相关性
Her-2的表达与Lauren分型相关,Her-2在肠型胃癌中表达率为36.7%,在弥漫型胃癌中表达率仅为10.4%。Her-2过表达与肿瘤大小、Lauren分型、浸润深度和临床分期相关(P<0.05),而与患者年龄、性别、肿瘤部位、肿瘤大小、手术切除方式、淋巴结转移、侵犯神经、侵犯脉管、侵犯淋巴管及侵犯食管无关(表1)。
2.4 Her-2与生存期分析
在胃癌组织中Her-2阳性表达组的生存率与Her-2阴性表达组差异无统计学意义(P>0.05)(图2)。
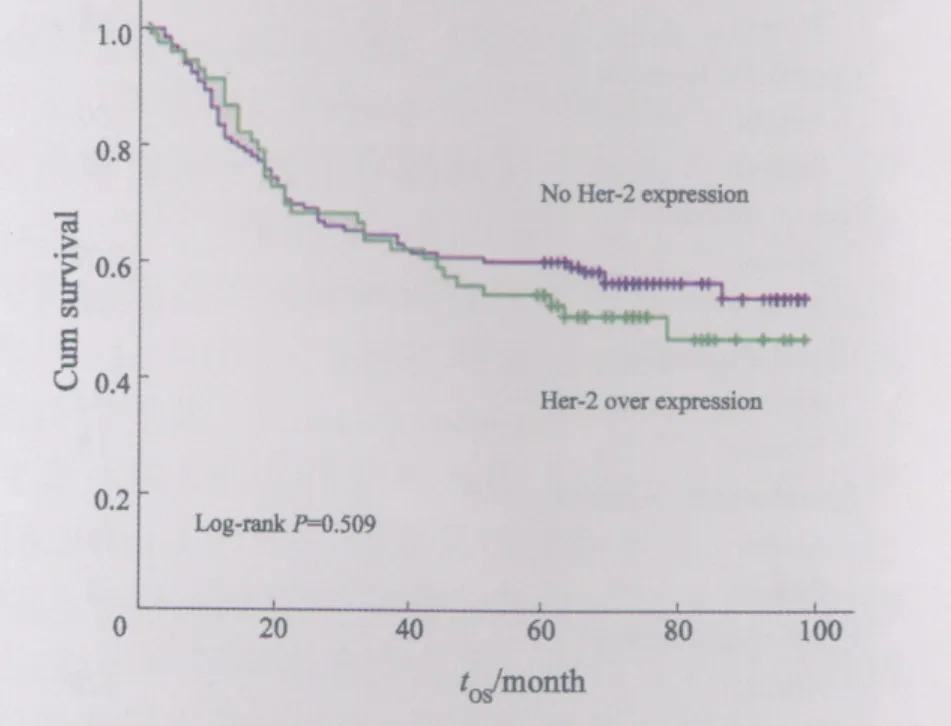
图2 Her-2蛋白表达阳性组胃癌与阴性组胃癌患者的5年生存率比较Fig.2 Comparison 5-year survival rate of Her-2 positive GC patients with Her-2 negative GC patients
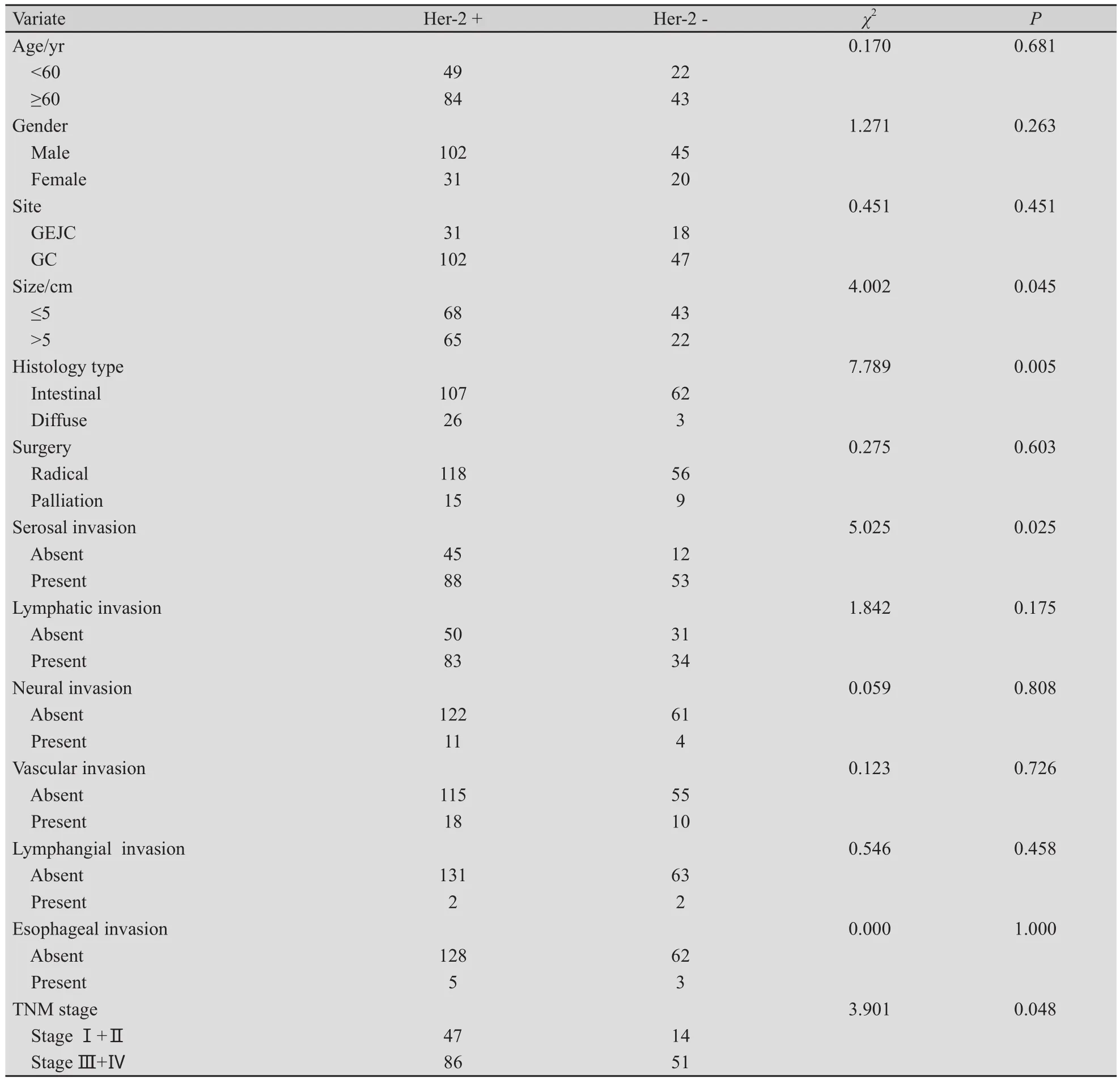
表1 胃癌组织中Her-2蛋白表达与临床病理参数的相关性分析Tab.1 Correlation between Her-2 protein expression and clinicopathologic parameters(n)
2.5 逐步多因素Cox回归分析
逐步Cox回归分析结果表明手术切除方式(P<0.002)、组织病理学类型(P<0.032)、淋巴结转移数目(P<0.003)、侵犯淋巴管(P<0.003)、TMN分期(P=0.000)与胃癌术后患者长期生存相关,而在本研究中性别、年龄、肿瘤位置、肿瘤大小、侵犯血管或神经、切缘阳性、侵犯食道,Her-2过表达间差异无统计学意义(P>0.05),与患者的远期生存无关(表2)。
3 讨 论
1986年Sakai等[11]率先报道采用免疫组化方法在胃癌中检测出Her-2蛋白过表达。20世纪90年代,文献报道胃癌中运用多克隆抗体检测Her-2蛋白表达率为9%~38%[12-14]。近年来Tanner等[15]报道在食道腺癌中Her-2过表达率为24%。但是,Her-2基因扩增或蛋白过表达的临床意义尚不明确。不同组胃癌研究中Her-2基因扩增或蛋白过表达的结论不一致。Her-2阳性率从最低6%到最高43%不等[16-17]。造成如此大差异的原因很多:可能是研究组的胃癌患者组成不同,西方组以胃上部癌为主,而亚洲组则以中下部胃癌为主;也可能与免疫组化检测Her-2抗体的不同有关,都会影响Her-2的检出率。胃癌的异质性明显高于乳腺癌,其成为影响Her-2检出率的非常重要的因素。 此外,缺乏对胃癌中Her-2 表达结果的判断标准也是重要原因之一。本实验采用Hofmann评分法进行Her-2阳性表达评分。对于Her-2可用FISH双色荧光原位杂交技术检测Her-2基因状况,也可用IHC检测Her-2蛋白,FISH方法敏感性强,被认为是金标准。但是要注意,基因扩增并不意味着蛋白过表达,因为翻译和转录也参与调节蛋白的合成。正常细胞与转化细胞的翻译效率并不相同,已有文献证实,少数乳腺癌和胃癌细胞Her-2蛋白高表达却没有基因扩增。此外,由于胃癌肿瘤存在异质性,免疫组织化学标记能在明视野下观察形态,更能准确检测到肿瘤组织内局部Her-2蛋白的阳性表达情况[4]。

表2 198例胃癌患者临床病理参数的Cox多因素逐步回归分析Tab.2 Multiple step-wise logistic Cox analysis of clinicopathologic parameters in 198 cases with gastric carcinoma
自1990年起有不少学者开始研究Her-2表达与肠型胃癌的相关性。最近有几项研究也已证实Her-2在肠型胃癌中高表达。本研究结果显示Her-2在肠型胃癌中表达高于弥漫型胃癌(36.7% vs 10.3%,P=0.005),与Gravalos等[18]及其他学者报道相似[19-20]。 本组研究与2009年ACSO会议上报道的TOGA试验[4]结果比较(32% vs 6.1%,P<0.001)基本相似。本研究略有升高,提示在我国胃癌病例的组成中肠型胃癌的比例比欧洲更高。Kang等[19]报道Her-2基因扩增与肿瘤位置有关,而且肠型胃癌的表达率高于弥漫型胃癌。而本研究中发现Her-2表达与肿瘤部位无关。全球胃癌发病的流行病学分析发现欧美国家以食管胃连接部肿瘤常见[14,17,21],而亚洲包括日本和我国胃癌患者的发病部位以胃窦体部为多见,食管胃连接部肿瘤相对较少。这种区别反映了东西方胃癌患者的发病机制不同。
关于Her-2是否能作为胃癌的主要预测因子的观点争议较多,因为各组研究结果不一[18,20]。Tanner等[15]报道,采用色素原位杂交(CISH)检测131例胃癌患者中Her-2的总基因扩增率为12%,其中在100例贲门癌患者中,Her-2基因扩增率为24%。Her-2基因扩增与生存期缩短显著有关(P=0.0089),Her-2阴性患者的生存期(12.7个月)较Her-2阳性患者(6.6个月)的生存期延长2倍,但差异却无统计学意义(P>0.05),可能是因为样本数较少。最近Park等[22]报道, Her-2过表达提示中位生存期缩短(922 d vs 3 243 d),5年生存率降低(21% vs 63%,P<0.05)。 Vizoso等[23]报道Her-2高表达胃癌患者的无病生存期和生存期相对更短。而Garcia等[24]得出相反的结论,认为Her-2水平与胃癌患者的临床病理特性无明显关系。张杰等[25]认为Her-2基因扩增或过表达与胃旁淋巴结转移无关。Pinto-de-sousa等[26]报道,Her-2过表达的5年生存率明显低于Her-2正常患者(16.2% vs 43.7%),经多变量分析发现,Her-2过表达与静脉侵犯的胃癌和贲门、胃体、胃底部癌的5年生存率影响不显著,但对无静脉侵犯的胃癌和胃窦部胃癌的5年生存率则有影响。
本研究显示Her-2表达与肿瘤大小、Lauren分型、浸润深度和TNM分期有关(P<0.05),临床分期越晚,肿瘤越大,则Her-2表达率越高;但Her-2高表达胃癌患者的5年生存率并未明显缩短(P>0.05)。分析入组病例,本研究发现大部分胃癌病例分期在Ⅱ期以上及淋巴结转移的患者均接受了术后辅助化疗, 可能影响统计分析。2009年NCCN建议Ⅲ期以上患者和Ⅱ期高危患者需接受术后辅助化疗,这些患者均能从术后辅助化疗中获益。2009年ASC0会议上发表的TOGA试验摘要显示在晚期胃癌中单纯化疗组的OS也达11.1个月,化疗能延长患者的生存期的结论已经被证实,由此推测术后辅助化疗可能影响到Her-2表达与胃癌生存率。本研究中胃癌患者Her-2免疫组化检测结果显示Her-2阳性患者(+++)28例(14.14%),这些患者可根据具体情况进入赫赛汀辅助治疗的临床研究。而Her-2(++)患者37例(18.69%),可采用FISH技术检测Her-2基因情况,以明确是否为Her-2阳性胃癌。对于晚期不能手术的胃癌患者,应采取因人而异的个体化治疗策略。TOGA研究结果表明经Her-2标准化的Hofmann检测流程进行分层[8],对免疫组织化学标记Her-2蛋白表达+++,或Her-2表达++,经FISH检测Her-2基因有扩增的胃癌患者可用化疗加赫赛汀的治疗方案。癌症是多基因、多步骤的发生发展过程。胃癌的生物学是由多种不同机制共同作用的结果,Her-2信号通路的异常仅仅是其中一个方面。本研究结果表明Her-2与肿瘤浸润深度和临床分期密切相关,但与生存期无明显关系。我们将进一步进行Her-2基因检测,为胃癌的靶向治疗提供数据。
[1] Muhammad WS, Nianwen S, Susan Z.Capecitabine treatment patterns in patients with gastroesophageal cancer in the United States[J].World J Gastroenterol, 2009, 15(35): 4415-4422.
[2] Kelley JR, Duggan JM.Gastric cancer epidemiology and risk factors[J].J Clin Epidemiol, 2003, 56: 1-9.
[3] 许晓勇, 胡乃中, 石海, 等.222例早期胃癌的临床病理及预后分析[J].中华消化内镜杂志, 2009, 26(4): 203-205.
[4] Van Cutsem E, Kang Y, Chung H, et al.Efficacy results from the ToGA trial: A phrase Ⅲ study of trastuzumab added to standard chemotherapy(CT) in first-line human epidermal growth factor receptor 2(Her-2)-positive advanced gastric cancer(GC)[J].J Clin Oncol, 2009, 27(18S): abstr LBA4509.
[5] Akiyama T, Sudo C, Ogawara H, et al.The product of the human c-erbB-2 gene: A 185-kilo-Dalton glycoprotein with tyrosine kinase activity[J].Science, 1986, 232: 1644-1646.
[6] Coussens L, Yang-Feng TL, Liao YC, et al.Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene[J].Science, 1985,230: 1132-1139.
[7] 冯莹莹, 徐建明.Herceptin治疗Her-2/neu过表达胃癌的研究进展[J].中国肿瘤临床与康复, 2007, 14(2): 177-180.
[8] Hoffmann M, Stoss O, Shi D, et al.Assessment of a Her-2 scoring system for gastric cancer: results from a validation study[J].Histopathology 2008, 52: 797-805.
[9] 武忠弼.病理学[M].3版.北京: 人民卫生出版社, 1994:286.
[10] 格林尼 FL, 佩董 DL, 弗莱明 ID, 等.AJCC癌症分期手册[M].毛伟征, 苏冬明, 李雪萍, 等译.6版.沈阳: 辽宁科学技术出版社, 2005: 99-103.
[11] Sakai K, Mori S, Kawamoto T, et al.Expression of epidermal growth factor receptors on normal human gastric epithelia and gastric carcinomas[J].J Natl Cancer Inst, 1986, 77: 1047-1052.
[12] Yonemura Y, Ninomiya I, Yamaguchi A, et al.Evaluation of immunoreactivity for erbB-2 protein as a marker of poor short-term prognosis in gastric cancer[J].Cancer Res,1991, 51: 1034-1038.
[13] Ishida T, Tsujisaki M, Hanzawa Y, et al.Significance of erbB-2 gene product as a target molecule for cancer therapy[J].Scand J Immunol, 1994, 39: 459-466.
[14] Tokunaga A, Onda M, Okuda T, et al.Clinical significance of epidermal growth factor(EGF), EGF receptor and c-erbB-2 in human gastric cancer[J].Cancer, 1995, 75: 1418-1425.
[15] Tanner M, Hollmen M, Junttila TT, et al.Amplification of Her-2 in gastric carcinoma: association with topoisomeraseⅡa gene amplification, intestinal type, poor prognosis and sensitivity to trastuzumab[J].Ann Oncol, 2005, 16: 273-278.
[16] Yano T, Ochiai A, Doi T, et al.Expression of Her-2 in gastric cancer: comparison between protein expression and gene amplification using a new commercial kit[J].J Clin Oncol,2004, 22(14S): Abstr 4053.
[17] Gravalos C, Ma´ rquez A, Garcı´a-Carbonero R, et al.Correlation between Her-2/neu overexpression/amplification and clinicopathological parameters in advanced gastric cancer patients: a prospective study[C].Gastrointestinal Cancers Symposium, 2007, 130: Abstr 89.
[18] Gravalos C, Jimeno A.Her-2 in gastric cancer: a new prognostic factor and a novel therapeutic target[J].Ann Oncol, 2008, 19: 1523-1529.
[19] Kang Y, Bang Y, Lordick F, et al.Incidence of gastric and gastro-esophageal cancer in the ToGA trial: correlation with Her-2 positivity[C].Gastrointestinal Cancer Symp, 2008,75: Abstr 11.
[20] Berx G, Becker KF, Hofler H, et al.Mutations of the human E-cadherin(CDH1) gene[J].Hum Mutat, 1998, 12: 226-237.
[21] Sasano H, Date F, Imatani A, et al.Double immunostaining for c-erbB-2 and p53 in human stomach cancer cells[J].Hum Pathol, 1993, 24: 584-589.
[22] Park DI, Yun JW, Park JH, et al.Her-2/neu amplification is an independent prognostic factor in gastric cancer[J].Dig Dis Sci, 2006, 51: 1371-1379.
[23] Vizoso FJ, Corte MD, Alvarez A, et al.Membranous levels of cerbB-2 oncoprotein in gastric cancer: their relationship with clinicopathological parameters and their prognostic significance[J].J Biol Markers, 2003, 19(4): 268-274.
[24] Garcia I, Vizoso F, Martin A, et al.Clinical significance of the epidermal growth factor receptor and Her-2 receptor in respectable gastric cancer[J].Ann Surg Oncol, 10(3): 234-241.
[25] 张杰, 舒维清, 朱为, 等.胃癌中Her-2/neu过表达与基因扩增及其意义[J].中华病理学杂志, 2003, 132(1): 52-53.
[26] Pinto-de-sousa JD, Almeida R.CerbB-2 expression in associated with tumor location and venous invasion and influences survival of patients with gastric carcinoma[J].Int J Surg Pothol, 2002, 10(4): 247-256.

