骨髓间充质干细胞移植对缺血性脑卒中大鼠的细胞外信号调节蛋白激酶的影响
郭继东, 王 月, 信 宏
目前关于临床上治疗缺血性脑卒中的方法有早期溶栓、保护脑细胞及抗血小板聚集等方法,有效的治疗措施只有极早期的溶栓治疗,但是很少有患者受益。近年发现骨髓间充质干细胞(BMCs)可以分化为神经细胞[1],使其成为治疗缺血性脑卒中研究的热点。关于其机制的研究较多的集中于各类生长因子及营养因子,而对于信号转导系统方面未见报道。故本研究欲观察 BMCs移植对缺血性脑卒中大鼠的细胞外信号调节蛋白激酶(ERK)的影响。
1 资料与方法
1.1 动物与试剂 健康幼年Wistar大鼠 5只,体重(120±10)g,用于提取 BMCs;健康成年Wistar大鼠 30只,体重(300±10)g,用于制作缺血性脑卒中模型。所有大鼠均雌雄不限,且由吉林大学实验动物中心提供。DMEM培养基、胎牛血清购自 Sigma公司,大鼠脑立体定位仪购自北京智鼠多宝公司;ERK免疫组化试剂盒购自武汉博士德公司。
1.2 方法
1.2.1 大鼠 MSCs的分离、培养及收集 联合采用密度梯度离心及贴壁法分离培养大鼠 MSCs,原代培养达 80%以上融合后按 1∶3传代培养,选取生长良好的 1、2、3代细胞,用 0.25%胰蛋白酶室温消化 5m in,用含胎牛血清的培养液终止消化,PBS清洗,1000r/min离心,每次 5min,共离心 3次,然后收集培养的大鼠 MSCs用于移植。
1.2.2 大鼠分组及缺血性脑卒中模型制作 30只Wistar大鼠随机分为假手术组、模型组和 BMCs移植组,每组10只。采用Longa[2]方法制作大鼠大脑中动脉缺血再灌注模型。麻醉清醒后 2h采用Longa[2]的评分方法进行评分。0分和 4分的动物弃之不用。假手术组只行开颅术,不凝闭大脑中动脉。
1.2.3 MSCs的移植 于造模术后 1w行细胞移植实验。在脑梗死侧(右侧)壳核区于立体定向仪定位下进行直接注射移植。移植组注射MSCs悬液 5μl,其他两组大鼠于相同部位注射同等量不含细胞的0.1mol/L PBS。
1.3 观察指标
1.3.1 神经功能损伤程度评分(NSS) 分别于造模前、移植前及移植后第 4周对各组动物进行NSS,评分标准参考Chen等[3]方法,主要观察运动、感觉功能、平衡能力及生理反射能力;总分为 18分,正常为 0分,分值越高其神经损害程度越严重。
1.3.2 免疫组化染色 移植后第4周,每组取5只处死大鼠取脑组织。脑组织用生理盐水和多聚甲醛先后经心灌注固定,石蜡包埋,冠状切片。严格按照免疫组化试剂盒说明书操作进行脑组织免疫组化染色检测ERK蛋白表达。显微镜下任选 5个 400倍视野计数阳性细胞。
1.3.3 脑梗死体积检测 移植后第 4周,各组剩余大鼠处死,取脑,于 -20℃冷冻 20min,冠状切片,由前到后,共 5张切片,置 2%TTC液中,37℃避光孵育 30m in,梗死区不着色,正常脑组织染成红色,随即采用 40g/L甲醛固定,根据苍白区观察梗死灶范围,依据公式计算梗死面积[4]。
1.4 统计学方法 实验数据以均数 ±标准差表示,应用 SPSS 13.0进行方差分析和 t检验。
2 结 果
2.1 实验动物数量统计 假手术组无动物缺失,模型组因麻醉过量死亡 2只,BMCs移植组因术后感染死亡 1只,其余大鼠均进入结果统计。
2.2 各组动物NSS 造模前各组动物 NSS比较无显著差异(P>0.05);移植前,模型组及移植组 NSS评分均较假手术组增高明显(P<0.05),但两组间无显著差异(P>0.05);移植后,模型组最高,其次为移植组,最低者为假手术组,3组间均有显著差异(P<0.05)(见表1)。
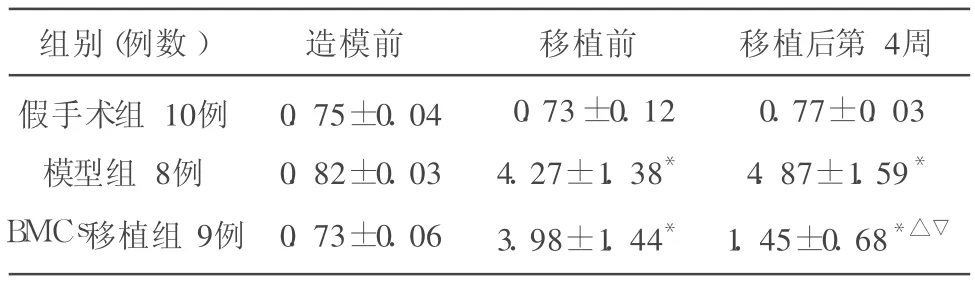
表1 各组 NSS比较
2.3 免疫组化 假手术组ERK阳性细胞数为 13.42±6.91,明显低于模型组(120.33±30.52)和 BMCs移植组(35.85±12.64)(P<0.05),BMCs移植组明显高于模型组(P<0.05)。
2.4 脑梗死体积 假手术组未见梗死灶,模型组梗死体积为(53.27±20.64)mm3;BMCs移植组梗死体积为(30.31±12.95)mm3,二者差异显著(P<0.05)。
3 讨 论
成年哺乳动物的神经细胞缺乏再生能力,其损伤后很难恢复,故缺血性脑卒中后如果不能在第一时间改善其血供,将导致缺血区神经细胞的死亡。干细胞移植是近年医学上乃至生命科学领域的研究热点。但是胚胎干细胞移植存在伦理、法律及取材等方面的不便,故移植治疗的应用方面受到很大限制。BMCs是多能细胞,具有多项分化的潜能,在一定诱导条件下可分化为多种造血外组织,特别是中胚层和神经外胚层发育来源的组织细胞,如成骨细胞、脂肪细胞以及神经细胞和神经胶质细胞等[5,6]。尤其是神经元的分化方向,使其具有了强大的吸引力,很多研究者都尝试将其用于治疗各类神经疾病,尤其用于治疗缺血性脑卒中的研究近年更为广泛。研究人员考虑到 BMCs具有高度可塑性,且取材方便、免疫排斥反应弱,少受伦理学制约,移植方便等特点,将其应用于脑梗死的治疗。
本研究成功地将 BMCs移植入梗死灶,结果表明,模型大鼠的神经功能缺损得到明显改善,其梗死的大脑面积也明显减小,考虑与BMCs分化为神经细胞和神经胶质细胞有关,同时我们未观察到 BMCs移植对脑组织结构的损伤。BMCs移植的疗效显著。
脑缺血时组织低氧缺氧,细胞可以表现为坏死或凋亡,同时细胞也会启动修复机制对其缺氧损伤进行修复。丝裂原活化蛋白激酶(MAPK)级联传导途径是与细胞增殖,分化及凋亡控制密切相关的细胞信号传导途径,ERK作为 MAPK的家族成员之一,可以介导细胞增殖、分化并促进细胞的存活。正常生理条件下 ERKs就存在于动物脑内,可被神经营养因子、神经递质和生长因子等多种信号激活,在中枢神经系统中可通过基因表达、蛋白合成等影响神经细胞增殖分化、突触可塑性、轴突生长等,并且参与多种神经系统疾病的病理生理过程[7]。但是关于 ERK在缺血性脑卒中的发病过程中到底起到保护还是损伤作用各家说法不一[8~10]。
本研究结果显示,经过造模以后,大鼠脑组织中 ERK明显增多,说明ERK通过介导炎性反应和氧化应激反应促进缺血缺氧时的神经细胞的死亡与凋亡[11]。但是移植入BMCs后,检测结果显示,大鼠脑内 ERK阳性细胞数量明显减少,表明BMCs的移植抑制了 ERK通路活性,下调 ERK蛋白的表达,保护缺血缺氧的神经细胞免受炎性反应和氧化应激反应的损伤,保护神经细胞的功能,从而达到治疗缺血性脑卒中的目的。
[1]Sanchez-Ramos JR.Expression of neuralmarkers in human umbilical cord blood[J].JNeuroscience Res,2002,69:880-893.
[2]Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebralartery cclusionwithout craniectomy in rats[J].Stroke,1989,2(1):84-91.
[3]Chen JL,Yi Li,Wang L,etal.Therapeutic benefit of intravenous adm inistration of bone marrow stromal cells after cerebral ischem ia in rats[J].Stroke,2001,189(1~ 2):49-57.
[4]Kashiwagi F,Katawama Y,Suzuki S,etal.Effect of glycerol administration on experimental cerebralischemia:Part 1.Studies on lipid peroxides,prostaglandins,brain edema,and brain metabolites[J].No To Shinkei,1988,40(2):179-85.
[5]Tao H,Rao R,Ma DD,etal.Cytokine induced stable neuronal differentiation of human bonemarrow mesenchymal stem cells in a serum/feeder cell free condition[J].Development,Growth and Differentiation,2005,47(6):423-433.
[6]Long X,O lszewski M,Huang W,etal.Neural cell differentiation in vitrofrom adult human bone marrow mesenchymal stem cells[J].Stem Cellsand Development,2005,14(1):65-69.
[7]Chang L,Karin M.Mammalian MAP kinase signalling cascades[J].Nature,2001,410(6824):37-40.
[8]Wang Z,Chen X,Zhou L,etal.Effectsofextracellular signal-regulated kinase(ERK)on focal cerebral ischemia[J].Chin Med J(Engl),2003,116(10):1497-1503.
[9]Henriksson M,Stenman E,Vikman P,etal.MEK 1/2 inhibition attenuates vascular ETA and ETB receptor alterations after cerebral ischaem ia[J].Exp Brain Res,2007,178(4):470-476.
[10]Yang JP,Lia XF,Liu HJ,etal.Extracellular signal-regulated kinase involved in NGF/VEGF induced neuroprotective effeet[J].Neurosci Lett,2008,434(2):212-217.
[11]严洪新,徐 恩.细胞外信号调节激酶与缺血性脑卒中[J].现代医学,2010,38(4):427-430.

