产细菌素干酪乳杆菌发酵培养基的响应面法优化
李俊霞,罗 宇,田鹏飞,李 瑾,张慧茹
(河南工业大学生物工程学院,河南郑州 450001)
产细菌素干酪乳杆菌发酵培养基的响应面法优化
李俊霞,罗 宇,田鹏飞,李 瑾,张慧茹*
(河南工业大学生物工程学院,河南郑州 450001)
采用响应面法对培养基的 10个组分和起始 pH值共 11个因素进行优化.通过 Plackett -Bur man试验(PB试验)从 11个因素中筛选出主要影响因子,再利用中心组合设计确定主要影响因子的最佳浓度,并对主要影响因子间的交互作用进行研究与探讨.经过 PB试验确定蛋白胨、葡萄糖、乙酸钠、吐温 80和柠檬酸三铵为主要影响因子;中心组合试验确定主要影响因子的最佳水平,分别为蛋白胨 19.67 g/L、葡萄糖 35.01 g/L、乙酸钠 9.24 g/L、吐温 80 0.41 mL/L、柠檬酸三铵 1.37 g/L.
Plackett-Bur man设计;中心组合设计;响应面法;优化
0 前言
乳酸菌发酵代谢可以产生有机酸、过氧化氢和乳酸菌素等多种抗菌物质.其中乳酸菌素是乳酸菌在代谢过程中通过核糖体合成机制产生的一类具有抗菌活性的肽或前体肽[1],可以抑制食品中腐败菌和病原菌的生长.除了乳酸菌本身的遗传特性决定细菌素的产量以外,培养基成分对细菌素的产量也有着很大的影响.如陈秀珠等[2]研究表明,Mn2+对 nisin的产生有促进作用,Mg2+可增加片球菌素 pediocin AcH的产量;庄绪亮等[3]研究结果表明,Tween 80对乳酸链球菌 S M526产nisin有一定的刺激作用.
作者筛选出了一株产细菌素的干酪乳杆菌,为了提高细菌素的活性,对干酪乳杆菌发酵培养基的组分和起始 pH进行了优化.国际上近年较为流行的生物过程优化技术包括非统计优化技术(全因子设计法)和统计优化技术 (如 Plackett-Burman设计法、部分因子设计法和中心组合设计法等响应面法)两大类.全因子设计法、PB设计法和部分因子设计法都是两水平实验设计方法,适用于从大量因子中筛选出重要影响因子.徐正军等[4]采用全因子设计法对核酸酶 P1的发酵培养基进行了优化,李孱等[5]采用了 26-2部分因子设计法对乳酸乳球菌乳酸亚种ATCC 11454细菌素发酵培养基进行了优化,而 Pujari等[6]采用了PB设计法对 Erem othecium ashbyii发酵产核黄素的培养基组分进行优化.3种方法相比,PB设计法能用最少的实验次数从大量的因子中筛选出重要的影响因子,省时省力.根据本实验室前期的几种发酵培养基对照结果,选取MRS液体培养基作为发酵培养基,组分较多,因此采用 PB设计法将更有优势.
中心组合设计 (central composite design, CCD)是一种国际上较为常用的响应面法,是一种 5水平的实验设计法.采用该法能够在有限的实验次数下,对影响生物过程的重要因子及其交互作用进行评价,而且还能对各因子进行优化,以获得影响过程的最佳条件.李孱等[5]在部分因子设计和最陡爬坡法的基础上,利用 22中心组合设计法对影响细菌素发酵的培养基组分进行了进一步优化,细菌素的发酵产率提高了 2倍.
在对产细菌素发酵培养基的优化方面,国内很少有 PB设计法和 CCD设计相结合的报道,因此作者采用 PB设计和CCD设计相结合的方法优化干酪乳杆菌产细菌素的发酵培养基,以期通过最少的试验次数提高细菌素的活性,为以后细菌素的研究提供思路.
1 材料和方法
1.1 菌株
供试菌:从青贮饲料中筛选出的一株产细菌素的干酪乳杆菌.
指示菌:大肠杆菌 E.coil(CVCC1490)购于中国兽医微生物菌种管理保藏中心.
1.2 培养基
MRS液体培养基:蛋白胨 10 g,肉浸膏 10 g,酵母膏 5 g,葡萄糖 20 g,乙酸钠 5 g,吐温 80 1 mL,柠檬酸三铵 2 g,磷酸氢二钾 2 g,硫酸镁
0.2 g,硫酸锰 0.25 g,蒸馏水 1 L,pH 6.2~6.4.
营养琼脂培养基:培养指示菌 E.coil.
1.3 细菌素含量的测定
1.3.1 细菌素发酵液的制备
将活化后的乳酸菌接入 MRS液体培养基, 37℃,160 r/min摇床过夜培养,按 2%比例将培养后的种子液再转接入新鲜MRS液体培养基, 37℃静置培养 48 h,收集发酵液,10 000g4℃将发酵液离心 15 min,去沉淀,收集上清液备用.
1.3.2 发酵液中细菌素活性的测定
抑菌实验采用打孔法,细菌素的活性测定采用标准曲线法[7].
1.4 试验设计
1.4.1 Plackett-Burman试验
用 Plackett-Bur man设计确定主要影响因子.对Chadha等[8]的试验方法进行改进,确定试验变量数为 19,其中包括 10个培养基组分、1个起始pH和 8个虚拟因素,19个考察因素及其代码、编码水平见表 1.利用 SAS软件(SAS 9.0)进行试验设计和数据分析.每个试验重复 3次,响应值 Y为细菌素的活性,单位为 IU/mL.
1.4.2 中心组合试验设计
采用 SAS(SAS 9.0)软件,中心组合试验水平及编码见表 2,对 PB试验筛选出的主要影响因子进一步优化,研究这些因子的最佳水平和交互作用,得到连续变量曲面模型[9].其响应值 Y为细菌素的活性,单位为 IU/mL.
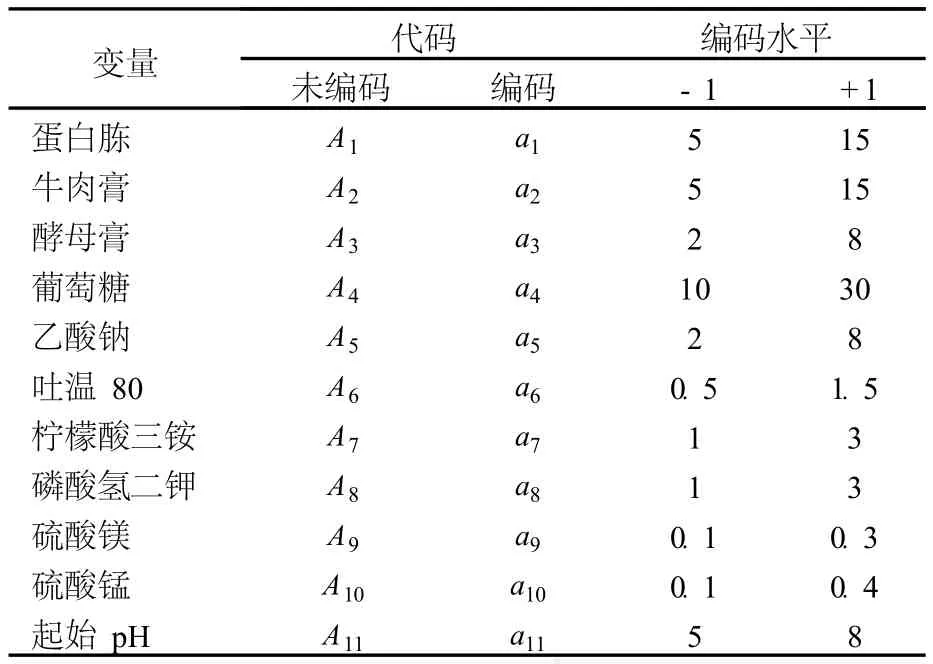
表 1 Plackett-Burman试验因素编码及水平g/L
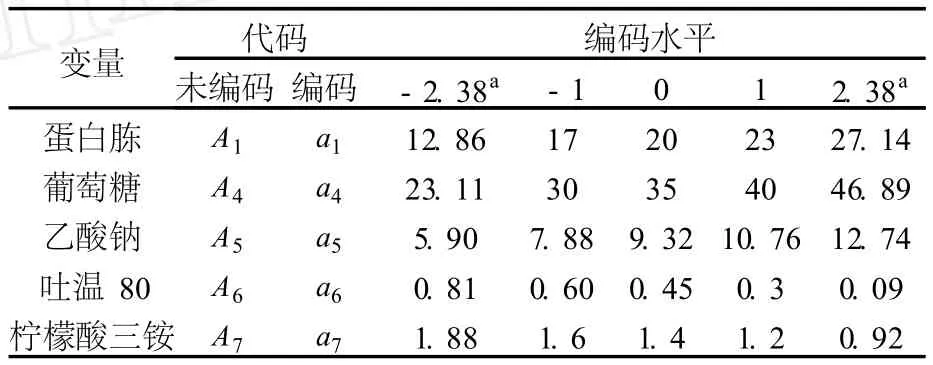
表 2 中心组合试验水平及编码 g/L
2 结果与分析
2.1 发酵培养基主要影响因子的确定
采用 SAS统计软件 9.0对 PB试验结果进行显著性检验,根据分析结果中的 P值大小来判断各因子对发酵过程的影响效果,将 P<0.05的因子确定为主要影响因子.
PB试验结果见表 3.
运用 SAS软件对试验结果进行方差分析,可以得出各因素对响应值的影响效果,以此筛选出主要影响因子,结果见表 4.
根据表 4的 P值大小可以看出,影响细菌素抗菌活性的主要因子为 a1(P=0.027 1)、a4(P<0.000 1)、a5(P=0.005 2)、a6(P=0.008 0)和 a7(P=0.036 0),这几个因子分别为蛋白胨、葡萄糖、乙酸钠吐温 80和柠檬酸三铵.其中,葡萄糖、乙酸钠、和吐温 80差异极显著 (P<0.01).从上述 5种因素的 t值可以看出,蛋白胨、葡萄糖和乙酸钠对响应值的影响为正效应,而吐温 80和柠檬酸三铵为负效应.
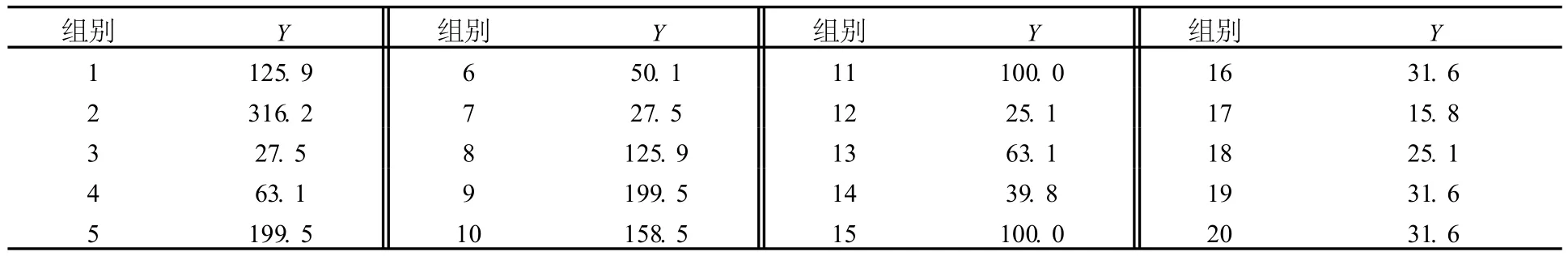
表3 Plackett-Bur man试验结果 IU/mL
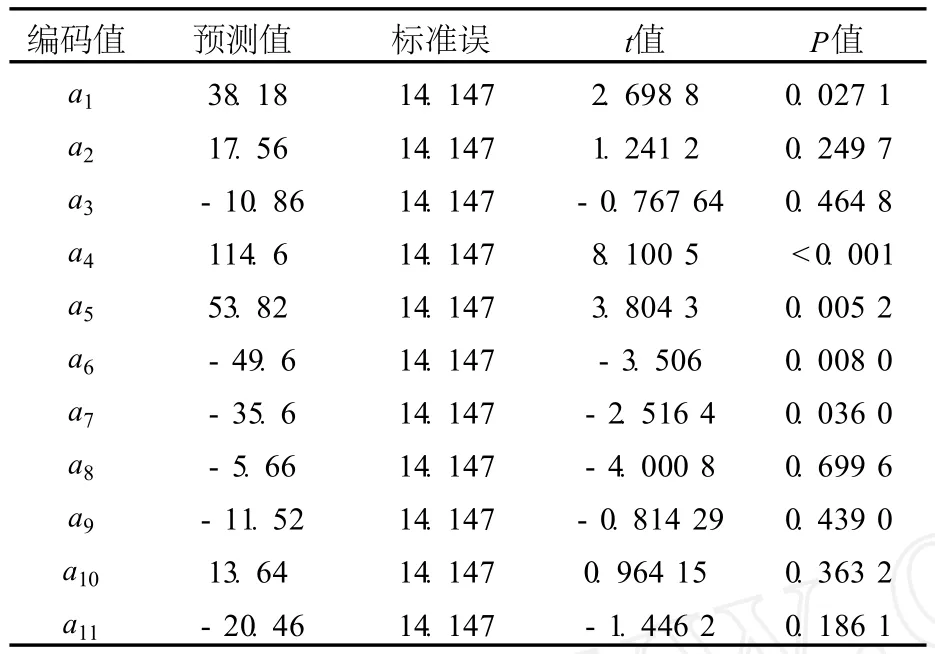
表4 各因素对响应值的显著性检验结果
2.2 响应面法优化培养基的主要影响因素
2.2.1 模型建立及显著性检验
中心组合试验结果见表 5.利用 SAS分析软件对表 5中实验数据进行二次多项回归拟合,获得响应值 Y对自变量蛋白胨 a1、葡萄糖 a4、乙酸钠 a5、吐温 80a6和柠檬酸三铵 a7的多元回归方程:Y=

表5 中心组合试验结果 IU/mL
由上述回归方程进行方差分析表明,该模型 极显著 (P<0.000 1),失拟项的 P=0.182 15,没有显著性意义,模型中不需要引入更高次数的项,模型适当,模型的拟合度 R2为 0.923,其值接近真实数据点,结果见表 6.
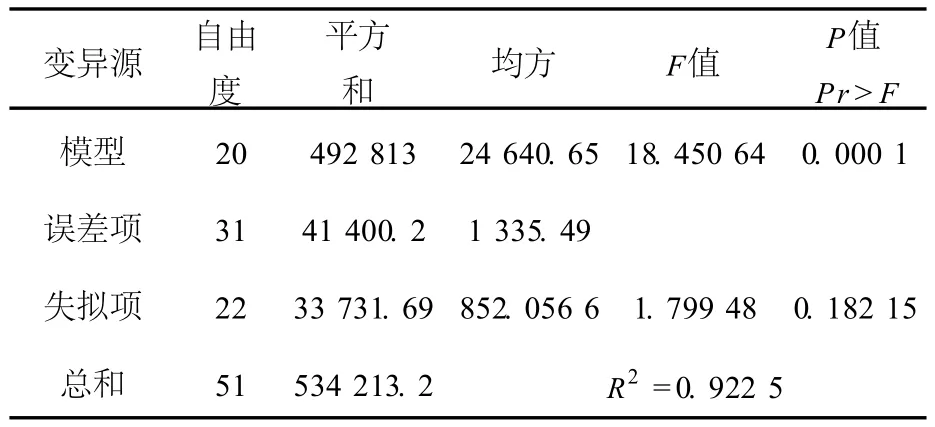
表6 二次多项回归模型方差分析
对上述回归方程求导,得到模型的极值点(a1=-0.113,a4=0.002,a5=-0.053,a6=0.297, a7=-0.144),即蛋白胨为 19.67 g/L,葡萄糖为
35.01 g/L,乙酸钠为 9.24 g/L,吐温 80为 0.41 mL/L和柠檬酸三铵为 1.37 g/L时,模型得到预测的极值为 332.2 IU/mL.在极值点处做了 10个重复实验,平均值为 330.3 IU/mL,证实模型和实测值之间具有良好的拟合性.
2.2.2 因子两两交互作用影响细菌素抑菌圈直径的响应面分析
回归方程的方差分析结果也显示出了两两因子交互作用的显著与否.在众多交互相中,除了a1a4、a1a5、a1a7、a4a6和 a4a7交互作用不显著,其余几项均为交互作用显著.
葡萄糖在培养基中主要起碳源和能源物质的作用,乙酸钠除了抑制杂菌外,还为乳酸菌提供必需的钠元素,以维持细胞的渗透压,另外Na+为乳酸菌吸收葡萄糖提供帮助[11].因此,在分析两因子交互作用时,考虑到交互作用显著项较多,仅分析葡萄糖和乙酸钠的交互作用.图 1为两者交互作用的响应面图和等高线图.
等高线图显示在蛋白胨、吐温 80和柠檬酸三铵分别为 19.67 g/L,0.41 mL/L和 1.37 g/L时,葡萄糖和乙酸钠交互作用显著.并且在乙酸钠处于最佳值水平附近时,随着葡萄糖浓度的增加,细菌素的抑菌圈直径不断增长,而且曲线较陡,说明葡萄糖浓度的变化对细菌素的抗菌作用影响较大;但是增至中心点附近时,再增加葡萄糖的浓度,抑菌圈直径变小,说明高浓度的葡萄糖对细菌素的活性有抑制作用.同样,高浓度的乙酸钠也抑制了细菌素的抗菌活性.由此可见,为了得到细菌素最大抑菌活性,发酵培养基中葡萄糖和乙酸钠水平需要合适的比例.

图 1 葡萄糖和乙酸钠的交互作用响应面图及等高线图
3 结论
作者利用统计优化技术,简捷、方便地对筛选得到的干酪乳杆菌产细菌素的发酵培养基进行了优化,得到最佳培养基浓度为蛋白胨 19.67 g/L,葡萄糖 35.01 g/L,乙酸钠 9.24 g/L,吐温 80 0.41 mL/L,柠檬酸三铵 1.37 g/L,其余组分浓度保持原始浓度.由此可见,利用统计优化技术 Plackett-Bur man和 RS M相结合的方法可以很好地对产细菌素乳酸菌的发酵培养基进行优化,以确定最佳培养基配方.
[1] Anastasiadou S,PapagianniM,Filiousis G, et al.Pediocin SA-1,an antimicrobial peptide from Pediococcusacidilactici NRRL B5627:production conditions,purification and characterization[J].Bioresource Tech-nology,2008,99(13):5384-5390.
[2] 陈秀珠,何松,龙力红.乳链菌肽高产菌株ALZ的发酵条件的研究[J].微生物学通报,1995,22(4):215-217.
[3] 庄绪亮,张洪勋,马桂荣.不同发酵条件下 Tween80对乳酸链球菌 S M526产 nisin的影响 [J].化工冶金,2000,21(2): 145-148.
[4] 徐正军,肖林平,吕浩,等.实验设计法优化核酸酶 P1的发酵培养基[J].过程工程学报,2003,3(5):433-436.
[5] 李孱,白景华,蔡昭玲,等.细菌素发酵培养基的优化及动力学初步分析 [J].生物工程学报,2001,17(2):187-192.
[6] PujariV,W ilson KB.Statisticaloptimization of medium components for enhanced riboflavin production by a UV-mutant ofErem othecium ashbyii[J].ProcessBiochem,2000,36: 31-37.
[7] 吕燕妮,李平兰,周伟.戊糖乳杆菌31-1菌株产细菌素发酵条件优化[J].微生物学通报,2005,32(3):13-19.
[8] Chadha B S,Gulati H,Minhas M,et al. Phytase production by thermophilic fungus Rhizom ucor pusillus[J].World JournalofMicrobiology and Biotechnology,2004,20:105-109.
[9] 王允祥,吕凤霞,陆兆新.杯伞发酵培养基的响应曲面法优化研究[J].南京农业大学学报,2004,27(3):89-94.
[10]Khuri A I,Cornell J A.Response Surface-Design and Analyses[M].New York:Marcel Dekker,ASQC Quality Press,1987.
[11]杨生玉,王刚,沈永红.微生物生理学[M].北京:化学工业出版社,2007: 51-52.
OPTIM IZATION OF FERMENTATION MED IUM OF BACTER IOCIN-PRODUCING LACTOBACILLUS CASEIBY RESPONSE SURFACEMETHODOLOGY
L IJun-xia,LUO Yu,T IAN Peng-fei,L IJin,ZHANG Hui-ru
(School of B ioengineering,Henan University of Technology,Zhengzhou450001,China)
The response surface methodologywas used to opt imize 11 factors(including 10 components and the initial pH value)of a fer mentation medium of bacteriocin-producinglactobacillus casei. In the first step, Plackett-Burman experiment(PB experiment)was used to screen out the main affecting factors from the 11 factors;then,center composite design was used to determine the optimal concentrations of the main affecting factors;finally,the article investigated the interaction among the main affecting factors.According to the PB experiment, the main affecting factors included peptone, glucose, CH3COONa, Tween-80 and (NH4)3C6H5O7;and the central composite design deter mined the optimal concentrations of the main affecting factors as follows:peptone 19.76 g/L,glucose 35.01 g/L,CH3COONa 9.24 g/L,Tween-80 0.41 mL/L and(NH4)3C6H5O71.37 g/L.
Plackett-Bur man design;central composite design;response surface methodology;optimization
TS201.2
B
1673-2383(2010)03-0045-05
2010-04-09
李俊霞(1984-),女,河南开封人,硕士研究生,研究方向为乳酸菌素的研究.
*通信作者

