EBV潜伏膜蛋白2的结构与功能分析
郑美霞,刘建晓,巩文词,朱珊丽,李文姝,张丽芳
(温州医学院 微生物学与免疫学教研室,浙江 温州 325000)
EBV潜伏膜蛋白2的结构与功能分析
郑美霞,刘建晓,巩文词,朱珊丽,李文姝,张丽芳
(温州医学院 微生物学与免疫学教研室,浙江 温州 325000)
目的:预测和分析EBV潜伏膜蛋白2(LMP2)的结构和功能。方法:采用互联网数据库和生物软件,从SwissProt蛋白质数据库中检索LMP2的氨基酸序列,通过生物软件分析预测其理化性质、二级结构及空间结构。结果:分析显示LMP2由497个氨基酸组成,分子量53011.4 Da,等电点4.85,为疏水性蛋白;具有12个疏水跨膜区,其N端含有免疫受体酪氨酸活化基序(ITAM)和脯氨酸富集基序(PY基序),前者位于氨基酸序列 74~77和85~88处,后者位于56~60和 97~101处;含有15个α螺旋结构和7个β片层结构,通过无规则卷曲连接α螺旋和β片层。结论:通过对LMP2生物信息学的分析,获得了此蛋白的理化特性及部分参与调节跨膜信号传导功能区的信息,为进一步研究EBV的感染与致病机制、研制EBV亚单位疫苗等奠定基础。
疱疹病毒4型,人;潜伏膜蛋白;蛋白质结构,二级;生物信息学
EB病毒(Epstein-Barr virus,EBV)是人类γ疱疹病毒,呈全球分布,感染率高,是传染性单核细胞增多症的病原体,并与鼻咽癌、口腔腺体肿瘤、淋巴瘤、何杰金氏病、胃癌以及器官移植后的B细胞淋巴瘤、艾滋病相关的淋巴瘤等密切相关[1]。研究证实,在所有病理类型的鼻咽癌组织中均发现了EBV的DNA,在异型增生组织和原位癌中也存在。EBV在潜伏感染时,表达潜伏膜抗原(the latency membrane protein,LMP)LMP1和LMP2。研究表明LMP1为肿瘤源性蛋白,而LMP2则不具细胞转化作用,因此,LMP2是研究抗EBV感染疫苗的理想靶抗原。本研究利用计算机辅助生物学软件和网络相关数据库对LMP2进行结构预测和功能分析,进一步了解EBV潜伏感染的机制,并对EBV感染相关肿瘤的治疗和疫苗的设计研究提供理论基础。
1 材料和方法
1.1 材料 利用在线生物信息学软件:SwissProt蛋白质数据库,Expasy服务器及LOMETS在线预测软件[2-3](http://www.uniprot.org/,http://expasy. org/,http://zhang.bioinformatics.ku.edu/ LOMETS/)对EBV LMP2进行结构预测和功能分析。1.2方法 EBV LMP2的氨基酸序列检索于瑞士生物信息研究所提供的SwissProt蛋白质数据库,使用Expasy(http://expasy.org/)服务器中的ProtParam(http://expasy.org/tools/protparam. html)预测LMP2的理化性质,GOR(http://expasy. org/tools/)和ProdectProtein(http://www. predictprotein.org/)分析LMP2的二级结构,TopPred(http://expasy.org/tools/)预测其拓扑结构模式,其空间结构是通过LOMETS(http:// zhang.bioinformatics.ku.edu/LOMETS/)在线软件进行预测。
2 结果
2.1 EBV LMP2理化性质ProtParam结果显示LMP2含有497个氨基酸,分子量为53011.4Da,等电点4.85,分子式为C2434H3835N591O671S28;LMP2不稳定系数II值(instability index,II)为47.27,表明此蛋白性质不稳定,其疏水性GRAVY(grand average of hydropathicity)值为0.719,表明其亲水性较差,为疏水性蛋白。
2.2 EBV LMP2的二级结构应用ProdectProtein和Expasy服务器上的GOR预测LMP2的二级结构。GOR预测显示其二级结构由α螺旋Alpha helix (Hh):37.83%、β-片层Extended strand(Ee):18.71%、无规则卷曲Random coil(Cc):43.46%构成。其二维结构显示LMP2蛋白具有12个螺旋跨膜区,其N端和C端均在胞浆内,见图1。EBV LMP2功能区免疫受体酪氨酸活化基序ITAM(YXXL)和PY基序均在N端,前者分别位于氨基酸序列74~77和85~88处,后者分别位于56~60和97~101处,均位于胞浆内,其具体氨基酸序列分别为YQPL、YLGL和PPPPY。
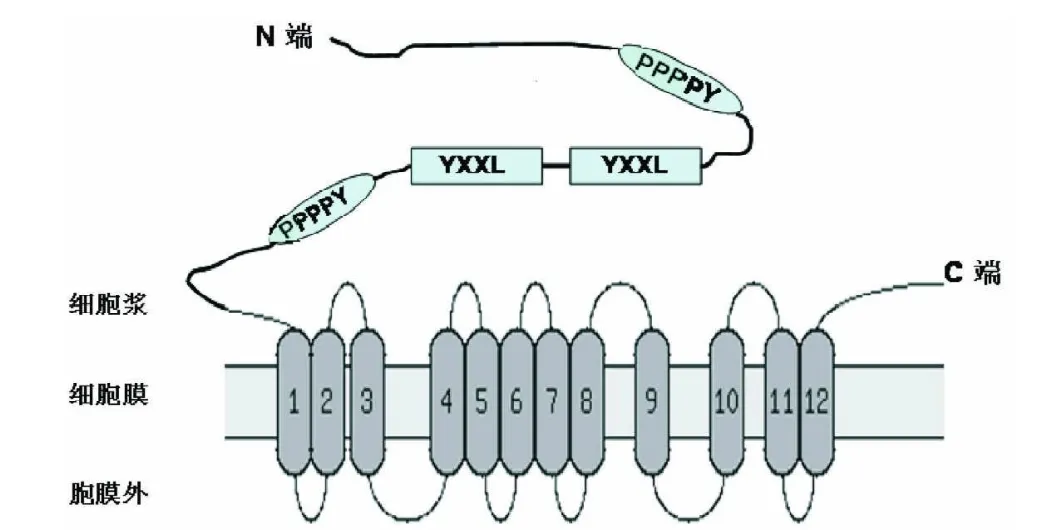
图1 EBV LMP2潜伏膜蛋白拓扑结构图
2.3 EBV LMP2空间结构利用在线软件LOMETS对LMP2的空间结构进行预测,通过分值、可信度及氨基酸数等参数的综合分析,筛选出各参数值均高的模板,将其导入Rasmol和Vector NTI软件中,分析推测其三级结构,结果显示LMP2结构主要包含15个α螺旋结构、7个β片层结构,其中有12个α螺旋构成跨膜区,通过无规则卷曲连接α螺旋和β片层,与二级结构预测的结果相符;其ITAM和PY基序位于N端的无规则卷曲内,见图2。
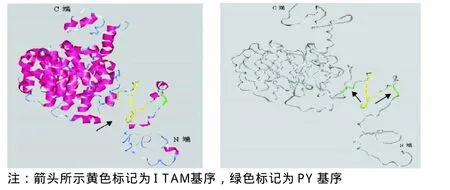
图2 EBV LMP2空间结构
3 讨论
EBV主要通过其包膜糖蛋白gp350/220结合B细胞上的受体即CD21分子感染B淋巴细胞或上皮细胞。通常在初次感染后,潜伏于宿主细胞内而形成长期携带状态,但在某些因素的影响下,EBV的潜伏感染可使细胞发生恶性转化,因此EBV感染与多种肿瘤的发生密切相关。
EBV的基因组为线性双链DNA分子,大小约为173 kb。在其感染的细胞中可检测到病毒基因组编码的6种EBV核抗原(EBNAs1、2、3A、3B、3C、LP)和3种潜伏膜蛋白(LMPs1、2A和2B)等产物。其中,LMP2有LMP2A和LMP2B两种类型,分别由497个氨基酸和378个氨基酸组成。前者编码基因仅比后者多了一个外显子,即LMP2A的第一个外显子编码亲水性N末端的119个氨基酸[4]。生物信息学分析获知LMP2A属于一种磷酸化膜蛋白,含有ITAM和PY基序功能区,均位于胞浆内。通过对LMP2A的三维结构预测得知其功能区位于不规则卷曲内,柔韧性好,有利于招募信号蛋白或激酶及相互结合及作用,引发下游事件,对感染细胞的信号转导进行正向或负向的双向调节,从而维持EBV的潜伏感染。
LMP2对信号转导的正向调节作用表现为,EBV LMP2参与ITAM的构成,LMP2A的N端参与了ITAM的构成,即LMP2A74~77的和LMP2A85~88氨基酸,序列分别为YQPL和YLGL,其中LMP2A中的74位和85位酪氨酸是形成具有ITAM功能的特征性序列(YXXL)关键的氨基酸残基,能与含有SH2结构域的Syk、Lyn、Fyn酪氨酸激酶结合。因此,YQPL和YLGL是具有非常重要功能的氨基酸序列[5]。研究表明,单拷贝ITAM特征性序列[YXXL]2表达即可激活B细胞或T细胞信号传导途径,进而触发细胞内信号传导[3]。但Richard等[6]认为LMP2A本身很可能并不是酪氨酸激酶,只是与胞内酪氨酸激酶相关,在EBV感染的B淋巴细胞或表达LMP2的B淋巴细胞中,LMP2是B淋巴细胞酪氨酸激酶的重要底物。就像多瘤病毒的转化蛋白MT抗原,本身没有内在的生化活性,但是此抗原与酪氨酸激酶Src家族成员如Lyn、Fyn等相关,从而导致各激酶活化。
LMP2对信号转导的负向调节表现在:①EBV LMP2可通过模拟B细胞抗原受体(BCR)而对信号转导的负向调节作用。EBV LMP2中的YXXL序列与BCR中Igα和Igβ的部分序列具有同源性,因此,EBV LMP2模拟BCR,通过Ras/PI3-K/Akt途径激活下游的Ras/MEK/ERK等激酶,改变核因子如NF-κB的表达来调节B细胞的增殖和存活,以达到EBV的持续潜伏感染的目的;或可通过阻止B细胞膜表面免疫球蛋白交联,抑制BCR与胞内蛋白酪氨酸激酶的结合,从而维持B细胞内EBV的潜伏感染;或可通过LMP2A模拟激活B细胞受体,干扰在B淋巴细胞发育过程转录因子的转录调控[7]。Cheryl等[8]报道LMP2A的N末端胞浆区域可与B淋巴细胞Src家族酪氨酸激酶如Lyn和Fyn等通过YXXL序列相互作用,从而阻止酪氨酸磷酸化和钙动员来影响细胞BCR免疫球蛋白的交联,从而抑制正常BCR跨膜信号的传导,以此来维持EB病毒的潜伏感染。②EBV LMP2可通过脯氨酸富集基序(PY基序)对细胞内信号转导起负向调节作用。LMP2A氨基酸N端含有两个保守的PY基序(PPPPY),分别位于LMP2A56~60和LMP2A97~101处。Nedd4泛素化蛋白连接酶中含有WW功能区,能够通过识别PY基序,导致LMP2A和Lyn PTK很快降解,从而下调B细胞信号传导,维持EBV在B细胞内的潜伏感染[9-10]。
蛋白质的生物学功能在很大程度上取决于其空间结构,蛋白质结构构象多样性导致了其具有多种生物学功能。蛋白的结构与功能关系研究是进行蛋白功能预测及蛋白质设计的基础,蛋白分子只有处于特定的三维空间结构情况下,才能获得特定的生物活性;而三维空间结构稍有破坏,就很有可能会导致蛋白质生物活性的降低甚至丧失。因此,利用生物信息学软件对LMP2的空间结构进行预测分析将有助于确认此蛋白的功能单位或者结构域,可为设计新的蛋白质或改造已有蛋白质提供可靠的依据,同时为新的药物分子设计提供合理的靶分子及结构。
通过对EBV LMP2的结构功能分析表明EBV LMP2的N端包含ITAM和PY重要的功能基序,对维持EB病毒的潜伏持续感染起至关重要作用。对LMP2A结构和功能的分析,有助于为EBV潜伏感染、致瘤机制和亚单位疫苗设计提供依据。
[1] 邓路瑶,肖雨萌,黄鹤,等.Epstein-Barr 病毒与其相关疾病研究进展[J].美中医学,2007,4(6):41-44.
[2] 欧琴,朱珊丽,张丽芳.EB病毒潜伏膜蛋白2的二级结构分析和B细胞表位预测[J]. 温州医学院学报, 2007, 37(2):114-118.
[3] Wu S, Zhang Y. LOMETS: a local meta-threading-server for protein structure prediction[J]. Nucleic Acids Res,2007, 35(10):3375-3382.
[4]朱伟,罗兵.EBV潜伏膜蛋白LMP2A的研究进展[J].国际病毒学杂志,2007,14(4):120-123.
[5] Lu J, Lin WH, Chen SY, et a1. Syk tyrosine kinase mediates Epstein-Barr virus latent membrane protein 2A-induced cell migration in epithelial cells [J].J Biol Chem,2006,281(3): 8806-8814.
[6] Anderson LJ, Longnecker R. EBV LMP2A provides a surrogate pre-B cell receptor signal through constitutive activation of the ERK/MAPK pathway[J]. J Gen Virol,2008,89 (7):1563-1568.
[7] Fukuda M,Longnecker R. Epstein-Barr virus (EBV) latent mmembrane protein 2A regulates B-cell receptor-induced apoptosis and EBV reactivation through tyrosine phosphorylation[J]. J Virol,2005,79(13):8655-8660.
[8] Miller CL, Lee JH, Kieff E, et a1.An integral membrane protein (LMP2) blocks reactivation of Epstein-Barr virus from latency following surface immunoglobulin crosslinking [J]. Proc Natl Acad Sci USA ,1994,91(2):772-776.
[9] Seo MD, Park SJ, Kim HJ, et a1. Identification of the WW domain-interaction sites in the unstructured N-terminal domain of EBV LMP 2A[J]. FEBS Lett,2007,581(1):65-70.
[10] Morrison JA, Raab-Traub N. Roles of the ITAM and PY motifs of Epstein-Barr virus latent membrane protein 2A in the inhibition of epithelial cell differentiation and activation of β-catenin signaling [J]. J Virol,2005,79(4): 2375-2382.
(本文编辑:胡苗苗)
Analysis of the structure and function for the latent membrane protein 2 of EBV
ZHENG Meixia,LIU Jianxiao,GONG Wenci,ZHU Shanli,LI Wenshu,ZHANG Lifang.
Deptartment of Microbiology & Immunology,Wenzhou Medical College,Wenzhou,325000
Objective: To predict and analyze the structural and functional characteristics of the latent membrane protein 2 (LMP2) of Epstein-Barr virus (EBV). Methods: From SwissProt the amino acid sequences of LMP2 were obtained. Physio-chemical property, the secondary structure and tertiary structure of LMP2 were analyzed by the computational analysis and bioinformatics webs,Expasy and LOMETS,respectively. Results:The results showed that LMP2 is made up of 497 amino acids with molecular weight 53011.4Da and PI 4.85. It is an acidic protein which owns 12-transmembrane domains and contains immunoreceptor tyrosine-based activation motif (ITAM) and PY motif. The ITAM is located at the positions of amino acid sequence 74~77 and 85~88 and the PY motif is located at 56~60 and 97~101. LMP2 contains 15 α-helices and 7 β-sheet which are connected by random coils. Conclusion: Through bioinformatics analysis,the characteristics and some signaling information of LMP2 were obtained,which would be the basis for further study of its infection, pathogenesis, and new subunit vaccines.
Herpesvirus 4,human;latent membrane protein;protein structure,secondary;bioinformatics
R373.9
A
1000-2138 (2010)03-0218-03
2009-11-10
国家自然科学基金资助项目(30671882)。
郑美霞(1983-),女,浙江衢州人,硕士生。
张丽芳,教授,硕士生导师,Email:wenzhouzlf@ 126.com。

