鞣花酸类化合物在植物界的分布及其生物活性
郭增军,谭 林,徐 颖,吴 楠
西安交通大学医学院药学系,西安 710061
鞣花酸类化合物在植物界的分布及其生物活性
郭增军*,谭 林,徐 颖,吴 楠
西安交通大学医学院药学系,西安 710061
本文综述了自然存在的鞣花酸类化合物的种类及其在植物界的分布,并对其生物活性进行了概述,为进一步开发利用鞣花酸类化合物打下基础。目前发现自然界存在的鞣花酸类化合物约有 17种,主要分布于大戟科中的大戟属和叶下珠属、蔷薇科中的悬钩子属、委陵菜属和草莓属,在珙桐科、使君子科、石榴科和桃金娘科等科属中均有分布,为自然界分布较为广泛的一类化学成分。鞣花酸类化合物具有抗肿瘤、抗病毒、抗氧化、抗菌及增强免疫作用等多种生物活性。
鞣花酸类物质;自然界分布;生物活性
鞣花酸 (2,3,7,8-tetrahydroxy benzopyrano[5,4, 3-cde]benzopyran-5,10-dione,ellagic acid)是广泛存在于各种具有软果或坚果的植物组织中的一种天然多酚成分,为没食子酸的二聚衍生物,是一种多酚二内酯,在自然界以游离的形式或缩合形式 (如鞣花单宁,苷等)存在,分子式为 C14H6O8,鞣花酸的衍生物常见的取代位置是 3-,4-,3′-和 4′-上的-OH,而 5′-也可能被取代,见图 1。鞣花酸类化合物主要存在于热带水果中,如红莓、石榴、草莓、胡桃和越橘等,具有抗肿瘤、抗氧化、抗菌和抗病毒等作用。

图 1 鞣花酸类物质母核结构Fig.1 Parent structure of ellagic acids
1 鞣花酸类化合物的种类及在植物界的分布
从天然植物中所分离得到的鞣花酸类物质主要有以下种类:
鞣花酸 ellagic acid(1),3-甲氧基鞣花酸 3-O-methyl-ellagic acid(2),4-甲氧基鞣花酸 4-O-methylellagic acid(3),3,3′-二甲氧基鞣花酸 3,3′-di-O-methyl-ellagic acid(4),4,4′-二甲氧基鞣花酸 4,4′-di-O-methyl-ellagic acid(5),3,4′-二甲氧基鞣花酸3,4′-di-O-methyl-ellagic acid(6),3,3′,4-三甲氧基鞣花酸 3,3′,4-tri-O-methyl-ellagic acid(7),3,4,4′-三甲氧基鞣花酸 3,4,4′-tri-O-methyl-ellagic acid (8),3,4-亚甲二氧基鞣花酸 3,4-methylenedioxy-ellagic acid(9),3,4-亚甲二氧基-3′-甲氧基鞣花酸 3, 4-methylenedioxy-3′-O-methyl-ellagic acid(10),3,4-亚甲二氧基-3′,4′-二甲氧基鞣花酸 3,4-methylenedioxy-3′,4′-di-O-methyl-ellagic acid(11),3,4-亚甲二氧基-3′,4′-二甲氧基-5′-羟基鞣花酸 3,4-methylenedioxy-3′, 4′-di-O-methyl-5′-hydroxyl-ellagic acid (12),3,4-亚甲二氧基-3′,4′-二甲氧基-5′-甲氧基鞣花酸 3,4-methylenedioxy-3′,4′-di-O-methyl-5′-methyloxy-ellagic acid(13),3,3′,4,4′-四甲氧基鞣花酸3,3′,4,4′-tetra-O-methyl-ellagic acid(14),3,3′,4, 4′-四甲氧基 5′-甲氧基鞣花酸 3,3′,4,4′-tetra-O-methyl-5′-methyloxy-ellagic acid(15),eschweilenol A也叫,rubuphenol,3-O-(2″,3″,4″-tri-hydroxyl-benzene)-ellagic acid(16),3,4-di-O-(1″,2″)-(3″,4″, 5″-tri-hydroxyl-benzene)-ellagic acid(17)等。
以上化合物的结构取代情况及主要参考文献见表1。
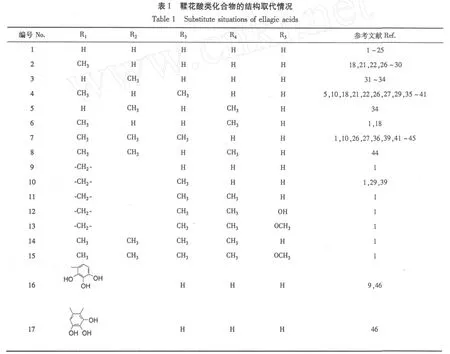
以上鞣花酸类物质广泛分布于不同种属的植物 中,它们在植物中的具体分布见表 2。
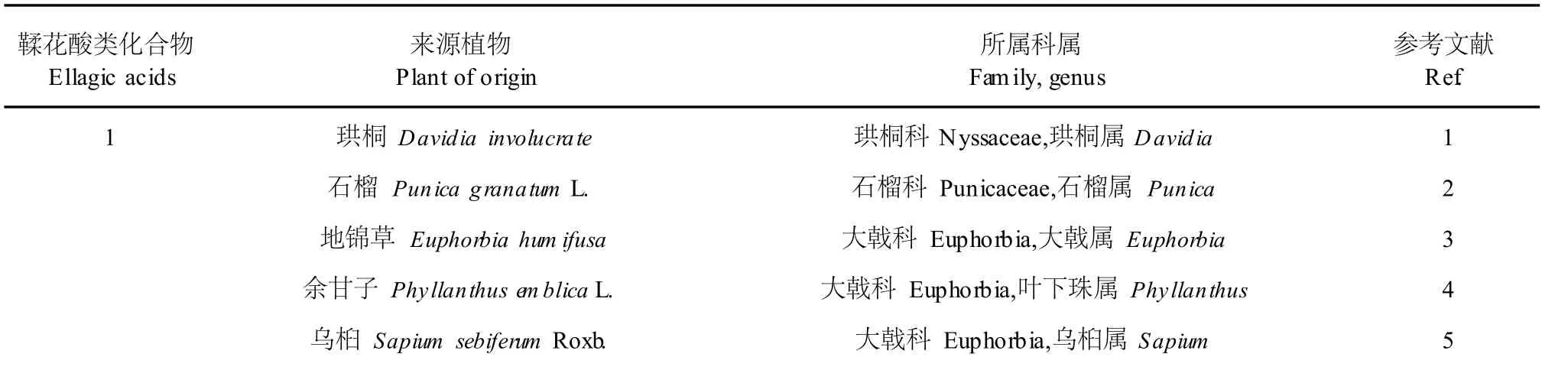
表 2 鞣花酸类化合物在植物中的分布Table 2 Distribution of ellagic acids in plants


由上表可以看出,鞣花酸类物质主要分布于大戟科和蔷薇科,在珙桐科、使君子科、石榴科和桃金娘科等也有分布,并且集中在大戟科的大戟属和叶下珠属中,以及蔷薇科的悬钩子属、委陵菜属和草莓属中。鞣花酸在植物中的分布最广,3,3′-二甲氧基鞣花酸和 3,3′,4-三甲氧基鞣花酸的分布也比较广, 3,4-亚甲二氧基鞣花酸、3,4-亚甲二氧基-3′,4′-二甲氧基鞣花酸、3,4-亚甲二氧基-3′,4′-二甲氧基-5′-羟基鞣花酸、3,4-亚甲二氧基-3′,4′-二甲氧基-5′-甲氧基鞣花酸、3,3′,4,4′-四甲氧基鞣花酸、3,3′,4,4′-四甲氧基 5′-甲氧基鞣花酸分布较少,文献仅报道存在于喜树中,4,4′-二甲氧基鞣花酸只存在于 Elaeocarpusmastersii中。eschweilenolA存在于粗叶悬钩子 Rubus alceaefolius和 Eschweilera coriacea中,EschweilenolB存在于 Eschweilera coriacea中。
2 鞣花酸类化合物的生物活性
2.1 抗肿瘤活性
肿瘤的发生是一个复杂漫长的过程,而最初是由致癌物引发的,许多实验都表明鞣花酸具有抗肿瘤和抗突变作用,小鼠和人组织体外和体内实验表明鞣花酸对多种肿瘤都有很好的抑制作用,特别是对结肠癌、食道癌、肺癌、肝癌、乳腺癌和皮肤癌效果十分显著。此外,鞣花酸也有抑制肿瘤细胞增殖、阻断生长因子信号传导途径、诱导凋亡、抑制 NF-κB, AP-1和 JAK-STAT激活途径、抑制血管生成、抑制抗凋亡蛋白的表达和抑制环氧化酶-2的活性。WendyA.Smith等 (1998)[47]发现鞣花酸对乳腺癌有很强的抑制作用,结果显示,通过鞣花酸干扰, 150μM的叶绿酸,苄基异氰酸酯,奥替普拉,金雀异黄素能使DBP(肽酸二丁酯)–DNA加合物(adduction)降低 75%以上,因此鞣花酸可能通过与酶无关的途径抑制DBP-DNA加合。
鞣花酸可能的抗癌机理包括以下四种:①抑制致癌剂的代谢活性:鞣花酸可以抑制多环芳香类化合物如苯并吡喃,亚硝基化合物如N-亚硝基苄基甲胺和黄曲霉素B1转换成诱导基因的物质。②解除致癌物的毒性:通过动物实验,鞣花酸可以通过刺激体内一些酶的活性比如 GST而解除某些致癌剂如苯并芘的毒性。③清除致癌物:鞣花酸可以与致癌剂的活性代谢物结合形成无害的化合物,从而使得致癌剂不能与细胞DNA结合。④占据DNA上可能与其它致癌物或其代谢物反应的位点鞣花酸通过与鸟嘌呤O6位置的反应可以阻止它的甲基化。从而抑制N-甲基N-亚硝基脲和鲑鲸DNA结合。
2.2 抗病毒活性
鞣花酸和一些鞣花单宁显示对人类 H IV、HBV、小鼠疱疹病毒、鸟的成髓细胞瘤的逆转录病毒都有抑制作用。Euu Hwa Kang等(2006)[48]用 C57ML/6小鼠即在金属离子诱导作用下产生的 HBeAg转基因小鼠(HBeAg-Tg)实验发现在 T-淋巴细胞和B-淋巴细胞水平上对 HBeAg有耐受性,在体内和体外都不产生相应的抗体,只产生了微量的细胞因子 (IF-4和γ-IFN),减小了细胞毒性 T-淋巴细胞免疫应答反应。当用鞣花酸以 5 mg/kg体重的量灌喂小鼠,能有效地阻止由 HBeAg引起的免疫耐受性。
2.3 抗氧化活性
鞣花酸中含有许多酚羟基,它们容易被氧化,因此它可以保护其他物质免被氧化。在哺乳动物中,鞣花酸类化合物对线粒体和微粒体中的脂质体过氧化有很好的抑制作用。因此利用鞣花酸的抗氧化活性,它可以有效地抑制由丝裂霉素和过氧化氢引起的人体细胞损伤,还能抑制多种致癌剂如多环芳香类化合物的形成,因此它广泛被用于食品和医药领域。
Anup Sricastava等[49]研究表明,鞣花酸对 DPPH自由基有很好的清除作用,并且呈现浓度依赖关系,从 IC50值来判断,它的自由基清除活性与槲皮素相当,比叔丁对甲氧酚强。同时清除超氧自由基的 I C50值也表明鞣花酸对超氧自由基的清除活性的也比槲皮素高,而叔丁对甲氧酚没有超氧自由基清除活性。鞣花酸也还是一种优良的羟基自由基和氧化亚氮清除剂。此外,鞣花酸对微粒体脂质过氧化的抑制活性比槲皮素和叔丁对甲氧酚都高得多,它与金属离子的螯合活性也呈浓度依赖关系。总之鞣花酸表现出良好的抗氧化活性,其抗氧化活性与槲皮素和叔丁对甲氧酚相当或者更高。
2.4 抗菌活性
鞣花酸对不同种类的细菌对有很强的抑制活性,它可以保护伤口免受入侵细菌的感染,也可抑制溃疡。B.Thiem等[50]研究了鞣花酸的抗菌活性,实验结果表明鞣花酸具有中等抗菌活性。
2.5 增强免疫活性
鞣花酸是一种天然多酚,可以在体外保护小鼠外周血淋巴细胞免受细胞和DNA损伤。Adluri Ram Sudheer等[51]研究了它对尼古丁诱导的小鼠外周血淋巴细胞的保护作用,实验结果表明在尼古丁对照组中用鞣花酸处理后脂质过氧化指数、DNA损伤程度、核小体数量都有显著的提高,而尼古丁对照组不具有抗氧化活性,用鞣花酸处理后又可以使其恢复抗氧化活性,其抗尼古丁活性与 NAC(N-乙酰基半乳糖)相当,鞣花酸和 NAC在它们的有效剂量范围内对正常淋巴细胞不产生任何损伤。以上结果表明鞣花酸今后可以被开发成尼古丁诱导的基因毒性调节药物。
2.6 抗增殖活性
Jack N.Losso等[52]通过研究了鞣花酸对人脐静脉内皮细胞的抗增殖活性,结果表明,用鞣花酸处理正常孵育的细胞后,ATP生物发光强度增强了约18%~21%。相反,浓度为 1~100μmol/L的鞣花酸在重建的细胞外基质中能抑制 HUVEC管的形成和增殖,同时它也显示了对结肠癌,乳腺癌和前列腺癌细胞株的抗增殖作用。
2.7 DNA损伤活性
Ya-ming Xu等[53]研究了鞣花酸类化合物的DNA损伤活性,利用来源于 RAD53基因条件表达诱导的修复缺陷酵母菌来寻找能破坏DNA的天然产物。实验结果表明,从多种植物包括 Alangium javanicum,Anisophyllea apetala,Crypteronia paniculata, Mouririi sp.and Scholtzia parviflora中分离得到的四种鞣花酸衍生物 3,3′-d imethyl-4′-O-β-D-glucopyranosyl ellagic acid,3,3′,4-tr imethyl-4′-O-β-D-glucopyranosyl ellagic acid,3′-methyl-3,4-O,O-methylidene ellagic acid and 3′-methyl-3,4-O,O-methylidene-4′-O-β-D-glucopyranosyl ellagic acid都被证明具有 DNA破坏活性,尽管分离出来的任何一种单体化合物在体外都没有介导DNA双链打开作用,但它们都有潜在抑制 RAD52缺陷型酵母菌的生长。
1 Xiang GQ(向桂琼),Lu FS(卢馥荪).J Integrative Plant B iology(植物学报,英文版),1989,31:540-543.
2 Lin J(林佳),Li Y(李琰),Xu LZ(徐丽珍).Central South Phar m acy(中南药学),2005,3(2):70-72.
3 Liu RH(柳润辉),et al.Chin Tradit Herb D rugs(中草药), 2001,32(2):107-108.
4 ZhangLZ(张兰珍),et al.China J Chin M atM ed(中国中药杂志),2003,28:940-943.
5 Liu RH(柳润辉),et al.J China Phar m Univ(中国药科大学学报),2002,33:370-373.
6 ZhangLZ(张兰珍),et al.China J Chin M atM ed(中国中药杂志),2000,25:615-617.
7 Seeram NP,et al.Food Chem istry,2006,97(1):1-11.
8 Maeaettae-Riihinen KR,et al.J Agric Food Chem istry,2004, 52:6178-6187.
9 Zhao QC(赵庆春).Shenyang:Shenyang Pharmaceutical U-niversity,PhD.2001.
10 Choi Yong-Hwa,et al.Saengyak Hakhoechi,1998,29(2): 79-85.
11 Xie YH(谢一辉),et al.J Chin M ed M at(中药材),2005, 28(2):99-100.
12 LiLB(李琳波),et al.Chin Tradit Herb D rugs(中草药), 2000,31(2):92.
13 Yang XF(杨小凤),et al.Acta Phar m aceutica Sinica(药学学报),1999,34:457-462.
14 Yan J(闫静),Yang XW(杨秀伟).China J Chin M atM ed(中国中药杂志),2005,30:1923-1926.
15 Li RJ(李人久),et al.China J Chin M atM ed(中国中药杂志),1999,24:479-482.
16 Dai Z(戴忠).Beijing:Beijing University of Chinese Medicine,PhD.2005.
17 Du YH(杜玉虹).Shenyang:Shenyang Pharmaceutical University,2003.
18 Matthew S,et al.Natural Product Research,PartA:Structure and Synthesis,2007,21(1):83-88.
19 Govindarajan R,et al.B iological&Phar m aceutical Bulletin, 2004,27:1266-1269.
20 Brookes KB,et al.South African Journal of Chem istry,1999, 52(4):127-132.
21 Tanaka T,et al.Phytochem istry,1998,47:851-854.
22 Pakulski G,Budzianowski J.Phytochem istry,1996,41:775-778.
23 Fodorea CS,et al.I,2005,109(1):174-178.
24 Sadhu Samir Kumar,et al.Journal of Ethnophar macology, 2006,108:371-378.
25 Yean-Yean Soong,et al.Food Chem istry,2006,97:524-530.
26 Shi XH(石心红),et al.China J Chin M atM ed(中国中药杂志),2006,31:1503-1506.
27 Yan XH(严小红),Guo Y W(郭跃伟).Chin Tradit Herb D rugs(中草药),2004,35(2):125-127.
28 LiD(李端).Beijing:China AgriculturalUniversity(中国农业大学),Master.2005.
29 Khallouki F,et al.Food and Chem ical Toxicology,2007,45: 472-485.
30 Guo QM,Yang XW.Phar m azie,2005,60:708-710.
31 Elkhateeb A,et al.Phytochem istry,2005,66:2577-2580.
32 Ueda H,et al.Phytomedicine,2004,11:652-656.
33 Asami Y,et al.Journal of Natural Products,2003,66:729-731.
34 Ito A,et al.Phytochem istry,2002,61:171-174.
35 Liu D,et al.Chin Tradit Herb D rugs,2003,34(1):4-6.
36 Xue PF,et al.B iochem ical System atics and Ecology,2005, 33:725-728.
37 Sheng XF(盛习锋),et al.Nat Prod ResDev(天然产物研究与开发),2005,17:743-745.
38 Lian Z(连珠),et al.J Chin M ed M at(中药材),2003,26 (1):23-24.
39 Atta UR,et al.Planta M edica,2001,67:335-339.
40 Tanaka N,et al.Journal of Agricultural and Food Chem istry, 2003,51:5906-5910.
41 Zhou G W,et al.Zhongcaoyao,2002,33:589-591.
42 Wang RF,et al.Punica granatum.Fitoterapia,2006,77:534-537.
43 Qi SH(漆淑华),et al.Nat Prod Res Dev(天然产物研究与开发),2004,16:297-299.
44 Faruk MJ A.Journal of the Bangladesh Chem ical Society, 2002,15(1):73-78.
45 Chakravarty AK,et al.Indian Journal of Chem istry,Section B:O rganic Chem istry Including M edicinal Chem istry,1998, 37B:1316-1318.
46 Yang S W,et al.Journal of Natural Products,1998,61:901-906.
47 Wendy AS,et al.M utation Research/Genetic ToxicologyandEnvironmentalM utagenesis,1998,412:307-314.
48 Eun HK,et al.Antiviral Research,2006,72(2):100-106.
49 Anup SL,et al.Food Chem istry,2007,103:224-233.
50 Thiem B,Goslinska O.Fitoterapia,2004,75(1):93-95.
51 Adluri RS,et al.Toxicology,2007,230(1):11-21.
52 Jack N,et al.J Nutritional B iochem istry,2004,15:672-678.
53 Xu Y M,et al.B ioorganic&M edicinal Chem istry,2003,11: 1593-1596.
D istribution of Ellagic Acids in Plantae and Their Bioactivities
GUO Zeng-jun*,TAN Lin,XU Ying,WU Nan
Faculty of Phar m acy of School of M edicine,Xi’an Jiaotong University,Xi’an 710061,China
This study reviewed the types of of the natural existence of ellagic acids and distribution in plantae and their bioactivities.It’s found that ellagic acids of nature existence boasted about 17 species,and these compoundswere mainly distributed in the Euphorbia and Phyllanthus of Euphorbiaceae,Rubus,Potentilla and Strawberry of Rosaceae;besides, theywere also distributed in Nyssaceae,Combretaceae,Punicaceae and Myrtaceae etc.It’s one of the most widely distributed constituents in plantae.Ellagic acids boast anti-tumor,antiviral,antioxidant,antibacterial and immunity-enhancing and other bioactivities.
Ellagic acids;distribution in plantae;bioactivities
R284;Q946
A
1001-6880(2010)03-0519-07
2009-03-18 接受日期:2009-04-27
*通讯作者 Tel:86-29-82655133;E-mail:guozj@xjtu.edu.cn

