银杏种仁中一种抗氧化活性蛋白的纯化及性质
孟如杰,田亚平
江南大学工业生物技术教育部重点实验室,无锡 214122
银杏种仁中一种抗氧化活性蛋白的纯化及性质
孟如杰,田亚平*
江南大学工业生物技术教育部重点实验室,无锡 214122
银杏种仁经破碎,提取缓冲液 4℃浸取后离心得上清液。上清液经硫酸铵沉淀,DEAE-52离子交换层析,MonoQ离子交换层析,UltroGelACA-54凝胶过滤层析后,分离得到一种具有抗氧化活性的蛋白。该蛋白经UltroGe lACA-54凝胶过滤层析测定分子量为 60 kD,经 PAGE和 SDS-PAGE鉴定均为单一蛋白质条带。SDSPAGE测定其亚基分子量为 10 kD。该蛋白具有一定的还原能力和清除超氧阴离子自由基及 DPPH自由基能力,并在 30~60℃温度下具有良好的稳定性。
银杏;种仁蛋白;纯化;抗氧化
银杏 (Ginkgo bilobaL.)为我国特有的植物。近年来,银杏资源的开发受到人们很大的关注,银杏叶以及银杏外种皮的开发更是成为国际性的热点[1-2]。银杏种仁是银杏资源的重要组成部分,其作为一种具有保健作用的食品,在中国已有很长的历史。银杏种仁含有药用成分,具有抑制真菌、抗过敏等作用。但是,国内对银杏种仁的化学成分和生物活性物质的研究报道不多。2000年,HexiangWang等从银杏果仁中分离出一个新的抗菌蛋白,分子量为 13 kD,具有抑制反转录酶的活性[3]。牛卫宁等经过两次柱层析,也分离得到一种分子量为 13 kD的抗菌蛋白[4]。黄文等通过盐溶和盐析,分析了银杏种仁蛋白的组成,并报道了银杏种仁蛋白具有体外抗氧化作用和抗生物氧化作用,且具有体外抗氧化作用的主要为水溶性蛋白[5,6]。
本文采用硫酸铵沉淀和离子交换层析等方法对银杏种仁中具有抗氧化作用的蛋白进行进一步的分离,得到一种分子量为 60 kD具有较好的体外抗氧化活性的蛋白,并对其部分性质进行了研究
1 材料与方法
1.1 试验材料
银杏种仁本地市售,原料经冷冻后,碾碎备用。
1.2 试剂
DEAE-52离子交换纤维素为Amersham生物技术有限公司产品,MonoQ为 Phar macia公司产品,UltroGelACA-54为 Reactifs IBF公司产品。二苯代苦味酰自由基(DPPH)为 Sigma公司产品,标准分子量蛋白购自上海博亚生物有限公司,考马斯亮蓝 R 250为上海生工产品。其它生化试剂为国产和进口分析纯。
1.3 试验方法
1.3.1 抗氧化蛋白的制备与纯化
150 g碾碎的银杏种仁,加入 500 mL提取缓冲液 (50 mmol/L磷酸缓冲液 pH 7.0,0.1 mol/L KCl, 2 mmol EDTA),在 4℃下过夜浸取。过滤后,8000 r/min离心 10 min,上清液加入硫酸铵至 30%饱和度,静置,待沉淀完全后,8000 r/min离心 10 min,收集上清液。加入硫酸铵至 80%饱和度,8000 r/min离心 30 min,收集沉淀,用少量缓冲液溶解后透析。12000 r/min离心 10 min,收集上清液得到蛋白质粗提取液。
DEAE-52离子交换层析 DEAE-52离子交换纤维素层析柱(2×15 cm),将粗蛋白提取液用磷酸缓冲液调 pH 6.5,上样,起始缓冲液为 pH 6.5,0.02 mol/L的磷酸缓冲液。洗脱缓冲液为含 0.1、0.2、0.3、0.4 mol/L的NaCl,pH 6.5的磷酸缓冲液,阶段洗脱,流速 1 mL/min。在 280 nm波长下检测,收集峰液,以DPPH法检测抗氧化活性。
MonoQ离子交换层析将有活性的部分浓缩脱盐,用磷酸缓冲液调整 pH为 7.0,上MonoQ离子交换层析柱 (1×10 cm),起始缓冲液为 pH 7.0,0.02 mol/L的磷酸缓冲液。线性梯度洗脱,缓冲液为 pH 7.0,0.02 mol/L的磷酸缓冲液,NaCl的浓度在 30 min内由 0.01 mol/L增加到 0.4 mol/L,流速 1 mL/ min,在 280 nm波长下检测,收集峰液,适当浓缩后以DPPH法检测抗氧化活性。
UltroGelACA-54凝胶过滤层析 UltroGelACA-54层析柱 (1.5×80 cm),用 pH 7.0,0.02 mol/L的磷酸缓冲液平衡,将收集到的样品适当浓缩后上柱,用同种缓冲液洗脱,流速为 1 mL/min,收集峰液备用。
1.3.2 蛋白质纯度鉴定以及分子量的测定
UltroGelACA-54凝胶过滤层析测定分子量:用以下四种已知分子量的标准样品标定 UltroGe lACA-54柱 (1.5×80 cm)。胰蛋白酶 (Mr 23300),胃蛋白酶 (Mr 35000),卵清蛋白 (Mr 45000),牛血清白蛋白(Mr 68000),流速 1 mL/min,分别测出洗脱体积Ve,同时计算这些分子相应的值 lg Mr,以Ve对 lg Mr作图,得到分子量标准曲线。相同条件下测定样品的Ve,并计算分子量。
SDS-PAGE:分离胶浓度 15%,Tris-HCl,pH 8.9的分离胶缓冲液,浓缩胶浓度 5%,Tris-HCl,pH 6.8的浓缩胶缓冲液,恒压 200 V,电泳 1 h。
PAGE:聚丙烯酰胺凝胶电泳 (PAGE)法,分离胶浓度 12%,Tris-HCl,pH 8.9分离胶缓冲液,恒压100 V,电泳 1.5 h。
电泳后均用考马斯亮蓝 R-250染色,含 10%醋酸和 10%甲醇的脱色液脱色。
1.3.3 蛋白质以及糖浓度的测定
福林-酚法测蛋白质含量,以牛血清白蛋白为对照制作标准曲线。苯酚-硫酸法测糖含量,以葡萄糖为对照制作标准曲线。
1.3.4 抗氧化活性和热稳定性测定
将待测样品统一调整蛋白浓度为 1 mg/mL。1.3.4.1 还原能力的测定[7]在比色管中分别加入0.2、0.4、0.8 mL的样品,加蒸馏水至 1 mL。加入2.5 mL的磷酸缓冲液 (0.2 mol/L,pH 6.6),再加入1%铁氰化钾 2.5 mL。混合物 50℃水浴 20 min后加入 1 mL 10%的三氯乙酸。取 2.5 mL反应液,加入蒸馏水 2.5 mL和 0.1%氯化铁 0.5 mL。在 700 nm处测吸光值。吸光值越高说明样品的还原性越强。以 0.5 mg/mL的抗坏血酸为参照。
1.3.4.2 清除超氧阴离子自由基能力的测定[8]
在比色管中分别加入 0.2、0.4、0.8 mL样品,加蒸馏水至 1 mL。加入 Tris-HCl溶液 (pH 8.2)5.0 mL和 50 mmol/L邻苯三酚溶液 1 mL,迅速摇匀,以蒸馏水为空白对照。每 30 s在 325 nm处测定吸光值。按下式计算清除率。

式中,F0为邻苯三酚的自氧化速率;Fs为加样品的反应溶液吸光值的变化率。
1.3.4.3 清除DPPH自由基能力的测定[9]
在试管中加入 0.01%的DPPH乙醇溶液 2 mL,然后加入 2 mL,各含 0.2、0.4、0.8 mL样品的溶液,摇匀,在 30℃水浴 30 min,以同体积的水代替样品溶液作为对照。在 517 nm下测定吸光值。按下式计算清除率。
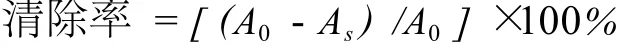
式中,A0为对照的吸光值;As为样品的吸光值。
1.3.4.4 热稳定性实验
将样品溶液分别经过 30、40、50、60、70、80℃水浴处理 30 min后,以 DPPH法测抗氧化活性,加入样品 0.8 mL。30℃时为标准情况。
2 结果
2.1 抗氧化活性蛋白的分离纯化
150 g银杏种仁提取液经过欲处理后,调整 pH为 6.5上DEAE-52离子交换层析柱,起始缓冲液为pH 6.5,0.02 mol/L的磷酸缓冲液。洗脱缓冲液为含 0.1、0.2、0.3、0.4 mol/L的 NaCl,pH 6.5的磷酸缓冲液,阶段洗脱,得到 4个洗脱峰,按洗脱顺序分别记为B1、B2、B3和 B4。以 DPPH法检测抗氧化性。经检测 B2的抗氧化活性较高,且蛋白含量也较高。收集峰B2。见图 1。

图 1 银杏种仁蛋白的DEAE-52离子交换层析Fig.1 Chromatography of protein of seeds on DEAE-52
将 DEAE-52层析得到的峰 B2适当浓缩脱盐后,用磷酸缓冲液调整 pH为 7.0,上样MonoQ离子交换层析柱,起始缓冲液为 pH 7.0,0.02 mol/L的磷酸缓冲液,线性梯度洗脱,缓冲液为 pH 7.0,0.02 mol/L的磷酸缓冲液,NaCl的浓度在 30 min内由0.01 mol/L增加到 0.4 mol/L。如图 2所示,得到两个峰,按洗脱顺序分别记为 C1和 C2,经以DPPH法检测峰 C1的抗氧化性较高,收集峰 C1,见图 2。

图2 MonoQ离子交换层析Fig.2 Chromatography ofB2 onMonoQ
以 UltroGelACA-54对 C1做进一步纯化,并测定其蛋白质相对分子量。结果为只有一个洗脱峰E1,已无杂蛋白峰,收集峰液,测定蛋白浓度,浓缩脱盐待用。
用苯酚-硫酸法测糖含量,结果表明该蛋白质样品中没有糖,说明该蛋白不是糖蛋白。
表 1为每一步纯化后,测定的蛋白含量和其所占的比例。以 150 g银杏种仁提取液经 80%硫酸铵沉淀得到的蛋白为 100%计。
2.2 蛋白质纯度鉴定以及分子量的测定
经UltroGelACA-54凝胶过滤层析测定蛋白 E1的分子量,分子量标准曲线为:y=-150.58x+767.34=0.9628。收集到洗脱液 Ve=48 mL。经计算,分子量为 60 kD。PAGE鉴定其纯度,为单一条带, SDS-PAGE鉴定蛋白质亚基也为单一条带,分子量为 10 kD,如图 3,初步推测该蛋白由单一亚基构成,亚基数为 6个。

表 1 每步纯化后所得蛋白量Table 1 Contents of protein of each step of purification

图 3 银杏种仁蛋白 E1的聚丙烯酰胺凝胶电泳Fig.3 Polyacrylamide gel electrophoresis of E1
图 3中 1、2为UltroGelACA-54凝胶过滤层析蛋白组分 E1。3为标准分子量蛋白,由上到下依次为兔磷酸化酶 (97400),牛血清白蛋白 (66200),兔肌动蛋白 (43000),牛碳酸酐酶 (31000),胰蛋白酶抑制剂 (20100),鸡蛋清溶菌酶 (14400)。4、5为 UltroGelACA-54凝胶过滤层析蛋白组分 E1。15%的分离胶适于分离 10~40 kD的蛋白质,所以以兔肌动蛋白、牛碳酸酐酶、胰蛋白酶抑制剂和鸡蛋清溶菌酶为准进行计算。
2.3 抗氧化活性蛋白的部分性质
2.3.1 抗氧化活性的测定
2.3.1.1 还原能力的测定
加入不同量的银杏蛋白,按照 1.3.4.1的方法进行还原能力的测定,以反应体系的吸光值和加入样品的量作图,同时以抗坏血酸为对照,结果如图4。
由图 4可知,样品有较明显的还原能力,还原能力随加入量的增大而增加。但明显低于抗坏血酸。

图 4 银杏种仁蛋白 E1的还原能力Fig.4 The effective reducing power of E1
2.3.1.2 清除超氧阴离子自由基的测定
按照 1.3.4.2的方法进行清除超氧阴离子自由基能力的测定,以样品清除率和加入样品的量作图。
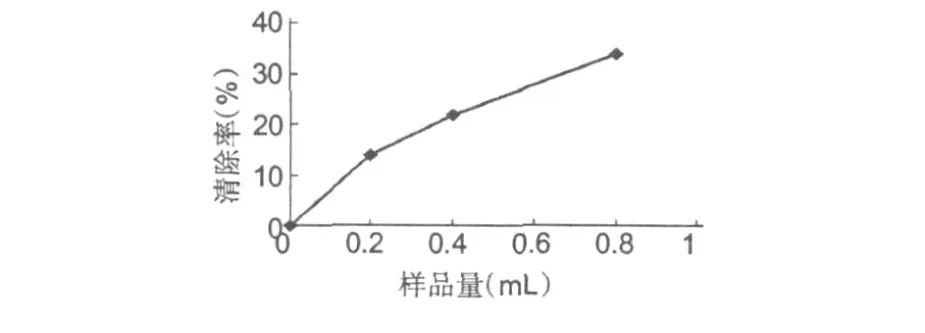
图 5 银杏种仁蛋白 E1清除超氧阴离子自由基的能力Fig.5 The scavenging effect of superoxide anion of E1
由图 5可知,样品具有清除超氧阴离子自由基的能力,清除率随加入量的增大而增加。总体来说,在低浓度情况下清除能力不高,在比较高的浓度下,清除率较为显著。加入样品体积达到 0.8 mL时,清除率达到了 34%。
2.3.1.3 清除DPPH自由基能力的测定
按照 1.3.4.3的方法进行清除DPPH自由基能力的测定,以样品清除率和加入样品的量作图。

图 6 银杏种仁蛋白 E1清除DPPH自由基自由基的能力Fig.6 The scavenging effect ofDPPH radical of E1
由图 6可知,样品具有较好的清除DPPH自由基能力,清除率随加入量的增大而增加。在低浓度时,清除率随浓度增加很快,达到一定的量后,清除率增加减缓。加入样品体积达到 0.8 mL时,清除率为54%。
2.3.2 热稳定性实验
样品溶液分别经过 30、40、50、60、70、80℃水浴处理 30 min后,DPPH法测抗氧化活性,结果如图。
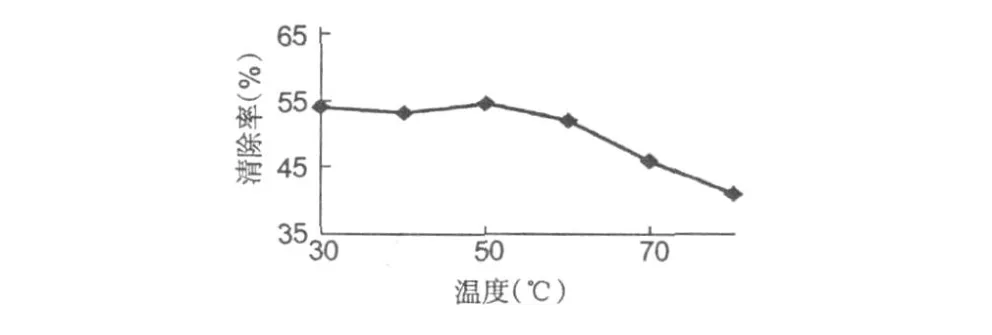
图 7 温度对银杏种仁蛋白 E1的影响Fig.7 Thermal stability of E1
由图 7可知,该银杏种仁蛋白在 30~50℃的温度范围内清除率没有大的变化,当处理温度达到 60℃时,清除率开始缓慢下降,可能是由于较高的温度会使蛋白质的部分结构和性质发生改变,从而使抗氧化活性下降。
3 讨论
氧在生物体内通过单电子还原产生化学性质活泼的物质,既活性氧 (ROS),包括超氧阴离子,羟基自由基等。它们可与DNA,蛋白质和多元不饱和脂肪酸作用,造成DNA的断裂和氧化性损伤,蛋白-蛋白交联,蛋白-DNA交联等,从而造成生物体氧化损伤,并进一步引起癌症,衰老,心血管等慢性病[10]。人体从外源,主要是食物当中获得抗氧化剂有助于减轻生物体的氧化损伤。
银杏种仁经研究,具有耐缺氧,延缓衰老等作用,除了研究较为广泛的酚类,黄酮类物质外,银杏种仁中含有大量的蛋白质,可占干重的 10%,并有较强的抗氧化活性,对其组成成分展开较为深入的研究,将使人们对银杏种仁的保健药理作用有更全面的认识。本文报道了从银杏种仁中分离出一种具有较好抗氧化活性,且含量较高的蛋白质 E1。该蛋白具还原能力,较好的清除羟基自由基的能力,对超氧阴离子也有一定的清除能力,在 30~50℃的水浴处理后仍保持稳定。对于该蛋白抗氧化的机理与其结构的关系及银杏种仁中其他活性蛋白的分离还有待进一步研究。
1 Efeudis FV,Drieu K.Ginkgo bilobaextract(EGB761)and CNS functions,basic studies and clinical applications.Curr D rug Target,2000,1:25-27.
2 Deng YZ,Yuan DX.Determination of polyscaccharide in ginkgobilgal by ultrasonic fragmentation pretreatment with HPLC analysis.Chem J Chinese Univ(高等学校化学学报),2000,21(12):68-72.
3 Hexw Nhte.Ginkbilobin,a novel antifungal protein fromGinkgo bilobaseeds with sequence sinilaritytu enbryo-abandantprotein.B iochanical and B iophysical Research Communication,2000,279:407-411.
4 Niu WN(牛卫宁),Guo GG(郭蔼光),Purification and characterization of an antimicrobial protein from seeds ofGinkgo biloba.Acta Bot Boreal Occident Sin(西北植物学报),2003,23:1545-1549.
5 HuangW(黄文),Xie BJ(谢笔钧),Ling ZQ(凌志群),et al.Studies on antioxidant of ginkgo protein.Food Sci(食品科学),2002,23(suppl)144-148.
6 HuangW(黄文),Xie BJ(谢笔钧),Yao P(姚平),et al. Studieson antibiooxidation of ginkgo protein.Acta NutrimentaSinica(营养学报),2002,24(2):192-194.
7 Oyaizu M.Studies on product of browning reaction prepared from glucose amine.Japanese Journal of Nutrition,1986,44: 307-315.
8 Shimada K,Fujikawa K,Yahara.Antioxidative properties of xanthin on autoxidation of soybean oil in cyclodextrin emulsion.J Agric Food Chem,1992,40:945-948.
9 Zhong YG(钟耀广),Lin N(林楠),Wang SQ(王淑琴),et al.Studyon antioxidative and antimicrobial activitiesof lentinan.Food Sci Tech(食品科技).2007,32(7):141-144.
10 Cui J(崔剑),Li CL(李兆陇),Hong XN(洪啸吟),Bio-antioxidantswith ill therapy.J Tsinghua Univ,Sci Tech(清华大学学报,自科版),2000,40(6):9-12.
Purification and Characterization of an Antioxidant Active Protein fromGinkgo bilobaSeed
MENG Ru-jie,T IAN Ya-ping*
The Key Laboratory of Industrial B iotechnology,M inistry of Education,Jiangnan University,W uxi 214122,China
An antioxidant active proteinwas isolated from the seeds of Ginkgo biloba by using the ammonium sulfate precipitation,the DEAE-52 and MonoQ ion-exchange chromatography,and the UltroGelACA-54 gel filtration chromatography.The protein gave a single band on PAGE and SDS-PAGE.The totalmolecularweight of the protein was 60 kD and the molecularweightof subunitwas 10 kD.The protein showed the capabilityof reducingpower,superoxide anion radical scavenging,and free radical scavenging activity,and was stable at the temperature of 30-60℃.
Ginkgo biloba;protein of Ginkgo biloba seed;purification;antioxidant activity
R284.2;Q946
A
1001-6880(2010)03-0388-05
2008-04-28 接受日期:2008-08-29
*通讯作者 Tel:86-532-88963253;E-mail:yapingtian@hotmail.com

