异补骨脂素加锌对大鼠成骨细胞相关细胞因子表达影响的实验研究
王建华,张军芳,吕 萍,王雅楠
河北医科大学药学院河北医科大学中西医结合研究所,石家庄 050017
异补骨脂素加锌对大鼠成骨细胞相关细胞因子表达影响的实验研究
王建华*,张军芳,吕 萍,王雅楠
河北医科大学药学院河北医科大学中西医结合研究所,石家庄 050017
为探讨异补骨脂素加锌对体外培养新生大鼠颅骨成骨细胞相关基因表达的影响,用改良的组织块培养法分离培养新生大鼠颅骨成骨细胞,在成骨细胞体系中加入异补骨脂素与锌,以雌激素为阳性对照,空白组为阴性对照。结果显示:异补骨脂素加锌较单纯应用异补骨脂素或硫酸锌在 48 h时促体外大鼠成骨细胞Ⅰ型胶原的表达;异补骨脂素加锌组可以明显上调大鼠成骨细胞 TGF-β1的细胞信号转导因子 Smad4 mRNA的表达(P<0.01);能促进 Runx2/Cbfa1 mRNA的表达 (P<0.05)。与空白对照组相比,异补骨脂素组,异补骨脂素加锌组均能增强OsterixmRNA的表达 (P<0.05)。与单纯应用异补骨脂素或者锌相比,异补骨脂素与锌联合应用能够协同增效,对促进体外培养的成骨细胞相关转录因子的表达更加明显,探讨了异补骨脂素及其与锌配伍调节骨代谢的分子机制,为提高骨质疏松症的临床疗效以及抗骨质疏松新药的开发提供了实验依据。
成骨细胞;异补骨脂素;锌;I型胶原(COL I);核心结合因子 (Runx2/Cbfa1);Osterix;Smad4
植物雌激素是存在于一些植物中的具有雌激素效能的化合物。中药补骨脂具有温脾止泻、温补肾阳之功效,其所含有的化合物补骨脂素 (psoralen)和异补骨脂素 (isopsoralen)属香豆素类植物雌激素,在体内能结合雌激素受体,并发挥一定的生物学效应。补骨脂素对促进大鼠成骨细胞增殖和提高碱性磷酸酶活性有较好的作用[1]。锌,是维持机体正常生理功能和内环境正常生化代谢所必需的微量元素,也是骨代谢中不可缺少的重要微量元素之一,它可以有效刺激成骨细胞的骨形成和抑制破骨细胞的骨吸收[2],锌能够促进体外培养大鼠成骨细胞的增殖及分化[3]。
本课题组前期的研究结果显示异补骨脂素和锌制剂协同具有促进成骨细胞增殖与分化的作用,其作用优于单纯应用异补骨脂素或锌制剂[4]。本文继续报道异补骨脂素与锌联合应用对成骨细胞相关基因表达的影响,以探讨香豆素类植物雌激素与锌配伍调节骨代谢的分子生物学机制,为指导临床用药以及防治骨质疏松药物的研发提供实验依据。
1 材料与方法
1.1 实验动物
出生 24 h内 SD系乳大鼠:性别体重不限。河北医科大学实验动物中心提供,动物合格证号: 800100。
1.2 试剂与仪器
DMEM培养基,胰蛋白酶 (G IBCO);胎牛血清(杭州四季青);Ⅱ型胶原酶,十二烷基磺酸钠(SDS),dNTP,Tris碱 (Sigma公司);雌激素,异补骨脂素 (中国药品生物制品检定所);硫酸锌 (zine sulfate)(天津市化学试剂公司 );焦碳酸二乙酯(DEPC),T IANScriptM-MLV,Oligo(dT)15,TagDNA Polymerase,DNA ladder,Loading Buffer(T IANGEN公司产品);Redzol总 RNA提取试剂 (北京赛百盛基因技术公司);琼脂糖,Rnasin(Promega公司产品); EDTA(Boehringer分装);冰醋酸,异丙醇,三氯甲烷,95%分析纯乙醇(国产试剂)。PCR引物均为上海生工生物技术有限公司产品(表 1)。

表1 PCR引物Table 1 PCR sense
XDS-1B型倒置相差显微镜(OLY MPUS);二氧化碳培养箱(美国NATURE公司);7230G型紫外可见分光光度计 (上海精密科学仪器有限公司);DYY-12型三恒多用电泳仪(北京市六一仪器厂);PCR仪(英国 TECHNE公司)。
1.3 新生大鼠颅骨成骨细胞的培养及鉴定
无菌条件下,取出生 24 h内的 SD大鼠乳鼠颅盖骨,用平衡盐溶液 PBS冲洗数次,放入 0.25%的胰蛋白酶溶液中,剔除骨表面被膜及软组织,将骨片剪成 1~3 mm3的骨粒,弃去胰蛋白酶溶液。在0.1%胶原酶Ⅱ中室温消化 45 min,将消化液弃去,平衡盐溶液 PBS洗三遍。将骨粒分散于 100 mL培养瓶中,加入含 20%胎牛血清的DMEM培养液,37℃5%CO2培养箱中培养。5 d后,将骨粒弃去,细胞进行传代培养,将细胞用胰蛋白酶消化,用含10%胎牛血清的 DMEM培养基吹打传代,置于细胞培养瓶中放入培养箱中继续培养。
细胞传至第 5代,通过细胞形态学观察及碱性磷酸酶细胞化学染色鉴定所用细胞为成骨细胞[5],成骨细胞的纯度达到 90%以上。
1.4 检测方法
1.4.1 成骨细胞中总 RNA的提取、鉴定和定量
细胞经过 0.25%胰蛋白酶消化,用含 10%胎牛血清的 DMEM培养基稀释到 5×104/mL接种于100 mL培养瓶中,常规培养 2 d换含异补骨脂素和锌的无血清培养基继续培养 48 h,采用 Redzol试剂进行总 RNA提取。弃上清,每瓶用平衡盐溶液 PBS冲洗后加 1 mL Redzol裂解细胞,然后转移至新的离心管中,室温放置 5 min。各管加入 0.2 mL氯仿,混匀后放置 3 min。4℃,12000 r/min离心 15 min,小心吸取上层水相至一新管中,加入 0.5 mL异丙醇混匀,静置 10 min。4℃,12000 r/min离心 10 min,去上清,RNA沉淀于管底,加入 1 mL预冷的 75%乙醇(DEPC处理过的水配制)洗沉淀,4℃,7500 r/min离心 5 min,弃上清,空气干燥 3~5 min,加入 30 mL DEPC处理过的三蒸水溶解所提取的 RNA样品。
取 5μL RNA溶液,进行 1.5%琼脂糖凝胶电泳,紫外灯下观察 RNA的纯度和完整性。另取 5μLRNA溶液倍数稀释后,测其在 260 nm,280 nm波长下的吸光度,计算总 RNA的含量和 OD260/ OD280的比值以了解其纯度,确保所提总 RNA完好。剩余样品用于 RT-PCR。
1.4.2 反转录反应合成 cDNA
反转录反应体系 (20μL体积)包括:dNTP(10 mM)1μL,Rnasin(30 U/μL)1μL,Oligo(dT)15 (10μM)2μL样品 RNA 1μg,三蒸水补足至 14 μL,70℃水浴 5 min,立即冰上冷却 2 min。再分别加入 5×First-Strand Buffer 4μL,DTT(0.1 M)1 μL,M-MLV(10 U/μL)1μL,混匀,42℃50 min充分反应,95℃5 min(以灭活逆转录酶),反转录后产物置-20℃冰箱保存、备用。
1.4.3 PCR扩增
PCR反应体系 (50μL体积)如下:反转录产物2μL,10×Taq Buffer 5μL,dNTP(10 mM)1μL,目的基因上下游引物 (25 pmol/L)各 1μL(同管扩增时再加内参上下游引物各 1μL),Tag DNA polymerase(5 U/μL)0.3μL,加三蒸水 39.7μL(同管扩增加37.7μL)补至终体积 50μL。最后加封石蜡油约25μL。循环条件:首次 94℃5 min;94℃30 s,58℃60 s,72℃60 s共 35个循环;最后延长 72℃6 min。
1.4.4 PCR产物分析
PCR产物 10μL加 2μL 6×Loading Buffer进行 1.5%琼脂糖凝胶电泳,并至凝胶成像仪中照相。照片进行光密度和面积扫描。计算每一样品和其内参对照的相对含量。
1.5 数据处理
使用 SPSS 13.0 for windows统计软件,所有数据均以±s表示。
2 结果
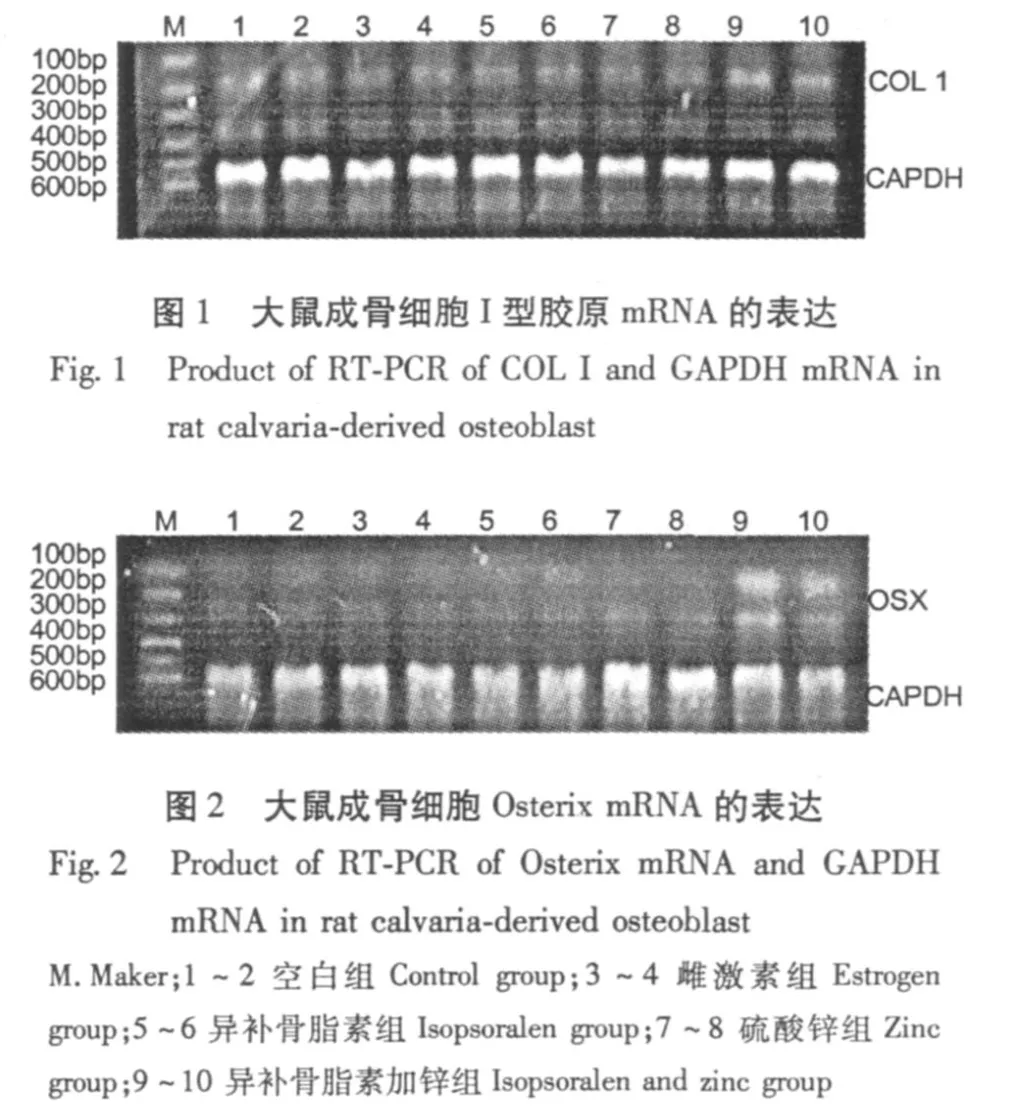
2.1 异补骨脂素和锌对成骨细胞 I型胶原mRNA表达的影响
异补骨脂素加锌组能促进 COL ImRNA的表达,异补骨脂素加锌组的相对表达量为 0.639,与空白对照组相比有统计学意义 (P<0.01),且效果显著。雌激素组和异补骨脂素组均能促进 I型胶原mRNA表达,但二者之间没有明显差别 (见图 1及表 2)。
2.2 异补骨脂素和锌对成骨细胞 Osterix表达的影响
与空白对照组相比,雌激素组,异补骨脂素组,异补骨脂素加锌组均能增强 Osterix mRNA的表达(P<0.05),异补骨脂素加锌组表达量 1.194高于雌激素组和异补骨脂素组 (P<0.01)(见图 2及表2)。
2.3 异补骨脂素和锌对成骨细胞 Runx2/Cbfa1 mRNA表达的影响
空白组Runx2 mRNA/GAPDH mRNA的相对表达量为 0.188,雌激素组的相对表达量 0.942,与空白对照组相比,能显著促进Runx2 mRNA的表达 (P<0.01);而异补骨脂素加锌组的相对表达量为0.7702,与空白对照组相比能明显促进 Smad4 mRNA的表达 (P<0.05);配伍组的相对表达量高于单纯使用异补骨脂素组 (见图 3及表 2)。
2.4 异补骨脂素和锌对成骨细胞 TGF-β信号转导蛋白 Smad4表达的影响
与空白对照组相比,雌激素组、异补骨脂素与异补骨脂素加锌组均能明显促进 Smad4 mRNA的表达 (P<0.01);异补骨脂素加锌组、异补骨脂素组和雌激素组比较没有明显的差别,但可观察到雌激素组的表达量相对较高 (见图 4及表 2)。
3 讨论
转化生长因子β信号通路调节许多过程,包括细胞的增殖,粘附和分化、造血、炎症反应、创伤愈合和骨骼发育。Smad4是 TGF-β家族中信号通路中通用的细胞内信号转导分子,是促进其转导过程的重要中转分子之一[6],研究发现成骨细胞中特异性剔除 Smad4基因的小鼠成骨细胞和破骨细胞明显减少,骨形成和骨吸收下降,导致小鼠早期发生骨质疏松[7]。异补骨脂素组与配伍加锌组均可诱导成骨细胞的分化,促进成骨细胞分泌 TGF-β1的同时,上调 Smad4 mRNA的表达,表明成骨细胞存在Smad4基因表达,推测异补骨脂素以及配伍组促进成骨细胞增殖与分化,增强成骨功能,促进骨形成,可能是通过干预 TGF-β1及其信号转导分子 Smad4的表达而实现的。

图 3 大鼠成骨细胞 Runx2/Cbfa1 mRNA与 GAPDH mRNA的表达Fig.3 Product of RT-PCR of Runx2/Cbfa1 mRNA and GAPDH mRNA in rat calvaria-derived osteoblast
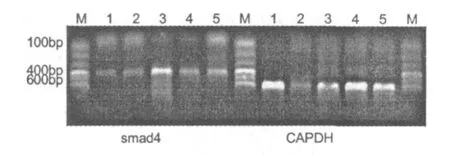
图4 大鼠成骨细胞Smad 4 mRNA与 GAPDH mRNA的表达Fig.4 Product of RT-PCR of Smad 4 mRNA and GAPDH mRNA in rat calvaria-derived osteoblast

表 2 大鼠成骨细胞各目的基因的相对表达量Table 2 Products of RT-PCR in rat calvaria-derived osteoblast
近年的研究发现,核心结合因子α1(core-binding factorα1,Cbfa1)决定着成骨细胞的发生与分化,是成骨分化关键性的转录因子,它在维持正常的骨骼生长发育中起着重要作用。Cbfa1基因敲除纯合子小鼠完全缺乏骨组织,骨内无矿化中心出现;在非成骨细胞如皮肤成纤维细胞过表达 Cbfa1,可诱导出成骨细胞特异性标志物如Ⅰ型胶原α1、骨涎素和骨钙素的表达;相反,若阻断成熟成骨细胞中 Cbfa1的表达,可使成骨细胞标志物的表达下降,并阻断其成骨过程。Cbfa1/Runx2能在非成骨细胞或成骨前体细胞上调成骨分化相关基因的表达。Osterix (OSX)是 2002年 Nakasllima[8]等发现的一种含有锌指结构的转录因子,OSX只在发育的骨组织中特异性表达,在 OSX基因剔除小鼠胚胎中,成骨细胞的分化受到阻碍,各种标志物的表达水平严重降低,可见在OSX基因剔除胚胎中成骨细胞分化、成熟受到抑制从而导致了骨形成的缺失,它是成骨细胞分化和骨形成过程中所必需的关键物质。有学者认为OSX可能是 sox9和软骨细胞的一种负向调控子,可阻止骨/软骨祖细胞向软骨细胞的分化。Cbfa1和Osterix在调控靶基因表达过程中有相互作用的关系,瞬时表达 Cbfa1能够诱导 Osterix的表达。在骨髓间充质细胞向成骨细胞分化过程中 Runx2/Cbfa1能直接刺激相关基因的转录,在 Runx2基因剔除小鼠软骨内骨骼成分的骨膜中未检测到OSX的转录产物,但 Runx2在 OSX失活胚胎中的表达却正常,因此人们推测OSX在胚胎发育成骨过程中出现比Runx2/Cbfa1晚,位于成骨细胞分化路径中它的下游。间充质祖细胞首先分化为前成骨细胞,在这一过程中 Cbfa1和 Cbfβ (core binding factor beta, Cbfβ)发挥决定作用[9],在这个阶段,前成骨细胞是双潜能细胞可以分化为成骨细胞或者成软骨细胞, OSX的参与可使它们分化为成熟的成骨细胞。成骨细胞标志性基因包括 I型胶原、骨钙素 (OC)、骨涎蛋白(BSP)等表达的蛋白构成了骨基质。
通过以上分析及实验结果显示,成骨细胞的骨形成可能通过 Smad4影响 TGF-β1的信号传导通路;Cbfa1以及其他调控因子与下游的 OSX一起激活成骨细胞标志性基因 I型胶原的表达,从而促进骨基质的形成。
补骨脂性辛温、微苦、入肾经,具有温脾止泻、温补肾阳之功效,临床应用情况及现代药理研究均证实补骨脂确有强筋骨,防治骨质疏松的作用。补骨脂的性成分主要为补骨脂素 (psoralen)、异补骨脂素(isopsoralen),属于香豆素类植物雌激素,在体内结合雌激素受体而发挥一定的生物学效应。本文探讨了异补骨脂素加锌防治骨质疏松症的分子机制,配伍组与单纯异补骨脂素组相比其表达量更高,说明锌离子在成骨细胞的分化成熟过程中确实发挥了促进作用,而OSX便是一种具有锌指基序结构域的转录因子,推测其机理可能与锌指结构有关,大多数含有锌指结构蛋白质的确切功能以及他们是否具有其他方面的功能尚不清楚,深入研究可能会有助于推进抗骨质疏松药物的研发工作。目前仍然有很多问题未解决,骨质疏松症的分子生物学机制尚需深入研究。
1 Wang JH(王建华),Wang Y(王艳),Pan Y M(潘永梅). Effects of psoralen on proliferation and differentiation of cultured osteoblastsin vitro.Nat Prod Res Dev(天然产物研究与开发),2007,19:844-846.
2 YamaguchiM,Uchiya Ma S.Receptor activator of NF-κB ligand-st imulated osteoclastogenesis in mouse marrow culture is suppressed by zincin vitro.Int J M olM ed,2004,14:81-85.
3 Cen XB(岑小波),Wang RS(王瑞淑),Wu ZF(吴兆锋). Zinc promotesproliferation and differentiation of osteoblast in ratsin vitro.Chin J PreventiveM ed(中华预防医学杂志), 1999,33:221-223.
4 Zhang JF(张军芳),Guo M(郭敏),Wang JH(王建华). Effects of isopsoralen plus zinc on proliferation and differentiation of cultured osteoblastsin vitro.Nat Prod Res Dev(天然产物研究与开发),in press.
5 Situ ZQ(司徒镇强),Wu JZ(吴军正).Cell Culture(细胞培养).Xi’an:World Book Publishing Company,2004.160-164.
6 KretzschmarM,Liu F,Hata A,et al.The TGF-βfamilymedlator Smad lisphosphorylated directly and activated functionally byBMP receptor kinase.Genes Dev,1997,11:984-995.
7 Yang X(杨晓).The function of Smad4 mediated transforming growth factor-β in regulating bone development and maintaining bone homeostasis.Chin Bull Life Sci(生命科学),2008,20:165-169.
8 Nakasllima K,zhou X,Kunkel G,et al.The novel zinc fingercontaining transcription factor osteoblast differentiation and bone formation.Cell,2002,108:17-29.
9 Komori T.Requisite roles of Runx2 and Cbfβin skeletal development.J BoneM inerM etab,2003,21:193.
Effect of Isopsoralen Plus Zinc on the Expression of Related O steoblasts Factors
WANG Jian-hua*,ZHANG Jun-fang,LV Ping,WANG Ya-nan
Faculty of Phar m acy,HebeiM edical University,Shijiazhuang 050017,China
To study the effects of isopsoralen plus zinc on the gene expression of related osteoblasts factors, Improved tissue block culture were used to demesh and cultivate osteoblasts in cranial bone of newly born SD rats.RT-PCR technologywas used to detect isopsoralen and zinc on osteoblasts related protein(COL I)mRNA,Smad4 mRNA,Cbfa1/Runx2 mRNA,OsterixmRNA expression.Itwas demonstrated that combination of isopsoralen and zinc could synergistically enhance the expression of cultured osteoblasts related osteoblasts factorsin vitro.From the cellular and molecular level to explore osteoporosismechanis m applying isopsoralen and zinc,with a view to improve osteoporosis clinical efficacy as well as anti-osteoporosis drug development in the future.
osteoblast;isopsoralen;zinc;COL I;Runx2/Cbfa1;Osterix;Smad4
R285.5;Q946.91
A
1001-6880(2010)03-0403-05
2009-05-11 接受日期:2009-07-07
河北省自然科学基金(C2009001072);河北省科学技术研究与发展计划项目 (09276418D-14);河北省中医药管理局课题(2007116)
*通讯作者 Tel:86-311-86265628;E-mail:s mith_Wang2000@126.com

