不同光强和光质对白桦幼树体内三萜积累的影响
李新宇,尹 静,詹亚光*,任春林,邱 伟,陈秀福,景丽鸿
1东北林业大学生命学院,哈尔滨 150040;2东北林业大学帽儿山实验林场,哈尔滨 150040
不同光强和光质对白桦幼树体内三萜积累的影响
李新宇1,尹 静1,詹亚光1*,任春林1,邱 伟1,陈秀福1,景丽鸿2
1东北林业大学生命学院,哈尔滨 150040;2东北林业大学帽儿山实验林场,哈尔滨 150040
来源于白桦树皮中的五环三萜类次生代谢产物白桦酯醇和齐墩果酸,具有广泛的药理学活性,是具开发潜力的抗癌和抗艾滋病毒类天然物质。本研究以白桦幼树为研究试材,通过不同光质和光强处理,检测白桦树各部位白桦酯醇和齐墩果酸含量变化。结果表明,与对照 (白光)相比,红、黄、蓝、绿 4种光质处理均降低白桦茎外皮中这两种三萜物质的积累;绿光处理下可显著提高叶片中齐墩果酸含量,而蓝光处理下可显著提高叶片中白桦酯醇含量,两种物质分别为对照的 13.28倍和 1.959倍。生长季节内,茎皮中齐墩果酸和白桦酯醇含量以八月份最高,极显著高于其它月份,且以遮光处理 (50%自然光)的效果较佳,齐墩果酸和白桦酯醇含量比正常光处理分别提高 30.50%和 45.09%。白桦植株中白桦酯醇和齐墩果酸含量的变化显著受到季节的调控。该研究为白桦树中三萜物质高效积累的栽培技术建立和代谢调控研究奠定了基础。
白桦;光;白桦酯醇;齐墩果酸
白桦酯醇和齐墩果酸同为五环三萜类次生代谢产物,具有多种的药理学活性,包括抗肿瘤[1-3]、抗艾滋病[4]、抗真菌[5]、抗病毒[6]、降脂、利胆和保肝等作用[7]。白桦酯醇和齐墩果酸均是植物天然产物,疗效高而毒性低,具有广阔的医用前景。
光是植物生命活动中重要的环境因子之一,它不仅是植物生长发育的能量来源,而且作为信号因子调控植物的生长发育,初生代谢和次生代谢过程。植物的次生代谢产物是植物对生长环境长期适应的结果,它们的代谢过程复杂而且种类繁多。很多研究报道了光强和光质对生物碱、黄酮类、萜类内酯、挥发性成分、糖苷等次生代谢物质影响[8-12]。国内外关于白桦三萜类物质的报道主要集中在白桦三萜的化学合成[13]、提取方法及药理学试验方面[3,4],本实验室对不同种源地和不同树龄及部位中白桦酯醇含量进行了比较和检测[14]。而在生长季节内关于白桦幼树次生代谢产物合成与光的关系尚不明确。本试验以一年半生白桦幼树为材料,研究不同光质和照度光处理后白桦各部位中次生代谢产物白桦酯醇和齐墩果酸含量的变化,以期为白桦树中三萜物质高效积累的栽培技术和代谢调控研究奠定基础。
1 材料
2007年在东北林业大学帽儿山试验基地温室大棚中进行白桦育苗,2008年 5月将白桦幼苗移栽于直径 25 cm,高 35 cm塑料钵中,土重 20 kg。盆栽用土为苗圃土∶草炭∶砂 (2∶1∶1,V/V/V)比例,细筛后反复混匀、保证每盆土壤均匀一致。户外进行常规管理,等量浇水。
2 方法
2.1 光照处理
1)光质处理:试验于 6月初在温室内进行,分别采用红光、蓝光、绿光、黄光滤光膜进行处理,设透明塑料膜处理为对照,不同光质处理一个月后收获植株,每种处理 3~5株,分别取茎皮、叶片及根皮,烘干待 HPLC分析;2)光强处理:试验于 6月初在户外进行,采取黑色遮光网进行遮光处理,透光率为正常光照强度 50%±5%,以正常的户外光照为对照处理,干旱时等量补水。处理后每隔 30天取样一次,取样重复 3~5株,分别测量单株株高和茎粗,称取根、茎、叶鲜重,烘干待 HPLC分析。
2.2 高效液相色谱(HPLC)检测三萜含量
齐墩果酸和白桦酯醇提取:采用改进的超声波醇法[15]。
检测条件:用Water公司 600-717-2487色谱系统,色谱柱 H iQ sil C18V 4.6 mm×250 mm;流动相为乙腈∶水 =4∶1;柱温 25℃;灵敏度 16AUFS;流速1.0 mL/min;检测波长 210 nm,进样 10μL。白桦酯醇含量计算依据线性回归方程:y=204940x+ 14282,r2=0.99875齐墩果酸含量计算依据线性回归方程:y=1028152.5x+35616,r2=0.99943
式中,y为液相色谱检测峰面积,x为样品浓度(mg/mL)。
3 结果与分析
3.1 不同光质处理对白桦植株中三萜含量变化的影响
由图 1(A,B)表明,与对照相比 (白光),4种光质(红、黄、蓝、绿)处理均降低了茎外皮中齐墩果酸和白桦酯醇的积累。除红光处理显著促进根皮中齐墩果酸的积累 (较对照增长 49.12%)外,不同光质处理均不利于根皮中齐墩果酸和白桦酯醇含量积累。4种光质处理均能促进叶片中这两种三萜物质的积累,其中绿光处理对齐墩果酸积累和蓝光处理对白桦酯醇处理效果为最佳,两个处理分别是对照含量的 13.28倍和 1.959倍。

图 1 白桦植株不同部位齐墩果酸和白桦酯醇含量变化Fig.1 Contents change of oleanolic acid and betulin in different parts of the birch plant
3.2 光强处理下白桦植株生长及三萜含量变化
表 1表明,在生长季节,八月份,茎皮中,无论是齐墩果酸还是白桦酯醇含量积累均达到最高值,极显著高于其它月份,而且以遮光处理的效果较佳,齐墩果酸和白桦酯醇含量比正常光处理分别提高30.50%和 45.09%。说明适当的遮光处理有利于白桦树茎皮中这两种三萜物质的积累,但其含量明显受季节调控。另外,叶片和根皮中次生代谢产物积累也以 8月份较高,叶片中齐墩果酸、白桦酯醇及根皮中白桦酯醇含量都以遮光处理较高,其他月份含量都极低,甚至不能被检测到,所以数据未列出。
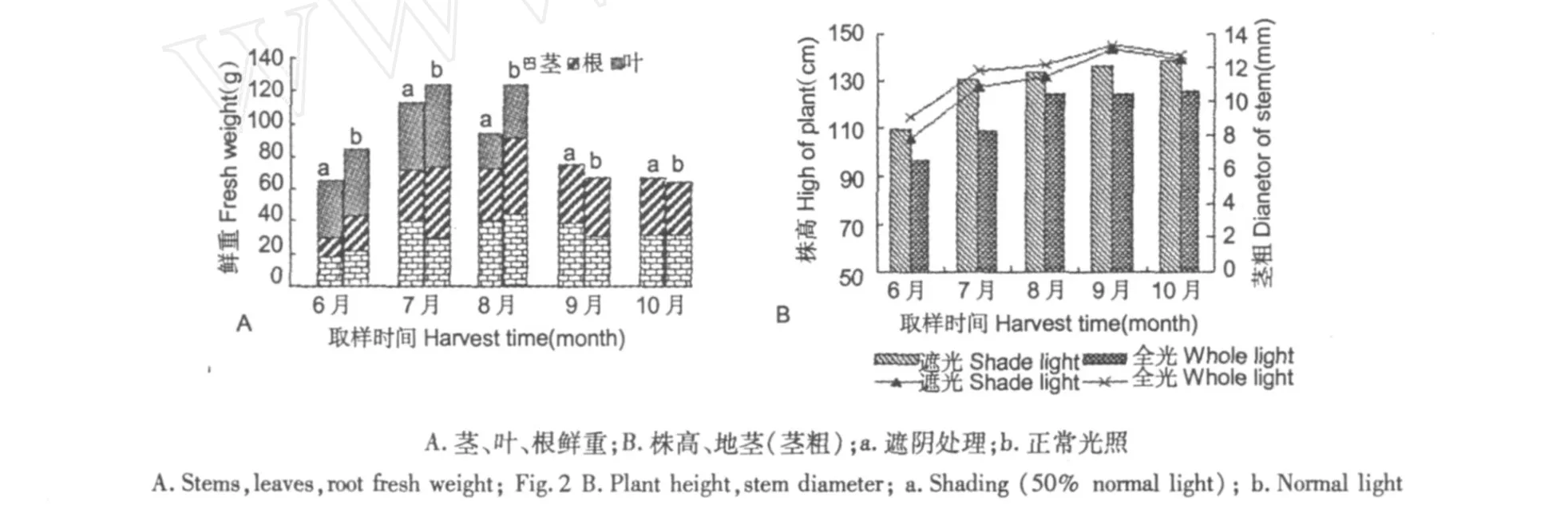
图 2 生长季节内遮阴和全光照处理下白桦植株各部位生长变化Fig.2 Growth change of diffrent part of the birch plant under shade light and the whole light during growing season
由图 2(A,B)可见,生长季节内 6月~10月,株高和茎粗均逐渐增长,以遮光处理有利于株高生长,而正常光照下地径略高。6月和 7月植株根、茎、叶的鲜重表现生长迅速,以正常光照处理表现鲜重增长较高,遮光处理对生长略有抑制。8月以后,开始逐渐有少量落叶,致使 9月份和 10月份叶片鲜重未做统计。
4 讨论
成年白桦树外皮中含有较丰富的白桦酯醇三萜,因树种、年龄、季节和生长条件影响,含量一般在10%~40%之间 (干重),而成年树中齐墩果酸也曾被报道过,但关于白桦幼树中齐墩果酸积累与分布很少有研究。本实验室在之前的研究表明,不同树龄的白桦树的叶、茎外皮和根皮中都能检测出齐墩果酸和白桦酯醇,但主要集中在茎外皮中,叶片和根皮中含量极低[14],本研究表明,茎皮和根皮中白桦酯醇和齐墩果酸积累高峰出现在 8月,两者在茎皮中最高含量可分别约达植株干重 8.10%和 2.64%,叶片仅在 8月和 9月可以检测少量积累,其他月份含量极低,甚至检测不到,说明因季节变异次生代谢产物含量变化显著。
绿色植物通过光合作用制造有机物,经过植物体内的运输和转化产生各级代谢产物,因此,光照对植物有效成分的形成和积累是必须的。以往研究表明,对于某些阳生药用植物,光强的增加能够提高其次生代谢物质的含量,如生于阳坡的金银花中绿原酸的含量高于阴坡[16];绞股蓝在强光条件下其黄酮类化合物含量较高。而对于阴生植物,则须适当遮荫以减少光照强度等,研究发现在 20%的荫棚透光率时人参皂甙含量最高,为干重的 4.5%[17]。遮荫处理可对银杏幼树叶片中药用成分槲皮素的含量有显著的促进作用[8];喜树幼苗叶片的喜树碱含量随着遮荫程度的增加而增加,但严重遮荫的 (光强为全光照的 20%)在处理后期 (75d)喜树碱含量降低[11]。通过红、黄、蓝三种滤光膜处理可促进喜树碱在幼苗叶片中的积累,提高了叶片喜树碱产量。其中在处理后第 10 d至第 30 d,幼苗叶片喜树碱含量均显著高于白光处理,以蓝膜下幼苗的喜树碱含量最高[10]。
本研究发现,红、黄、蓝、绿四种光质处理促进了白桦树叶中三萜物质含量提高,但却显著降低了茎外皮中白桦酯醇和齐墩果酸的积累,所以在进行光质调控时应根据人们所需部位进行选择光,如需要叶片进行制备茶叶,可以进行光质处理,提高三萜物质含量。然而,如果目的是进行茎皮部位的三萜物质合成,则不适宜光质处理。另外,研究中发现各种光质处理后出现叶片萎蔫现象,且严重抑制了植株的生长,一个月内生物量未见增长,说明光质处理后严重制约了叶片的光合作用,导致其正常的光合作用产物严重不足,不能维持其基本的生理代谢所致,影响植株生长和次生代谢产物积累,这也是本实验中光质处理仅持续一个月的原因。适当的遮光处理(透光率 50%左右)同全光照相比,虽抑制了植株生长 (图 2),但对植株茎皮中次生代谢产物积累有利,这一结果说明次生代谢产物积累与植物生长所需的最适宜的环境条件存在一定的矛盾。这一点与以往研究结果相似,即不利于初生代谢的胁迫生态环境有利于药用植物次生代谢产物的积累[18]。因此,需要根据每种植物次生代谢的生态适应性特点,选择具有一定环境压力的次适宜生态环境,以兼顾一些药用植物栽培中生长和次生产物积累的平衡。
1 Pisha EH,Chai IL,et al.Discovery of betulinic acid as a selective inhibitor of human melanoma that functions by induction of apoptosis.NatM ed,1995,1:1046-1051.
2 LiW(李薇),et al.Antitumor activity and immunoregulatory effect of triterpenes isolated fromBetula platyphylla.Chin J Immunology(中医中药与免疫),2000,9:485-487.
3 Zhukova NA,SemenovDE,Sorokina IV,et al.Effect of betulonic Acid and its derivative[3-Oxo-20(29)-Lupene-28-Oyl]-3-Aminopropionic acid on liver structure in mice with RLS lymphoma.B iol Phar m Bull,2005,9:348-351.
4 Li F,Goila-Gaur R,Salzwedel K,et al.PA-457:A potent H IV inhibitor that disrupts core condensation by targeting a late step in Gag processing.PNAS,2003,100:13555-13560.
5 Kovalenko LP,Balakshin VV,Presnova GA,et al. Immunotoxicity and allergenic properties of betulin-containing birch bark dry extract.Phar m Chem J,2007,41:18-20.
6 Liu ZQ(刘志芹),Zhang QY(张庆云),et al.Study on the anti-fungal activity of the bark and the leaves ofBetulaplatyphylla.Tianjin Phar m(天津药学),2004,16(3):3-4.
7 LiD(李丹),Zhou JP(周金培),Wu XM(吴晓明).Recent advances of betulinic acid and its derivatives.Progress in Phar m Sci(药学进展),2004,28(3):120-125.
8 Leng PS(冷平生),Su SC(苏淑钗),Wang TH(王天华). Effects of light intensity and light quality on photosynthesis, flavonol glycoside and terpene lactone contents ofGinkgo bilobaL.seedlings.J Plant Resources Environ(植物资源与环境学报),2002,11:1-4.
9 Yan(阎秀峰),Wang Y(王洋),Shang XH(尚辛亥). Effects of field light intensity and quality on biomass and salidroside content in roots ofRhodiola sachalinensis.Acta Ecologica Sinica(生态学报),2004,24:674-679.
10 Dai SJ(戴绍军),Wang Y(王洋),Yan XF(阎秀峰),et al.Effects of color films on growth and camptothecin content in the leaves ofCam ptotheca acum inataseedlings.Acta Ecologica Sinica(生态学报),2004,24:869-875.
11 Wang Y(王洋),Dai SJ(戴绍军),et al.Effects of light intensity on secondary metabolite camptothecin production in leaves ofCamptotheca acum inataseedlings.Acta Ecologica Sinica(生态学报),2004,24(6):1118-1122.
12 Zhou YT(周忆堂).Studies on the effectof different light intensity on the photosynthesis and secondary metabolit of catharanthus roseus.Chongqing:Southwest University(西南大学),MasterD.2008.
13 Zhang T,Li L,Song LR,et al.Synthetic approach to analogues of betulinic acid.Tetrahedron,2006,62:9321-9334.
14 Yin J(尹静),Zhan YG(詹亚光),Li XY(李新宇).Changes of distribution and content of betulin and oleanolic acid in different apparatus and in induced callus of culture seedling from birch(Betula platyphylla suk.).Plant Phys Commun(植物生理学通讯),2009,45:610-614.
15 Zhang Z(张泽),Sun H(孙宏).Determination of betulin content from bark ofBetula platyphyllasuk.by HPLC.Chemistry&Industry of Forest Products(林产化学与工业 ), 2004,24(1):61-63.
16 LiQ(李强),Ren Q(任茜),Zhang YL(张永良).Effects of ecological environment,collecting stages and storage time on chlorogenic acid content ofLonicera ferdinandiiFranch.China J Chin M atM ed(中国中药杂志),1994,18:594-595.
17 Zhang ZA(张治安),Xu KZ(徐克章),Ren YY(任跃英). Effect of light intensity on content of soluble sugar,starch and ginseng saponin in ginseng plant.J Jilin Agric Univ(吉林农业大学学报),1994,16(3):15-17.
18 Lu SP(鲁守平),SuiXX(隋新霞),SunQ(孙群),et al.Biological functions of secondary metabolism of medicinal plants and influencesof ecological environment.Nat Prod Res Dev(天然产物研究与开发),2006,8:1027-1032.
Effect of D ifferent Intensity and Quality of L ight on Accumulation of Triterpenoid in Birch(Betula platyphyllasuk.)Seedlings
L IXin-yu1,YIN Jing1,ZHAN Ya-guang1*,REN Chun-lin1,Q IU Wei1,CHEN Xiu-fu1,J ING Li-hong2
1College of Life Sciences,2M aoershan Experim ental Forestry Center, Northeast Forestry University,Harbin 150040,China
Betulin and oleanolic acid in bark of the white birh trees as the secondarymetabolites of pentacyclic triterpenoid,have extensively phar macological activities,which are the natural substancesworthy of being empoldered in using for anti-cancer and anti-H IV. In this study,betulin and oleanolic acid content in different parts of birch seedlings which were treated by different intensity and quality of light,were analyzed.The results showed thatwith the comparion of control(white light),the accumulation of the two triterpenoids in their stem skin decreased under four kinds treatment of light quality include the red,yellow,blue,green.Oleanolic acid content in leaf of white birch treated by the green light and betulin content in leaf treated by blue light were significantly increased,which were 13.28 times and 1.959 t ime higher than thatof control,respectively.In the growing season(from June toOctober),the highest contents of oleanolic acid and betulin in the stem bark was in August,which were higher than other months.The best shading treatmentwas 50%of natural light.Under the condition,oleanolic acid and betulin content in the stem bark were increased to 45.09%and 30.50%higher than nor mal light,respectively.The contents of oleanolic acid and betulin in plants changed with the seasons.The research laid bases for seting up the cultivation technology of high efficient accumulation and metabolic regulation study of the triterpenoid substances ofwihte birch.
Birch;light;betulin;oleanolic acid
Q946.91;R284.1
A
1001-6880(2010)03-0475-04
2009-06-25 接受日期:2009-09-21
黑龙江省自然基金重点项目(ZD200918);中央高校基本科研业务费专项基金项目(DL09BA14);中国博士后基金(20080430873)
*通讯作者 Tel:86-451-82191752;E-mail:yaguangzhan@126.com

