奈达铂+紫杉醇化疗联合调强放疗在初治鼻咽癌中的临床观察
李桂梅,何 侠,翟振宇,谈 艳
(1.江苏省扬州洪泉医院放疗科,江苏江都,225200;2.江苏省肿瘤医院放疗科,江苏南京,210009)
越来越多的资料已经表明,IMRT在治疗鼻咽癌中占有的优势,取得了良好的局部控制率,远处转移成为影响鼻咽癌患者愈后的主要原因[1]。放化疗结合是目前治疗鼻咽癌的主要综合治疗手段,寻找IMRT与化疗最合适的结合方式及最佳的化疗方案是目前的要点。回顾性研究分析江苏省肿瘤医院2007年02月17日~2008年07月24日收治的41例鼻咽癌患者,使用奈达铂和紫杉醇联合调强放射治疗鼻咽癌的近期临床疗效作如下总结。
1 资料与方法
1.1 一般资料
2007年02月17日~2008年07月24日收治经鼻咽活检诊断为鼻咽癌患者41例,其中男性29例,女性12例,年龄范围17~70岁,平均45.5岁,KPS≥80分。经病理证实均为低分化鳞癌。依据1992年福州鼻咽癌分期标准[2],41例鼻咽癌患者经临床分期归纳为Ⅱ期、Ⅲ期和ⅣA期3种类型,分别为7例、19例和 15例。所有鼻咽癌患者经临床体检、胸片、腹部B超、骨ECT等检查均未发现有远处转移现象。
1.2 治疗方法
治疗方案:所有患者经病理诊断为鼻咽癌,确定无化疗禁忌后,开始使用紫杉醇+奈达铂诱导化疗,在起初的1~3 d用紫杉醇130~175 mg/m2,第1天;奈达铂50 mg,第1~3天。进行1周期诱导化疗,第5~7天开始调强放疗,采用鼻咽、全颈及锁骨上全程实施 IMRT。到第28天(放疗开始3.3周)再进行第2周期相同方案的化疗与放疗同步进行。
药物化疗方法:紫杉醇130~175 mg/m2,第1天;奈达铂50 mg第 1~3天诱导化疗:用紫杉醇前12 h、6h分别口服地塞米松片15 mg,化疗前半小时静脉滴注甲氰咪呱0.4 g,肌注非那根25 mg,用生理盐水250 mL加入紫杉醇 130~175 mg/m2,3 h用完;然后,使用奈达铂50 mg加入生理盐水250 mL中,1 h用完,连用3 d。用药过程中,辅以止吐、护胃、支持、对症等治疗。
调强放疗方法:①体位固定及CT模拟:全部患者均接受根治性外照射,鼻咽和全颈及锁骨上全程实施IMRT,下颈部、锁骨切线野与上颈、鼻咽调强照射野为头肩一体化调强照射野。所有病例均使用个体化的头肩一体体膜以固定体位,用楔形垫板使下巴仰起,在PHILIPS MX8 000 CT机作 CT模拟,层距 2.5~6.5 mm,扫描上界从眶上缘上2~3 cm到锁骨下3~4 cm,以保证所有靶区体积的下缘有2 cm以上的余量。②调强放疗靶区界定:按ICRU50号及62号文件标准勾画靶区。GTV分为鼻咽原发肿瘤靶区(GTV1)和淋巴结转移病灶靶区(GTV2),根据CT/MRI显示的肿瘤影像边界勾画;鼻咽亚临床灶设置2个CTV,CTV1为GTV+5~10 mm及全鼻咽腔、茎突前间隙;CTV2为GTV+CTV 1+5~10 mm及鼻腔后1/3、上颌窦后1/3、全颈淋巴结预防区等常规放疗应该覆盖的靶区。PTV由逆向计划系统根据不确定因素自然生成。邻近敏感器官结构的勾画包括晶体、视神经、垂体、腮腺、颞颌关节、脑干、脊髓和大脑颞叶等[3]。
强放疗的准备与实施方法:作者在Varian的EKLICPS计划系统上设计鼻咽癌的调强治疗计划。从计划系统的优化结果看,后7野的方案较前7野的要稍好,但是后野方案受到体膜固定架以及治疗床边框的影响,前者可以绘制进人体外轮廓加以解决,而后者由于每次摆位的不完全一致而不能在计划系统内解决,这会带来一定的误差。故采用前 7野。机臂角度一般选择 0°、30°、60°、300°、330°、100°、260°,根据 BeamsView 选择非共面。射线能量选6 MV。全程采用同期整合推量照射技术(SIB),按进程分别给GTV1每日2.18 Gy×28次和 2.24 Gy×4次,共 70 Gy;GTV2每日2.05 Gy×28次和2.15 Gy×4次,共66 Gy;CTV1每日1.88 Gy×28次和1.84 Gy×4次,共 60 Gy;CTV2每日 1.8 Gy×28次,共50.4 Gy。计划设计时除了保证各个治疗体积所需的剂量之外,还要注意正常组织的剂量,尤其是脊髓与脑干的剂量控制在40 Gy以内。对于腮腺剂量争取控制在50%体积30 Gy以下,以使腮腺功能得到充分的保护。调强计划优化时对各个靶区体积作了考虑,脊髓、脑干、腮腺也参加了优化,颅底部有侵犯时晶体也参加优化。颞叶、颞颌关节点、视神经、视交叉等关键器官未参加优化,但在最终决定治疗方案时要加以考虑。
化疗结合调强放疗效果评价方法:IMRT治疗计划实施通过60对动态多叶光栅旋转共面照射完成。评价标准按WHO1981年制定的实体瘤疗效标准评价。分为完全缓解(CR)、部分缓解(PR)、好转(MR)、稳定(SD)和进展(PD)。总缓解率为(CR+PR)/总病例数×100%。毒副作用按WHO1981年制定的抗癌药物不良反应统一标准分为0~Ⅳ等级。IMRT的急性调强放射反应,按照RTOG急性调强放射损伤分级标准分为0~4级[2]。
观察指标和随诊:治疗期间每周行体检、血常规及间接鼻咽镜检查,记录急性调强放射反应和肿瘤消退情况。调强放射治疗第5周及结束后1个月内复查鼻咽及颈部MRI。治疗结束后每3个月复查1次,进行血常规、血生化、胸片、腹部B超和头颈CT或MR检查1次,并记录晚期损伤情况,有远处转移指征时进行胸、腹部CT或同位素骨扫描。随访时间自放疗结束日开始计算,随访截止2008年10月30日,中位随访期9个月。
2 结 果
2.1 鼻咽癌放化疗的效果
41位鼻咽癌患者化疗1周后,经检查评价患者颈部淋巴结部分缓解的有3例(7%),在疗程的第2周停止化疗进行单一调强放疗1周后经检查有6例(15%)表现部分缓解,第3周和第4周,经过2周和3周单一调强放疗后,患者病情部分缓解数分别增到为8例和24例,在疗程的第6周经过化放结合治疗1周后,患者完全缓解数31例(76%),部分缓解数9例(22%),此后,继续进行单一调强放射治疗,对磁共振检查提示鼻咽病灶有残留的患者,治疗结束后,行电子鼻咽镜检查,有2例取病理证实属残留病灶,用后装的方法补充剂量。针对颈部残留淋巴结采用电子线补量5~6 GY/3~5次。在治疗结束后 1个月,复查MRI显示有37例患者为完全缓解,4例为部分缓解,但颈部残留淋巴结直径<1 cm,此时缓解率为100%,详见表1。在第5周前鼻咽腔病灶未进行评估,第6周复查核磁共振后评估情况。
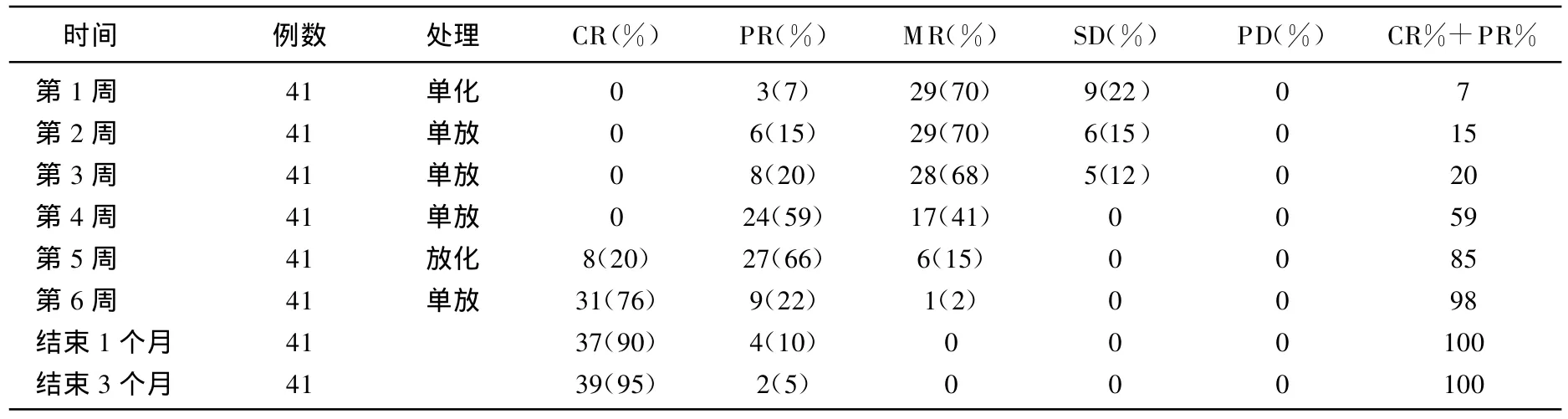
表1 41例鼻咽癌放化疗评价表
2.2 治疗过程中的骨髓抑制及胃肠道毒副反应情况
本研究中,每周查血常规,评价胃肠道反应,疗程中,一般做3次肝、肾功能化验,毒副反应表现多数始于药物化疗后1周以后,详见表2。在药物化疗1周后经检查评价,白细胞减少的患者Ⅰ、Ⅱ和Ⅲ级百分比分别为22%、44%和24%;血小板减少的患者Ⅰ、Ⅱ、Ⅲ和Ⅳ等级百分比分别为32%、22%、7%和5%;血红蛋白减少的患者Ⅰ、Ⅱ和Ⅲ等级百分比分别为44%、12%和5%;恶心与呕吐患者Ⅰ、Ⅱ和Ⅲ等级百分比分别为44%、20%和7%;肝功能损害患者Ⅰ和Ⅱ等级百分比分别为37%和7%;在整个疗程中经检查未发现有肾功能损害现象发生。
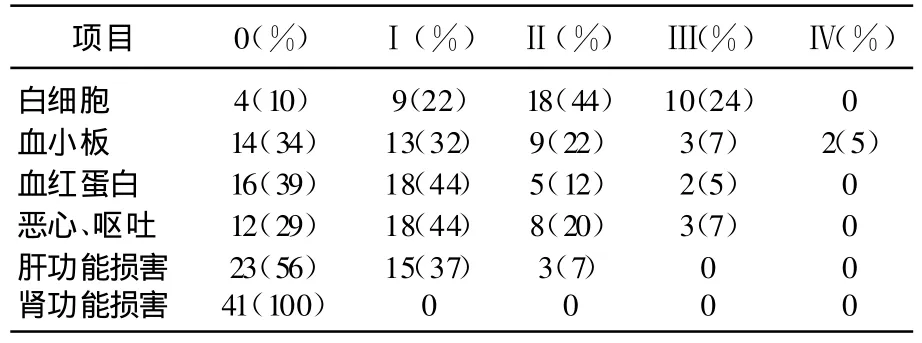
表2 奈达铂+紫杉醇化疗毒副反应等级表
2.3 急性口腔粘膜反应和急性皮肤反应
调强放射反应主要表现为急性口腔粘膜反应和急性皮肤反应,在调强放疗1周后,按照RTOG急性放射损伤分级标准评价分为0~4级,评价结果见表3和表4。调强放射反应的急性口腔粘膜反应大多数在调强放疗两周后出现,呈现随着放疗总剂量增加,反应逐渐加重的现象,到疗程第7周,即治疗结束时达到高峰,此时急性口腔粘膜反应的Ⅰ、Ⅱ和Ⅲ级分别为5%、78%和17%。
急性皮肤反应也是随着放射治疗时间的延长而表现逐渐强烈。表4显示在放射治疗持续4周后急性皮肤反应由正常转到Ⅰ和Ⅱ级,百分比分别为23%和70%,到第8周达到高峰,Ⅰ、Ⅱ、Ⅲ和Ⅳ分别为12%、49%、37%和2%。
鼻咽癌患者经治疗结束后每3个月复查1次。进行血常规、血生化、胸片、腹部B超和头颈CT或MR检查,未发现有肿瘤复发及严重晚期放射损伤。
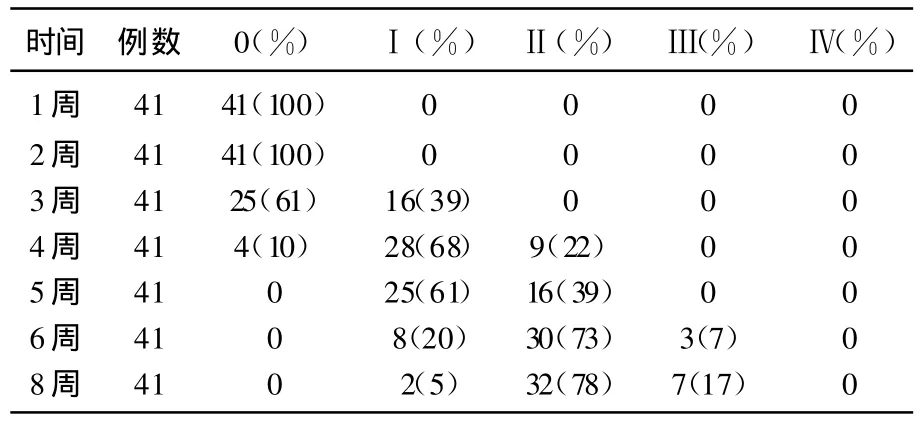
表3 IMRT急性调强放疗毒副反应(口腔粘膜反应)等级表
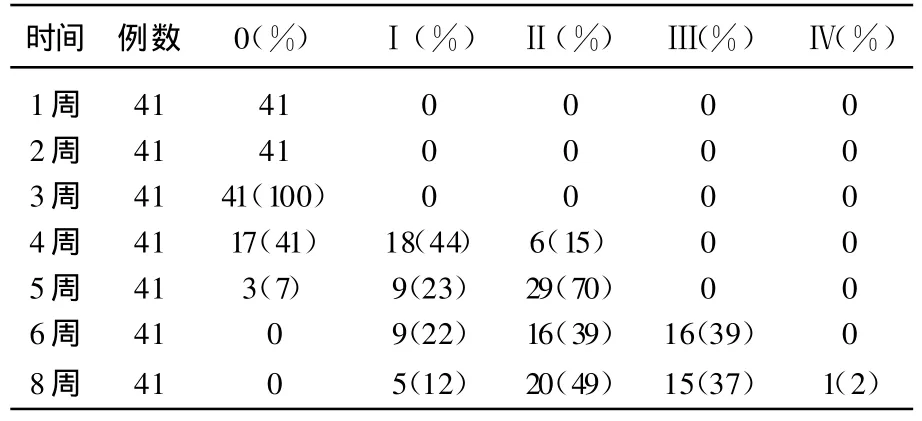
表4 IMRT急性调强放疗毒副反应(急性皮肤反应)等级表
3 讨 论
3.1 紫杉醇+奈达铂诱导化疗鼻咽癌短期效果显著
从表1可知,41例鼻咽癌患者经药物化疗1周后,经检查评价患者部分缓解的有3例(7%),在疗程的第2周停止药物化疗进行单一调强放疗1周后经检查是6例患者表现部分缓解,说明药物化疗虽有疗效,但效果有限。在第2周进行调强放疗1周后,即在第3周和第4周,经过1周的药物化疗,加上调强放疗2周和3周后,患者病情部分缓解数第3周增到为8例(20%),第4周增加到24例(59%),较第2周分别提高了33%和29%,即紫杉醇130~175 mg/m2,第1天;奈达铂50 mg,第1~3天,化疗鼻咽癌效果在调强放疗2周后提高了近3倍。理论上调强放射治疗前诱导化疗具有如下优点:①放疗前没有因放疗所造成纤维化,肿瘤血供良好,有利于药物进入肿瘤组织;②可在短时间内使局部肿瘤及区域淋巴结肿瘤负荷减少,降低分期;③消除已存在的微小转移灶,增加调强放射敏感性。
3.2 紫杉醇+奈达铂化疗和同步调强放疗鼻咽癌具有明显的协同作用
表1显示单独调强放疗鼻咽癌3周时,其疗效评价PR%为24例(59%),接下来增加紫杉醇130~175 mg/m2第1天;奈达铂50 mg,第1~3天,化疗5天,1周后疗效评价CR12例(29%),PR 27(66%),CP+PR由59%提高到95%,其原因可能与具体治疗方案选择有一定关系,理论上,一是奈达铂(奥先达,NDP,江苏奥赛康)是第二代有机铂类抗癌药物,其作用机理为与水结合产生多种离子型物质,以与顺铂相同的方式与DNA结合并抑制DNA复制而发挥抗肿瘤作用,其水溶性比顺铂约高10倍,明显优于顺铂(DDP)。二是紫杉醇可将瘤细胞阻滞于G2/M期,而此阶段肿瘤细胞对放疗敏感,因此紫杉醇可以起到放疗增敏的作用。TXL与NDP协同抗癌机制可能为:TXL能使大多数肿瘤细胞积聚在G2/M期,然后同步进入G1期,而NDP与DDP相同对G1期肿瘤细胞具有明显的细胞毒作用,因此应用TXL后再联合NDP可增强抗肿瘤作用,且毒性反应轻[4]。在许多临床研究中表明,以NDP为基础的联合化疗有更好的有效率和安全性,有逐渐取代DDP的趋势,其肾毒性及胃肠道副反应发生率极低[5],紫杉醇疗效国内报道对晚期鼻咽癌有效率为41.8%[6]。再就是调强放射治疗与常规调强放射治疗相比,可明显提高靶区的覆盖,使得剂量分布与靶区的三维形状一致,靶区内剂量按处方剂量要求分布,克服了常规调强放射治疗的剂量重叠或漏照,在初治早期或晚期鼻咽癌病例均可获得理想的剂量分布,正常组织得到很好的保护[7]。由于紫杉醇130~175 mg/m2第1天;奈达铂 50 mg,第 1~3天,化疗结合调强放疗鼻咽癌具有上述特点,说明奈达铂+紫杉醇化疗联合调强放射治疗鼻咽癌显现较好初治效果是有理论基础的。
如上所述本研究证明放疗前诱导化疗可明显改善近期疗效,更多学者认为同步放化疗是中晚期鼻咽癌综合治疗的可行性方法[8-10],且能缩短治疗时间,能够降低肿瘤消退所需要的调强放射剂量,降低肿瘤复发率与远处转移率,多数报道认为同期放化疗使长期生存率及疗效较单纯放疗提高,可使局部中晚期鼻咽癌获得较好的局部控制率和总生存率。本研究进一步证明紫杉醇+奈达铂诱导化疗及同步调强放疗鼻咽癌具有缩短治疗时间,近期疗效明显。
3.3 采用常规处理方法可有效降低紫杉醇+奈达铂化疗和调强放疗鼻咽癌后产生的副作用
表2的药物化疗毒副反应陆续出现在治疗后的1周,症状有白细胞减少、血小板减少、血红蛋白减少、恶心与呕吐和肝功能损害,还有放疗引起的口腔粘膜和急性皮肤反应(见表3和表4),以上不良反应程度较相关文献报道低[11]。经止吐、升白细胞等对症治疗很快恢复正常,并不影响放疗如期进行;第28天进行第2周期化疗,放疗已经开始3~4周,此后胃肠道反应及骨髓抑制情况加重,2例Ⅳ血小板抑制即在此后出现,经输血等对症治疗,可恢复,并未终止放疗正常进行。对于奈达铂+紫杉醇诱导及放化同步治疗初治鼻咽癌患者(主要是中晚期患者)引起的恶心、呕吐不良反应主要为Ⅰ、Ⅱ度,未见明显肝肾功能损害,骨髓抑制给予粒细胞集落刺激因子治疗,并给予适当支持治疗,全组病例均顺利完成治疗。而对于奈达铂引起的不良反应主要表现为Ⅳ度血小板下降(其发生在第2周期化放同步治疗时期),给予促血小板生成素或输血小板,可恢复至正常,无出血倾向。其Ⅲ级以下口腔粘膜反应及急性皮肤反应经抗炎、对症、营养支持治疗均不影响放疗正常进行。总之对于由紫杉醇+奈达铂化疗和调强放疗鼻咽癌后产生的不良反应,经过相应处理后不影响治疗。
调强放射治疗技术日趋成熟,鼻咽癌是最适于调强放射治疗的肿瘤之一,优于常规放射治疗技术,由于IMRT具有效分隔肿瘤靶区与邻近正常组织器官的不同强度照射优势,使脊髓、脑干、颞叶、视神经、视交叉、腮腺和颞颌关节等危及器官的受照剂量均明显降低[12],分次照射剂量也普遍降低,不仅可达到提高靶体积照射总剂量和分次剂量目的,也显著降低了周围危及器官受照的剂量,从而降低了放化联合治疗的毒副反应。
综上所述,由于奈达铂、紫杉醇药物与调强放射的自身优势特点,以及紫杉醇+奈达铂化疗结合调强放疗鼻咽癌方案合理的实施,使得鼻咽癌患者康复,药物化疗毒副作用和调强放疗不良反应的控制均达到较满意的效果,但远期疗效和后遗症仍需进一步观察研究。
[1]林少俊,陈传本.鼻咽癌调强放射治疗230例初步结果[J].福建医科大学学报,2007,41(1):66.
[2]谷铣之,殷蔚伯,余子豪,等.肿瘤调强放射治疗学[M].第4版.北京:中国协和医科大学出版社,2008:458.
[3]何侠,翟振宇.初治鼻咽癌调强适形放疗近期临床观察[J].肿瘤防治研究,2006,33(4):272.
[4]张美琴.紫杉醇联合奈达铂对HeLa细胞移植瘤生长的影响[J].中国癌症杂志,2007,18(8):587.
[5]王全助,杜京娟.奈达铂联合吉西他滨治疗非小细胞肺癌[J].临床肿瘤学杂志,2004,9(6):637.
[6]何小进,马进安.奈达铂和氟尿嘧啶化疗联合同步放疗治疗Ⅲ、Ⅳa期鼻咽癌临床分析[J].现代肿瘤医学,2007,15(5):626.
[7]洪明晃,郭祥.鼻咽癌[M].北京:中国医药科技出版,2003:337.
[8]徐瑞华,管忠震,姜文奇,等.奈达铂治疗非小细胞肺癌的Ⅱ期临床研究报告[J].癌症,2002,21(12):1354.
[9]佟仲生,李淑芬,汪旭,等.注射用奈达铂治疗头颈部鳞癌与食管癌及非小细胞肺癌Ⅱ期临床试验研究[J].肿瘤防治杂志,2005,12(23):1779.
[10]王全助,杜京娟.奈达铂联合吉西他滨治疗非小细胞肺癌[J].临床肿瘤学杂志,2004,9(6):637.
[11]张力,姜文奇.紫杉醇治疗晚期鼻咽癌的临床研究[J].癌症,2000,19(8):811.
[12]何侠,翟振宇,宋丹,等.初治鼻咽癌调强放疗布野及联合化疗的临床研究[J].肿瘤学杂志,2006,12(4):282.
——再论奈达对翻译本质属性的认知

