H2O2/HAc协同降解制备水溶性壳聚糖及其抑菌性研究
孟 玲, 王 雷
(沈阳化工大学环境与生物工程学院,辽宁沈阳 110142)
H2O2/HAc协同降解制备水溶性壳聚糖及其抑菌性研究
孟 玲, 王 雷
(沈阳化工大学环境与生物工程学院,辽宁沈阳 110142)
采用 H2O2/HAc协同降解法对壳聚糖进行降解.通过正交实验获得 16种水溶性壳聚糖片段,并对降解条件进行研究.以水稻纹枯菌Rhizzctania solaui、小麦赤霉病Fusarium gram inearum以及小麦根瘤病Helm inthnsporium sativum3种植物常见病原菌作为实验菌种,利用含毒介质法分别测定 16种水溶性壳聚糖对上述 3种病原菌的抑菌效果.实验结果表明,降解后的片段较未降解前具有较好的抑菌作用;同一片段在高浓度时的抑菌效果高于低浓度;同一降解条件下获得的水溶性壳聚糖片段对不同植物病菌的抑制作用效果不同.
H2O2/HAc; 水溶性壳聚糖; 降解; 抑菌作用
甲壳素 (chitin)是除植物纤维素外的第二大生物资源,壳聚糖 (Chitosan)是甲壳素的脱乙酰基产物.壳聚糖具有良好的生物相容性,在农业、食品、日用化学品等方面具有广泛的应用[1].研究表明,壳聚糖可作为植物生长调节剂,促进农作物产量提高,还可作为土壤改良剂及用于收获后农产品的保鲜等,尤其在抑制植物病害方面已逐渐成为人们研究的热点[2].如壳聚糖可以诱导植物产生广谱抗性,增强植物的自身防卫能力,抑制多种植物病原微生物的生长,而且对环境不会造成污染[3-6].由于壳聚糖 (Chitosan)相对分子质量大,一般在数十万甚至上百万,因而水溶性差,使其在应用方面受到了很大的限制.壳聚糖经降解生成的低聚合度的壳聚糖片段具有较高的溶解度,易被吸收利用,更显示其独特的生理活性和功能性质[7].关于相对分子质量对壳聚糖抑菌性能的影响已有不少研究,但是研究结果并不统一[8-9].本文通过不同条件下H2O2/HAc协同降解壳聚糖的研究,获得一系列的水溶性壳聚糖片段,并将各种片段对水稻纹枯菌、小麦赤霉病和小麦根瘤病 3种植物病菌的抑制作用分别进行了初步的研究.
1 材料与方法
1.1 实验材料与仪器
壳聚糖,金湖甲壳食品有限公司,脱乙酰度>90%,相对分子质量 30万,食品级;双氧水、乙酸、乙醇、磷酸氢二钠、硝酸钙、蔗糖、蛋白胨和琼脂均为分析纯;供试病原菌:水稻纹枯菌(Rhizzctania solaui)、小麦赤霉病(Fusarium gram inearum)和小麦根瘤病(Helm inthnsporium sativum),由沈阳化工研究院农药生测中心提供.
LDZX-40B I立式自动电热压力蒸汽灭菌器, LD4-2低速离心机,JJ-1电动搅拌器,DHG-9070A电热恒温鼓风干燥箱,LRH-280生化培养箱,HNP-水平流形超净工作台,FA1104电子天平.
1.2 实验方法
1.2.1 水溶性壳聚糖的制备
根据正交实验表 (见表 1、表 2),将壳聚糖(CTS)溶解于稀乙酸(HAc)水溶液中,快速升温到所需温度,在搅拌条件下滴加质量分数为30%的 H2O2,反应若干时间后,调节 pH值为7.0~7.5,抽滤,滤液在室温条件下醇沉,3 000 r/min离心 15 min,将固体于 60℃烘箱中干燥30 min后,得水溶性低聚壳聚糖.

表 1 H2O2/HAc降解壳聚糖因素水平表Table 1 The factor levels of degradation soluble chitosan through HAc/H2O2

表 2 5因素 4水平表Table 2 Designed normal test(5 factors and 4 leves)
1.2.2 水溶性壳聚糖产率的测定
根据产物 (水溶性壳聚糖)质量与原料 (壳聚糖)质量的比值计算水溶性壳聚糖的产率.

1.2.3 壳聚糖降解片段抑菌效果测定
采用含毒介质法[10],供试药剂为不同相对分子质量的壳聚糖乙酸溶液,壳聚糖质量浓度分别为 10 mg/L和 100 mg/L,各供试菌种均另设不加壳聚糖的乙酸溶液作为空白对照.每实验号设 3个平行实验.
将 PDA培养基加入壳聚糖乙酸溶液充分混合,高压蒸汽灭菌后,待其冷却后接种直径0.5 cm的病原菌菌片,放置培养箱中 25℃培养1~2 d后进行调查,调查时分别测量每个处理的供试病原菌菌落生长直径,并计算抑菌率.

2 结果与讨论
2.1 水溶性壳聚糖产率的正交实验结果
利用正交实验,采用 H2O2/HAc降解壳聚糖,获得不同的水溶性壳聚糖片段,其产率结果见表 3.

表 3 水溶性壳聚糖产率的测定结果Table 3 The result of productivity of soluble chitosan
由表 3可知,获得最佳水溶性壳聚糖产率的降解条件是:壳聚糖质量分数为 5%,乙酸体积分数为 4%、双氧水与壳聚糖摩尔比为 4、反应温度为 80℃、反应时间为 4 h.根据极差大小可看出各因素对实验结果的影响程度,5个因素的影响大小为:壳聚糖质量分数 >双氧水与壳聚糖摩尔比 >反应时间 >乙酸体积分数 >反应温度.
2.2 壳聚糖降解片段的抑菌作用结果
利用含毒介质法,对正交实验获得的 16种水溶性壳聚糖的抑菌效果进行研究,其中零号为未降解处理的壳聚糖.实验结果见表 4、图 1~图 3.
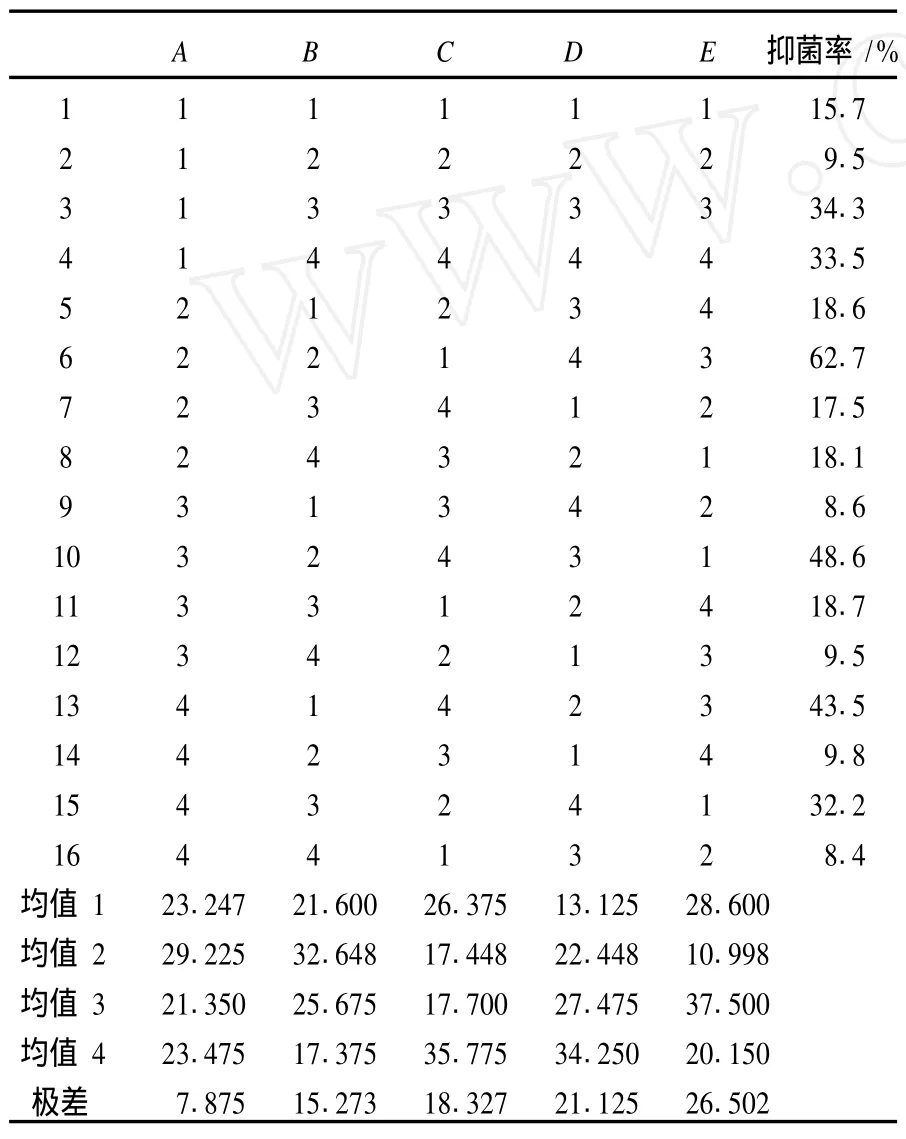
表 4 水溶性壳聚糖对水稻纹枯菌的抑菌效果Table 4 Inhibition effects of soluble chitosan products forRhizzctania solaui

图 1 水溶性壳聚糖产物对水稻纹枯菌抑菌效果Fig.1 Inhibition effects of soluble chitosan products forRhizzctania solaui
由图 1可以看出,未降解处理的非水溶性壳聚糖的抑菌活性较降解得到的水溶性的壳聚糖差,当培养基中水溶性壳聚糖质量浓度为 100 mg/L时,对水稻纹枯病具有一定的抑菌效果.由表 4可知,根据降解得到的 16种水溶性壳聚糖抑菌率,对制备这 16种水溶性壳聚糖的降解条件进行正交实验分析,可得出具有最佳抑菌作用的壳聚糖的降解条件为壳聚糖质量分数 3%,乙酸体积分数 2%、双氧水与壳聚糖摩尔比为 4、反应温度 80℃、反应时间 2 h.当质量浓度降至10 mg/L时,水溶性壳聚糖对水稻纹枯菌的抑菌率均在 30%以下.由图 1可见,除少数情况外,同一片段的水溶性壳聚糖在高浓度时较低浓度的抑菌活性更高.
由图 2可以看出,未降解处理的非水溶性壳聚糖的抑菌活性较降解得到的水溶性的壳聚糖差.根据 16种水溶性壳聚糖对小麦赤霉菌的抑菌率,对降解条件的正交实验分析得到具有最佳抑菌作用的壳聚糖的降解条件:壳聚糖质量分数2%,乙酸体积分数 4%、双氧水与壳聚糖摩尔比为 4、反应温度 80℃、反应时间为 4 h,对小麦赤霉病的抑菌效果最好.当质量浓度降至 10 mg/L时,水溶性壳聚糖对小麦赤霉病的抑菌率均在 30%以下,除 2号、3号实验条件降解得到的产物外,其他条件下得到的同一片段的水溶性壳聚糖在高浓度时的抑菌活性明显高于较低浓度时的抑菌活性.

图 2 水溶性壳聚糖产物对小麦赤霉病抑菌效果Fig.2 Inhibition effects of soluble chitosan products forFusarium gram inearum
由图 3可以看出,未降解处理的非水溶性壳聚糖的抑菌活性较降解得到的水溶性的壳聚糖差.根据 16种水溶性壳聚糖对小麦根瘤菌的抑菌率,对降解条件的正交实验分析得到壳聚糖质量分数 2%,乙酸体积分数 3%、双氧水与壳聚糖摩尔比为 2、反应温度 70℃、反应时间为 2 h时,降解制备的水溶性壳聚糖对小麦根瘤病的抑菌效果最好.当质量浓度降至 10 mg/L时,水溶性壳聚糖对小麦根瘤病的抑菌率明显降低.

图 3 水溶性壳聚糖产物对小麦根瘤病抑菌效果Fig.3 Inhibition effects of soluble chitosan products forHelm inthnsporium sativum
2.3 各种因素对水溶性壳聚糖抑菌效果的影响
2.3.1 壳聚糖质量分数对水溶性壳聚糖抑菌率的影响
研究壳聚糖质量分数对水溶性壳聚糖抑菌率的影响实验中,壳聚糖的抑菌质量浓度均为100 mg/L,结果如图 4所示.由图 4可以看出,当壳聚糖的质量分数达到 3%时,提取的水溶性壳聚糖产物对水稻纹枯菌和小麦赤霉病的抑菌效果均达到较大值,抑菌率为 27.727%.而当壳聚糖的质量分数为 2%时,获得的水溶性壳聚糖对小麦根瘤病的抑菌率达到最大值,为23.134%.因此选择壳聚糖的质量分数在 2%~3%进行降解可以得到较好抑菌效果的水溶性壳聚糖.
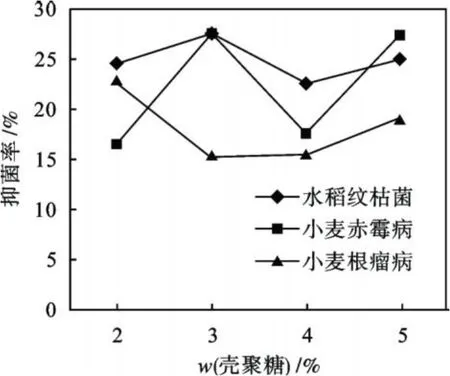
图 4 壳聚糖质量分数对水溶性壳聚糖抑菌率的影响Fig.4 The effect ofmass concentration of CTS for inhabition rate of soluble chitosan
2.3.2 乙酸体积分数对水溶性壳聚糖抑菌率的影响
研究乙酸体积分数对水溶性壳聚糖抑菌率的影响,所有实验中壳聚糖的抑菌质量浓度均为100 mg/L,实验结果如图 5所示.从图 5可以看出,水溶性壳聚糖对水稻纹枯病和小麦赤霉病的抑菌效果受乙酸含量的影响较大,当乙酸的体积分数为2%时,水溶性壳聚糖对水稻纹枯菌的抑菌效果最好,抑菌率为 32.954%.当乙酸的体积分数为3%时,水溶性壳聚糖对小麦根瘤病的抑菌效果最好,抑菌率为 20.612%.当乙酸的体积分数达到 4%时,水溶性壳聚糖对小麦赤霉病的抑菌效果最好抑菌率为 32.325%.

图 5 乙酸体积分数对水溶性壳聚糖抑菌效果的影响Fig.5 The effect ofvolume concentration of HAc for inhabition rate of soluble chitosan
2.3.3 温度对水溶性壳聚糖抑菌效果的影响
反应温度对水溶性壳聚糖抑菌效果的影响如图 6所示.

图 6 反应温度对水溶性壳聚糖抑菌效果的影响Fig.6 The effect ofmol ratio ofreaction temperature for inhabition rate of soluble chitosan
所有溶液中壳聚糖的抑菌质量浓度均为100 mg/L,在 50~80℃之间随温度的升高,获得的水溶性壳聚糖对水稻纹枯菌的抑菌效果逐渐增加,80℃时的抑菌率为 34.545%.而对于小麦根瘤病和小麦赤霉病的抑菌效果并无规律可循,如果要获得外观颜色浅的片段且具有较好的抑菌效果,可采用 50℃降解条件获得的水溶性壳聚糖产物.
2.3.4 双氧水与壳聚糖摩尔比对水溶性壳聚糖抑菌效果的影响
壳聚糖抑菌质量浓度仍是 100 mg/L,实验结果如图 7所示.由图 7可以看出,当双氧水与壳聚糖的摩尔比在 0.5~1之间时,水溶性壳聚糖对水稻纹枯菌的抑菌效果逐渐下降,双氧水与壳聚糖的摩尔比在 1~2之间时,水溶性壳聚糖对水稻纹枯菌的抑菌效果表现平稳,当双氧水与壳聚糖的摩尔比达到 2~4之间时,水溶性壳聚糖对水稻纹枯菌的抑菌效果逐渐增大,当摩尔比为 4时,壳聚糖对水稻纹枯菌的抑菌效果达到最大值,抑菌率为 34.772%.当双氧水与壳聚糖的摩尔比为 4时,提取的水溶性壳聚糖对小麦赤霉病的抑菌效果最好,抑菌率为 25.159%.当双氧水与壳聚糖的摩尔比为 2时,提取的水溶性壳聚糖对小麦根瘤病的抑菌效果最好,抑菌率为25.128%.

图 7 双氧水与壳聚糖摩尔比对水溶性壳聚糖抑菌效果的影响Fig.7 The effect ofmol ratio between H2O2and CTS for inhabition rate of soluble chitosan
2.3.5 反应时间对水溶性壳聚糖抑菌效果的影响
在抑菌效果方面,壳聚糖的抑菌质量浓度为100 mg/L.反应时间对水稻纹枯病的抑菌效果影响较大,结果见图 8.从图 8可以看出,当反应时间为 2 h时,提取的水溶性壳聚糖对水稻纹枯病和小麦根瘤病的抑菌效果最好,抑菌率分别为38.182%和 25.319%.当反应时增加到 4 h时,提取的水溶性壳聚糖对小麦赤霉病的抑菌效果最好,抑菌率为 23.911%.

图 8 反应时间对水溶性壳聚糖抑菌效果的影响Fig.8 The effect of reaction time for inhabition rate of soluble chitosan
3 结 论
(1)采用 H2O2/HAc协同降解壳聚糖,可获得一系列的水溶性壳聚糖片段.获得最佳水溶性壳聚糖产率的降解条件是:壳聚糖质量分数为5%,乙酸体积分数为 4%、双氧水与壳聚糖摩尔比为 4、反应温度为 80℃、反应时间为 4 h.5个因素对实验结果的影响程度大小为:壳聚糖质量分数 >双氧水与壳聚糖摩尔比 >反应时间 >乙酸体积分数 >反应温度.
(2)各种水溶性壳聚糖片段分别对水稻纹枯菌、小麦赤霉病和小麦根瘤病 3种植物病菌的抑制作用研究表明,降解后的片段较未降解前具有较好的抑菌作用;大部分情况下同一片段在高浓度的抑菌效果高于低浓度;同一降解条件下获得的水溶性壳聚糖片段对不同的植物病菌的抑制作用效果不同.
[1] Cheng M ingyu,Deng Jinguang,Yang Fei,et al.Study on Physical Properties and Nerve Cell Affinity of Composite Films from Chitosan and Gelatin Solutions [J].B iom aterials,2003,24(17):2871-2880.
[2] 郎刚华,陈西广,刘成圣,等.壳聚糖及其衍生物在生物工程领域中的应用研究[J].海洋科学,2001, 25(7):25-28.
[3] 马鹏鹏.甲壳素及其衍生物在农业生产中的应用[J].植物生理学通讯,2001,37(5):475-478.
[4] 赖凡,雷朝亮,钟昌珍.蝇蛆几丁糖对几种植物病原真菌的抑制作用[J].华中农业大学学报,1998, 17(2):122– 125.
[5] 水茂兴,马国瑞,陈美慈,等.壳聚糖添加助剂保鲜草莓的效应[J].浙江大学学报 (农业与生命科学版),2001,27(3):343-344.
[6] Struszczyk Henryk,Pospieszny Hehryk.N ew Applications of Chitin and Itsderivatives in Plant Protection[M]//Goosen M attheus F A.Application of Chitin and Chitosan.Lancaster:Technom ic Publishing Company,1997:129-139.
[7] Chiang M T,Yao H T,Chen H C.Effect of D ietary Chitosans with D ifferent V iscosity on Plasm a L ipids and L ipid Peroxidation in Rats Fed on a D iet Enriched with Cholesterol[J].B iosci B iotechnol B iochem,2000,64(5):965.
[8] 宗献周,沈月新.不同平均分子量的α-壳聚糖的抑菌作用[J].上海水产大学学报,2000,9(2):138-141.
[9] Jeon Y J,Park P J,Kim S K.A ntim icrobial Effect of Chitooligosaccharides Produced by B ioreactor[J]. Carbohydrate Polym er,2001,44(1):71-76.
[10]L in W L,Hu X Y,ZhangW Q,et al.Hydrogen Peroxide M ediates Defence Responses Induced by Chitosans of D ifferentM olecularW eights in Rice[J]. Journal of Plant Physiology,2005,162(8):937-944.
Preparation of Soluble Chitosan Through HAc/H2O2Coordinated Reaction and Inhibition on Phytopathogenic Fungi
M ENG L ing, WANG Lei
(Shenyang U niversity of Chem ical Technology,Shenyang110142,China)
Chitosan was degradate through H2O2/HA c coordinated reaction,and16kinds of soluble chitosan fragm ents w ere obtained by orthogonal experim ents and degradation conditions w ere studied.Three comm on phytopathogenic fungi:Rhizzctania solaui,Fusarium gram inearum and Helm inthnsporium sativum as experim ental objects.By using toxic m edium m ethod,16kinds of soluble chitosan fragm ents act on the three phytopathogenic fungi,respectively.The experim ental results show ed that the fragm ents after degradation had better effects than not degradation;the inhibition rates of sam e fragm ent at high concentrations w ere better than those at low concentrations;for different phytopathogenic fungi,there w ere different effects of soluble chitosan fragm ents w hich w ere obtained with sam e degradation conditions.
H2O2/HA c; soluble chitosan; degradation; inhibition
S482.2
A
1004-4639(2010)03-0209-06
2009-09-16
孟玲(1969-),女,吉林吉林人,副教授,博士,主要从事生物农药方面的研究.

