阿魏酸钠对单侧输尿管梗阻大鼠肾间质纤维化的防治作用
谌洪俊,苏 宁 ,陈昱江 ,朱春玲,李 龙
(1.贵阳中医学院,贵州 贵阳 550002; 2.贵阳医学院附属医院,贵州 贵阳 550004)
肾间质纤维化是各种肾脏疾病进入终末期的共同病理损害,采取各种措施阻止肾间质纤维化的发生是临床防治肾小管间质病变、保护肾功能的重要目标之一。肝细胞生长因子(HGF)能促进小管上皮细胞增殖,同时具有抗凋亡的作用,能够拮抗小管间质纤维化[1]。因此,笔者选用HGF研究新型内皮素受体拮抗剂阿魏酸钠(SF)防治单侧输尿管梗阻(UUO)大鼠肾间质纤维化的作用环节和机制,现报道如下。
1 资料与方法
1.1 试剂与动物
试剂:一抗分别为兔抗大鼠HGF,小鼠抗大鼠!-平滑肌肌动蛋白(!-SMA)单克隆抗体(中山生物公司),生物素标记山羊抗兔IgG,生物素标记山羊抗小鼠IgG,链酶亲和素-过氧化物酶复合物,封闭用正常山羊血清;二氨基联苯胺(DAB)显色系统(博士德生物公司),链霉素亲和素-生物素-辣根过氧化物酶(SABC)试剂盒。
动物及分组:雌性SD大鼠(贵阳医学院动物中心,清洁级),体重180~200 g,适应性饲养 1周后,随机分为 4组,即假手术组(SHAM组),模型组(UUO组),洛汀新治疗组[血管紧张素转换酶抑制剂(ACEI)组],SF治疗组,每组均为12只。
1.2 模型建立与给药方法
UUO组及两治疗组均予戊巴比妥钠45 mg/kg腹腔注射以麻醉大鼠。取左侧背部脊柱旁1 cm、肋下1 cm纵形切口,逐层分离,找到并游离输尿管,结扎并剪断输尿管,逐层缝合,清洁伤口,得UUO动物模型。SHAM组仅行输尿管游离而不结扎,其余处理方法相同。SF组和ACEI组于手术前1 d分别按110 mg/(kg·d)和10 mg/(kg·d)灌胃给药[2-3];SHAM组及UUO组以等量清水灌胃。试验期间大鼠自由进食进水。第9天断头处死大鼠,取术侧肾组织,置10%甲醛溶液中,用于病理切片和免疫组化染色。
1.3 检测指标及半定量分析方法
肾小管间质病理改变:将10%甲醛溶液固定的肾组织常规石蜡包埋切片,经HE及Masson染色后,显微镜200倍放大后分别在左上、左下、右上、右下、中间各取2个视野,每张切片共10个视野,依据间质纤维化、小管萎缩、间质浸润、红细胞管型、蛋白管型、间质水肿、小管扩张、小管细胞空泡变性8项指标来观察肾间质病理改变并作肾小管间质损伤指数评分[4]。
免疫组织化学方法:采用SABC法。载玻片应用APES防脱片处理。石蜡切片常规脱蜡,新鲜配制3%H2O2灭活内源性过氧化物酶,复合消化液37℃消化1 h。正常山羊血清封闭液室温封闭20 min。分别滴加不同的一抗,37℃孵育1 h。滴加生物素化羊抗小鼠或抗兔 IgG,37℃孵育 30 min。滴加 SABC复合物,室温下孵育30 min。最后加入DAB显色液,显微镜下控制显色时间,苏木素衬染,脱水、透明、封片。试验同时采用磷酸盐缓冲液(PBS缓冲液)替代一抗的方法作为阴性对照。将染色切片于高倍镜下(200×)观察15个不重复的肾小管间质视野,测定阳性染色面积占1个视野面积的百分比做半定量分析,观察肾脏!-SMA及HGF的表达。
1.4 统计学方法
使用SPSS 11.10 for Windows软件,数据用均数±标准差表示,多组间比较采用单因素方差分析。HGF与各项指标之间做Pearson相关分析。
2 结果
2.1 SF对肾脏病理的影响
肉眼观察可见,SHAM组肾脏大小、形态正常,颜色暗红;UUO组结扎侧肾脏肿大,颜色变浅,有囊性感,切开后可见褐色混浊尿液,肾实质变薄。光镜下,SHAM组偶见肾小管上皮细胞空泡变性,灶状单核细胞浸润;UUO组可见弥漫的肾小管上皮细胞空泡变性,多数肾小管扩张、萎缩,偶见坏死,肾间质有多灶状单核细胞浸润和纤维化,肾小球无明显病变。SF组及ACEI组上述改变均有所减轻,且肾小管间质损伤指数明显下降(P<0.05),但仍高于SHAM组的水平。
2.2 SF对肾组织内HGF和α-SMA表达及分布的影响
HGF表达:SHAM组小管间质内几乎无表达。UUO组阳性表达主要在肾小管周围细胞,尤以髓质区明显,少量肾小管上皮细胞胞浆也为阳性表达(图1)。

图1 免疫组化示HGF的表达(200×)
!-SMA表达:SHAM组的血管壁平滑肌细胞呈强阳性,肾小球和肾小管上皮细胞无明显着色,肾髓质稀疏散在分布呈弱阳性。UUO组表达部位以肾间质为主,主要围绕在萎缩或扩张的肾小管周围,或可见散在于纤维化的肾间质中(图2)。
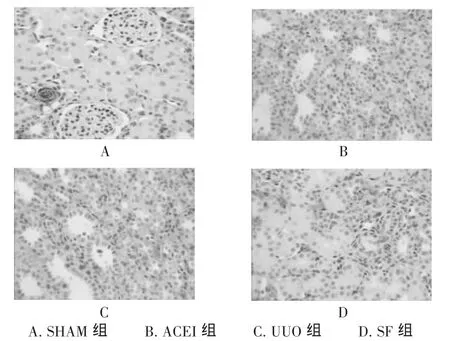
图2 免疫组化示!-SMA的表达(200×)
半定量分析比较:结果见表1。UUO组的!-SMA及HGF表达均较SHAM组明显上调(P<0.01),SF组和ACEI组!-SMA的表达均较UUO组明显减少(P<0.01),且两组间比较无统计学差异(P>0.05)。SF组及 ACEI组 HGF 的表达高于 UUO 组(P<0.05),但两组间比较无统计学差异(P>0.05)。HGF与肾小管间质损伤指数 (r=0.917,P <0.01)及 ! -SMA(r=0.841,P <0.01)均为正相关关系。
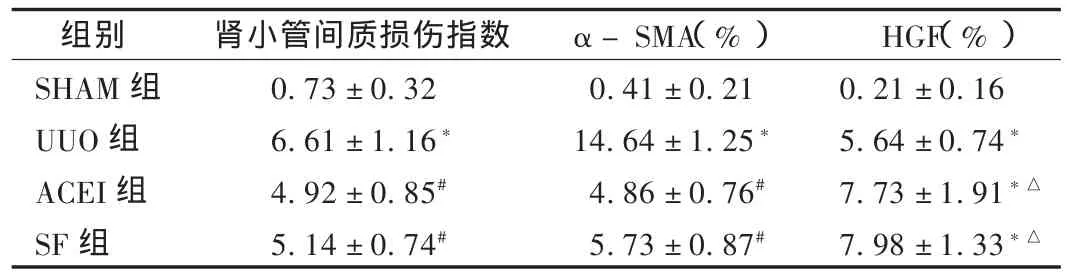
表1 各组大鼠肾小管间质损伤指数、!-SMA及HGF的改变
3 讨论
正常肾组织!-SMA的表达仅见于肾脏血管,而肾小球和肾间质中无或极少表达,说明正常肾脏几乎无肌成纤维细胞(MyoF)。在各种病因(如炎症、免疫反应等)刺激下,表达!-SMA的MyoF可在肾小球系膜区、肾小球周围间质、萎缩的小管周围纤维化区域及血管周围增生,参与肾脏纤维化形成[5]。本试验的结果也显示,!-SMA的表达与肾间质纤维化程度呈密切的正相关关系,提示预后不良。本试验中还观察到!-SMA主要表达于肾间质细胞及部分小管上皮细胞,由此推测病理条件下成纤维细胞的分化、肾小管上皮细胞的转分化均可能参与了肾间质中MyoF的形成,这与文献报道基本一致[6]。
生理条件下,肾脏HGF仅表达于间质来源的细胞上,包括肾小球系膜细胞、间质成纤维细胞等,其生物学作用主要是保持正常肾脏结构和功能,促进肾小管上皮细胞的有丝分裂、形态发生,并抑制其凋亡[7-8]。有试验研究证实,急性肾损伤后,组织及血浆中的HGF浓度反应性升高,对于维持和重建肾小管结构和功能的完整性起着重要作用[9]。体外试验也证明,HGF具有促进肾小管细胞再生、有序化排列形成小管分支和细胞移动的作用[10]。对UUO小鼠小管间质纤维化的研究证实,单独HGF基因治疗7 d及14 d后,其抑制!-SMA表达率分别为54%和60%,并能抑制纤维连接蛋白(FN)及"型胶原等间质的沉积,抑制转化生长因子-#(TGF-#)及其受体的表达[11]。进一步的研究表明,HGF与TGF-#在肾间质纤维化进程中存在互逆效应,在近曲小管细胞培养液中,HGF能完全阻止由TGF-#所诱导的上皮细胞向MyoF转化[12]。本试验中,UUO组术后9 d梗阻侧肾HGF表达均明显高于SHAM组,且治疗组较模型组表达增高,并与!-SMA相互间呈正相关表达,提示在慢性肾脏疾病的早中阶段,HGF在肾脏反应性表达增高可发挥其重要的保护及修复功能,且洛汀新及SF能通过上调HGF的表达发挥抗间质纤维化作用。
内皮素1(ET-1)不仅为强烈的缩血管肽,而且是一种强炎症介质。肾组织多种细胞(如肾小球系膜细胞、肾小管上皮细胞和成纤维细胞等)均能合成及分泌成熟的ET-1,同时表达其受体,通过自分泌和旁分泌作用发挥多种病理生理学效应[13]。研究表明,ET-1能够刺激体外培养的人肾间质成纤维细胞增殖并上调其TGF-#的表达,而选择性内皮素受体拮抗剂能够特异地阻断上述效应[14-15]。田雪飞等[16]证实ET-1可能参与 UUO大鼠的肾间质纤维化过程,而内皮素受体拮抗剂波生坦有可能通过抑制TGF-#而拮抗纤维化。SF是中药阿魏、川芎等的有效成分,是一类新的非肽类内皮素受体拮抗剂。有研究证实,SF能减轻糖尿病肾病大鼠TGF-!的表达及ECM的沉积[2]。本试验观察到SF能明显下调UUO组大鼠"-SMA的表达,发挥抗纤维化效应,推测SF可能通过阻断ET-1与其受体的结合,进而抑制TGF-!表达,促进HGF的表达,从而改善肾脏的纤维化病变。另外,SF的抗炎作用也可能参与了抗纤维化的进程,但具体机理有待于进一步深入的实验及临床研究。
综上所述,内皮素系统可能参与了肾间质纤维化过程;SF对于UUO模型同样具有使肾小管扩张及萎缩减少、肾间质内单核细胞的浸润减少、间质纤维化病变减轻的治疗作用,且疗效与ACEI类药物相似,并与贝那普利一样能上调肾脏保护性因子HGF,发挥重要的修复和再生作用,有着良好的临床应用前景。
[1]Yang J,Dai C,Liu Y.Systemic administration of naked plasmid encoding hepatocyte growth factor ameliorates chronic renal fibrosis in mice[J].Gene Therapy(Basingstoke),2001,8(19):1 470 - 1 479.
[2]赵同峰,张 梁,邓华聪.阿魏酸钠对糖尿病大鼠肾脏的保护作用及机制研究[J].中国中西医结合杂志,2004,24(5):445 -449.
[3]陈运芬,朱春玲,李 龙.单核细胞趋化蛋白-1和#型胶原在糖尿病肾病大鼠肾组织中的表达[J].贵州医药,2004,28(1):10 - 12.
[4]Radford MG,Donadio JV,Bergstral EJ,et al.Predicting renal outcome in IgA nephropathy[J].J Am Soc Nephrol,1997,8(2):199 - 207.
[5]Pedagogos E,Hewitson TD,Walker RG,et al.Myofibroblasts involvement in chronic transplant rejection[J].Transplantation,1997,64(8):1 192 -1 197.
[6]Crupp C,Troche I,Klass C,et al.A novel model to study renal myofibroblasts formation in vitro[J].Kidney Int,2001,59(2):543 - 553.
[7]Yamashita Y,Jeschke MG,Wolf SE.Differential expression of hepatocyte groeth factor in liver,kidney,lung,and spleen following burn in rats[J].Cytokine,2000,12(9):1 293-1 298.
[8]Ueda T,Takeyama Y,Hori Y,et al.Hepatocyte growth factor increases in injured organs and functions as an organotrophic factor in rats with experimental acute pancreatitis[J].Pancreas,2000,20(1):84 - 93.
[9]祝高红,朱忠华,张 春,等.肝细胞生长因子在大鼠肾间质纤维化中作用机制的研究[J].医学研究生学报,2004,17(4):319 - 321.
[10]Liu Y,Rajur K,Tolbert E,et al.Endogenous hepatocyte growth factor ameliorates chronic renal jijury by activating matrix degradation pathways[J].Kidney Int,2000,58(5):2 028 -2 043.
[11]Yang J,Dai C,Liu Y.Hepatocyte growth factor gene therapy and angiotensin$blockade synergistically attenuate renal interstitial fibrosis in mice[J].J Am Soc Nephrol,2002,13(10):2 464 - 2 477.
[12]Yang J,Liu Y.Dissection of key events in tubular epithelial to myofibroblast transition and its implications in renal interstitial fibrosis[J].Am J Pathol,2001,159(4):1 465 - 1 475.
[13]Kohan DE.Endothelins in the normal and diseased kidney[J].Am J Kidney Dis,1997,29(1):2-26.
[14]王海燕.肾脏病学[M].第2版.北京:人民卫生出版社,1996:477-478.
[15]田雪飞,唐功耀,谌贻璞.内皮素1及内皮素受体A拮抗剂对人肾间质成纤维细胞的作用[J].中华医学杂志,2002,82(1):5-9.
[16]田雪飞,唐功耀,谌贻璞.内皮素受体拮抗剂对单侧输尿管梗阻大鼠肾间质纤维化的保护作用[J].中华医学杂志,2003,83(6):510 -514.

