从FPN1基因筛选预测有氧耐力训练对左心室功能指标影响的分子标记
乌云格日勒,胡 扬,李燕春,聂 晶,席 翼,文 立
从FPN1基因筛选预测有氧耐力训练对左心室功能指标影响的分子标记
乌云格日勒1,胡 扬2,李燕春2,聂 晶3,席 翼4,文 立5
目的:通过膜铁转运蛋白1(FPN 1)基因多态性与有氧耐力训练后左心室功能指标训练效果的关联性分析,以期能为预测有氧耐力训练效果和制定个性化有氧耐力训练方案提供科学依据。方法:对102名中国北方平原地区健康男子进行为期18周的有氧耐力训练,使用超声心动仪测定其训练前后安静状态和递增负荷运动下的左心室结构功能指标,应用PCR-RFLP技术解析受试者FPN 1基因rs1123110、rs4145237多态性。采用association studies with training response phenotypes方法,分析rs1123110、rs4145237多态性与训练前后左心室结构功能指标变化的关联性。结果:经18周有氧耐力训练后,rs1123110的CC型群体100W/SV和100W/SV I的增加量显著高于TT型群体、CO和COI的下降量显著大于TT和TC型群体;rs4145237的CG型群体训练前安静时CO和Re/EF的增加量显著高于其他基因型。研究表明,rs1123110的CC型和rs4145237的CG型可以作为预测部分心室功能指标训练效果的分子标记。
膜铁转运蛋白1;基因多态性;训练;左心室功能;分子标记
研究表明,人类运动能力的个体差异[1,2]、有氧耐力训练效果[16,18]均与基因多态性关联。因此,通过基因多态性与反映运动能力表型指标的关联性研究,探寻影响人体有氧运动能力的基因标记,从基因水平揭示人类不同个体间训练效果存在差异的本质,已成为运动生命科学重要的研究内容之一。
膜铁转运蛋白1(ferroportin1,FPN 1)是参与铁代谢的一种铁调节跨膜蛋白[14],FPN 1可促进铁从小肠上皮细胞转运进入血液,并参与巨噬细胞对铁的再循环过程,对铁循环再利用起着重要的作用,影响着机体铁平衡状态[13],进而影响人的运动能力。当细胞内铁缺乏时,使FPN 1表达下降[21]。适度运动使十二指肠FPN 1的表达增强[3],而腓肠肌FPN 1表达则减少[4]。有研究发现,FPN 1基因不同的变异体表现出不同的铁输出功能[19,20]。因此,推测FPN 1基因是与人体有氧运动能力相关的重要候选基因。本研究选取102名中国北方平原地区汉族男子,通过18周的有氧耐力训练,探讨FPN 1基因rs1123110、rs4145237多态性与有氧耐力训练后左心室功能训练效果的关联性,以期为预测耐力训练效果,制定个性化有氧耐力训练方案提供分子标记。
1 研究对象与方法
1.1 研究对象
102名中国武装警察某部队新兵,籍贯为山东等北方平原地区,全部为健康、汉族男性。入伍前均无训练史,也未进行长期耐力性活动,无家族疾病史。所有研究对象均知情同意。受试者平均年龄18.82±0.88岁,身高171.67 ±5.83 cm,体重60.27±6.54 kg。
1.2 研究方法
1.2.1 有氧训练计划
每周进行3次5 000 m匀速跑有氧耐力训练,共持续18周。其训练强度通过个体无氧阈强度(VT)对应的心率(HR)控制,由polar表(芬兰)监控(VTHR±3次/min)。前10周训练强度为95%个体VTHR,后8周训练强度为105%个体VTHR。正式训练前进行2周适应性训练。训练期间,受试者作息时间、饮食条件、训练安排均保持一致。训练地点在部队驻地,由专人负责整个训练过程。
1.2.2 左心室功能指标的测定
a.测试方法:受试者静坐10 min,测定安静时心功能指标,然后以起始负荷50 W和60 rpm的频率开始蹬车,每3 min增加50 W负荷,直至150 W负荷蹬踏3 min后结束,总负荷时间9 min,平卧恢复3 min。分别测定50 W、100W、150 W负荷的最后30 s和恢复期的最后30 s的左心室功能指标。全部测试由同一实验师完成。
b.测试仪器:ERICH JAEGER D-8700型卧式功率自行车(德国产),Aloka SSD-118型超声心动仪(日本产)。
c.测试指标:每搏输出量(SV)和每搏输出量指数(SI);心输出量(CO)和心输出量指数(CI);射血分数(EF);心动周期(T)。
1.2.3 基因多态性分析
采用Promaga公司试剂盒提取全血DNA。人的FPN 1基因位于2号染色体上,全长约20 kb,含8个外显子。rs1123110、rs4145237为NCBI的SNPs库公布的FPN 1基因多态位点,位于intron2和intron5。HapMap-HCB显示杂合度均>30%。Hapview分析表明,rs1123110和rs4145237位点是标签SNP位点。参考AC_000045序列,应用Primer 5.0自行设计引物(上海生工生物工程有限公司合成),采用PCR-RFLP进行基因多态性分析。目前,国内外尚无FPN 1基因多态性功能研究的相关报道。
rs1123110位点分型方法:
引物(5′→3′):上游5cgt tgt tta cat cga aga tct ttc cc,下游gct taa gtc agt cac tct acc att c;PCR反应体系(15μl): DNA模板0.4μl,Taq酶(0.2μl,5 U/μl),dNTP(0.4μl, 10 mM),Mg2+(1.6μl,25 mM),上下游引物各2μl(0.05 μg/μl),PCR buffer2μl,灭菌双蒸水补齐;PCR反应条件: 95℃预变性10 min,变性95℃30 s,退火58℃30 s,延伸72℃30 s,共30个循环,72℃延伸7 min;酶切条件:PCR产物3.5μl,内切酶BstuⅠ(Bsh1236Ⅰ)3.5U,37℃水浴3 h。
rs4145237位点分型方法:
引物(5’→3’):上游atc tcc atc tca tct cat cac aac a,下游tgg aaa gca att gag gac cag g;PCR反应体系(15μl):DNA模板0.4μl,Taq酶(0.2μl,5U/μl),dNTP(0.4μl,10mM), Mg2+(1.4μl,25mM),上下游引物各2μl(0.05μg/μl), PCR buffer2μl,灭菌双蒸水补齐;PCR反应条件:95℃预变性10 min,变性95℃30 s,退火62.5℃30 s,延伸72℃30 s,共30个循环,72℃延伸7 min;酶切条件:PCR产物3.5 μl,内切酶Rsa I 1U,37℃水浴3.5 h。
测试仪器:PCR扩增仪(PCR SYSTEM 2700、美国ABI公司);梯度PCR扩增仪(iCYCLER、美国Biorad公司);水平板电泳仪(DYY-8C、北京六一仪器厂);紫外凝胶成像系统(BIOSPECTRUM-AC、美国UVP公司)。
1.3 数据处理
采用χ2检验确定受试者人群的基因型频率是否符合H-W遗传平衡定律。所有数据在K-S检验的基础上,计算出变化量(△=训练后-训练前)。基因型组间和组内数据采用重复测量的双因素方差分析和一元方差分析。数据处理采用SPSS 13.0软件,数据均用±SD,显著性水平为P<0.05。
2 实验结果
2.1 FPN 1基因多态性分布特征
rs1123110位点在受试者人群中的分布为CC型:6 (0.06),TC型:32(0.31),TT型:64(0.63),经卡方检验χ2=0.228,P>0.05,符合H-W遗传平衡定律。rs4145237位点在受试者人群中的分布为CC型:4(0.04), CG型:33(0.33),GG型:65(0.63),经卡方检验χ2= 0.130,P>0.05,符合H-W遗传平衡定律。CC型只有4人(n<5),不做分析。
2.2 FPN 1基因多态性与心功能指标训练效果的关联性
2.2.1 与每搏量的关联性
rs1123110、rs4145237位点各基因型在不同状态下SV、SI初始值之间没有显著差异(P>0.05);经18周耐力训练后,rs1123110位点CC型100 W/SV和100 W/SV I的增加量显著高于TT(P<0.05),而rs4145237位点不同基因型变化量之间没有显著差异(P>0.05,表1)。
2.2.2 与心输出量的关联性
rs1123110位点各基因型在不同状态下CO、CI初始值之间没有显著差异(P>0.05),但rs4145237位点CG型CO的初始值显著高于GG型(P<0.05);经18周耐力训练后,rs1123110位点CC型CO和CI的下降量显著大于TT和TC型(P<0.05),而rs4145237位点不同基因型变化量之间没有显著差异(P>0.05,表2)。
2.2.3 与射血分数的关联性
rs1123110、rs4145237位点各基因型在不同状态下EF初始值之间没有显著差异(P>0.05);经18周耐力训练后,rs4145237位点CG型Re/EF的增加量显著高于GG型(P<0.05),而rs1123110位点不同基因型变化量之间没有显著差异(P>0.05,表3)。
2.2.4 与心动周期的关联性
rs1123110、rs4145237位点各基因型在不同状态下T初始值之间没有显著差异(P>0.05);经18周耐力训练后,不同基因型变化量之间也没有显著差异(P>0.05,表4)。
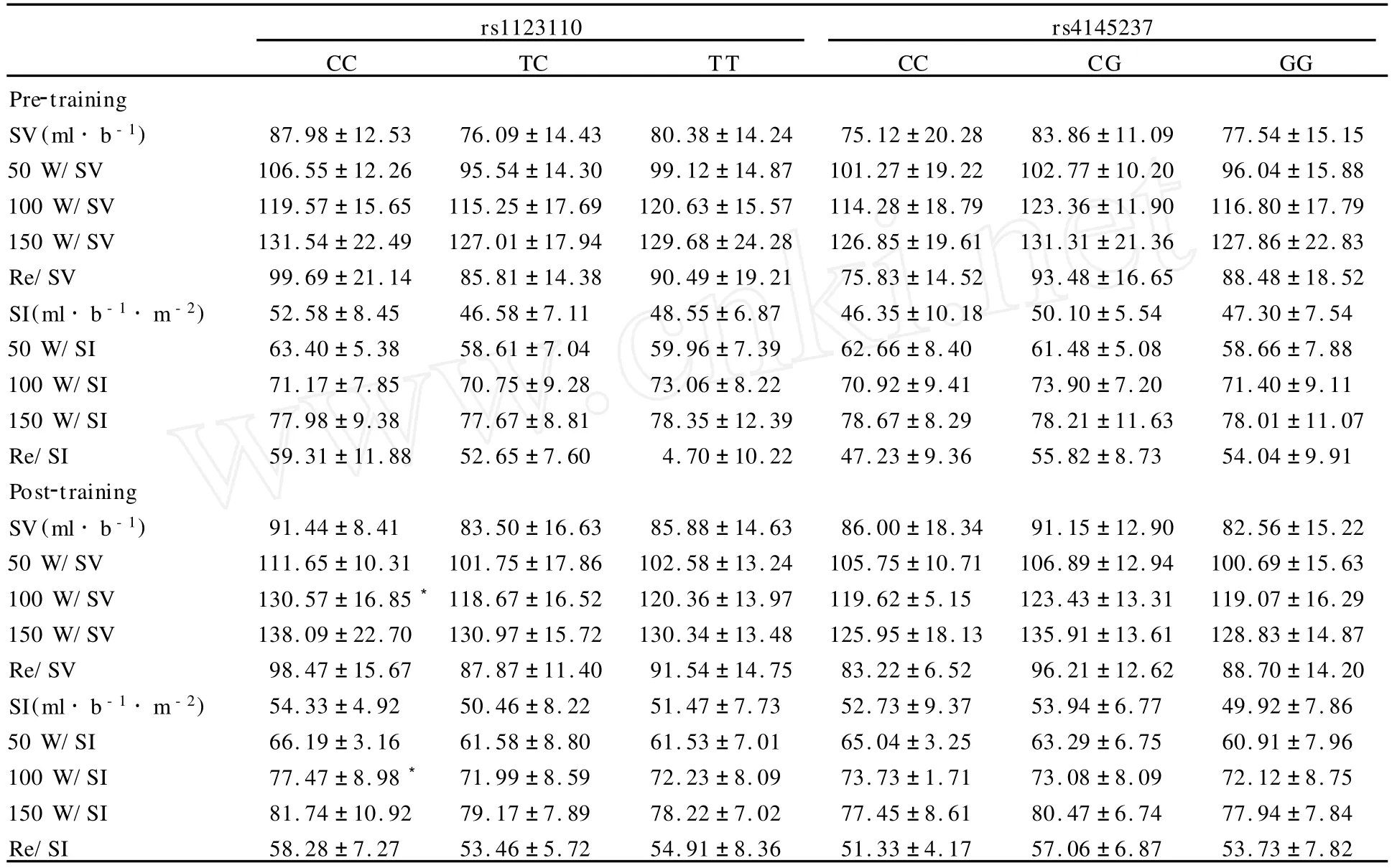
表1 FPN1基因多态性与每搏量的关联分析一览表Table 1 The association analysis of SVand FPN1 genotypes

表2 FPN1基因多态性与心输出量的关联分析一览表Table 2 The association analysis of CO and FPN1 genotypes

续表2

表3 FPN1基因多态性与射血分数的关联分析一览表Table 3 The association analysis of EFand FPN1 genotypes

表4 FPN1基因多态性与心动周期的关联分析一览表Table 4 The association analysis of T and FPN1 genotypes
3 讨论
运动时心肌耗氧量增加,达安静时的5倍左右,从而引起心肌细胞对铁的需要量大幅增加。铁是心肌细胞必需的微量元素,心肌细胞内铁的异常可直接影响心脏正常的生理功能。有研究表明,铁缺乏大鼠心脏线粒体NADH细胞色素还原酶、琥珀酸细胞色素还原酶、琥珀酸脱氢酶和NADH铁氰化物氧化还原酶活性显著降低,严重影响其生存能力[11]。另外,缺铁可影响大鼠骨骼肌和心肌的工作能力,并使骨骼肌和心肌线粒体铁硫蛋白(Fe-S)下降[17],从而影响心肌的能量代谢过程。铁缺乏也会影响人的运动和工作能力[7]。FPN 1在小肠和肝脏表达外,骨髓、脾红髓内的网状内皮巨噬细胞[15]、心脏等大部分组织内也有表达[14]。运动或膳食引起的缺铁均使FPN 1基因表达发生改变。细胞内铁缺乏导致FPN 1在十二指肠表达升高,在肝脏表达降低[10]。适度运动使大鼠十二指肠FPN 1的表达提高,可能通过HEPC来调节十二指肠FPN 1的表达增强[5]。而游泳训练大鼠体内血清铁及Hb含量和转铁蛋白饱和度增加,腓肠肌细胞膜上TfR和DM T1(IRE)的表达增加,FPN 1表达降低。认为游泳训练可以增加腓肠肌非血红素铁含量,促进机体铁动员,可能与腓肠肌细胞膜上向胞内转运铁的TfR和DM T1(IRE)蛋白表达增加,而向胞外转运铁的FPN 1表达下降有关[6]。采用不同浓度低铁(DFO)处理大鼠心肌细胞,发现心肌细胞FPN 1表达量下降,FPN 1的表达呈剂量依赖性。低铁(DFO)、高铁(FeSO、FAC)可引起大鼠心肌细胞搏动频率减慢,并且,随浓度升高,心肌细胞收缩幅度逐渐降低,收缩力明显减弱,呈浓度依赖性[8]。说明了心肌细胞铁状态与FPN 1的表达量的关系以及对心脏正常生理功能产生的重要影响。
本研究表明,rs1123110多态性与100W/SV、100W/ SV I、CO和CO I的训练效果关联。经过18周的耐力训练后,不同基因型之间100 W/SV和100 W/SV I的变化量有显著差异,CC型的100 W/SV和100 W/SV I的增加量显著高于TT型。SV是评价心脏泵血功能的重要指标,说明训练后CC型在完成等同负荷运动时心肌收缩力量显著高于TT型。另外,18周的耐力训练后,不同基因型安静时CO和COI的变化量也有显著差异,CC型的下降量显著大于TT和TC型。CO是每分钟心室射入主动脉的血量,反映循环系统功能的重要指标。由于训练后不同基因型之间的安静时SV的变化量没有差异,因此,训练后CC型CO和COI的减少与心率下降、心力储备增加有关。
本研究表明,rs414523多态性与训练前安静时CO和Re/EF的训练效果关联。CG型训练前安静时CO显著高于GG型,而安静时初始SV虽高于GG型,但没有显著差异。训练后CG型恢复期EF的增加量也显著高于GG型。说明GG型心室功能指标初始值高、训练效果显著,训练后心室舒张末期容积和心肌收缩力显著增加。
本研究通过关联分析后发现,FPN 1基因rs1123110和rs4145237多态性与18周耐力训练后的部分左心室功能指标的训练效果关联,其原因可能是这两个位点均位于内含子区,其多态性与FPN 1基因表达调控能力有关[9],进而影响蛋白质的功能。另外,可能与有功能的多态位点连锁不平衡[12],但具体的关联机制需要进一步探讨。
4 小结
1.rs1123110多态性与100W/SV、100W/SV I和安静时CO和COI的训练效果关联,CC型群体的变化量显著大于其他基因型群体。
2.rs4145237多态性与初始CO和Re/EF的训练效果关联,CG型群体的初始值和变化量显著大于其他基因型群体。
因此,FPN 1基因rs1123110的CC型和rs4145237的CG型可能区分18周耐力训练后左心室功能训练效果的个体差异。
[1]何子红,胡扬.运动能力相关基因标记的研究策略及方法[J].中国运动医学杂志,2006,25(1):684-691.
[2]胡扬.体育科研中的基因多态性战略[J].中国运动医学杂志, 2005,24(5):619-622.
[3]刘玉倩,常彦忠,王海涛,等.不同强度游泳运动对大鼠贮存铁及十二指肠铁吸收相关蛋白表达的影响[J].中国运动医学杂志, 2006,25(4):411-415.
[4]刘玉倩,常彦忠,钱忠明,等.不同强度游泳运动对大鼠不同组织铁分布及血清铁状态的影响[J].解剖学报,2005,36(5):519-522.
[5]刘玉倩,常彦忠,王海涛,等.不同强度运动对大鼠十二指肠DM T1、FP1蛋白和肝HEPC mRNA表达的影响[J].体育科学,2006,26(9):68-71.
[6]刘玉倩,常彦忠,钱忠明,等.游泳训练对大鼠腓肠肌铁代谢相关蛋白表达的影响[J].中国运动医学杂志,2005,24(2):147-151.
[7]钱忠明.铁代谢—基础与临床[M].北京:科学出版社,2000: 185-187.
[8]王娜.低铁、高铁对原代培养的大鼠心肌细胞铁转运相关蛋白表达的影响[EB/OL].中国期刊网—中国优秀博硕士论文全文数据库.
[9]徐晋麟,徐沁,陈淳.现代遗传学原理[M].北京:科学出版社, 2007:193-195.
[10]ABBOUD S,HA ILE D J.A novel mammalian iron-regulated p rotein involved in intracellular iron metabolism[J].J Biol Chem,2000,275(26):19906-19912.
[11]BLAYNEY L,BA ILEY-WOOD R,JACOBS A,et al.The effects of iron deficiency on the respiratory function and cytochrome content of rat heart mitochondria[J].Cire Res,1976, 39(5):744-748.
[12]BROOKESA J.The essence of SNPs[J].Gene,1999,234(2): 177-186.
[13]CANONNE-HERGAUX F,DONOVAN A,DELABY C,et al. Comparative studies of duodenal and macrophage ferroportin p roteins[J].Am J Physiol Gastrointest Liver Physiol[J].2006, 290(1):156-163.
[14]DONOVAN A,BROWNL IE A,ZHOU Y,et al.Positional cloning of zebrafish ferroportin1 identifies a conserved vertebrate iron exporter[J].Nature,2000,403:776-781.
[15]GALL IA,BERGAMASCHIG,RECALDE H,et al.Ferroportin gene silencing induces iron retention and enhances ferritin synthesis in human macrophages[J].Br J Haematol,2004,127 (5):598-603.
[16]MON TGOM ERY H E,CARKSON P,DOLLERY C M,et al. Association of angiotensin converting enzymegene I/D polymorphism with change in left ventricular mass in response to physical training[J].Circulation,1997,96:741-747.
[17]OH IRA Y,GILL SL.Effectsof dietary iron deficiency on muscle fiber characteristics and w hole-body distribution of hemoglobin in mice[J].J Nut,1983,113:1811-1818.
[18]RANKINEN T,BRA YM S,HAGBERGJM,et al.The human gene map for performance and healthrelated fitness phenotypes:The 2005 Update[J].Med Sci Sport Exe,2006,38(11): 1863-1888.
[19]RIVARD S R,LANZARA C,GRIMARD D,et al.Autosomal dominant reticuloendothelial iron overload(HFE type 4)due to a new missense mutation in the FERROPORTIN 1 gene (SLC11A 3)in a large French-Canadian family[J].Baematologica J Hematology,2003,88:824-826.
[20]SCH IMANSKIL M,DRA KESM ITH H,AL ISON T M ERRYWEA THER-CLARKE,et al.In vitro functional analysis of human ferroportin(FPN)and hemochromatosis-associated FPN mutations[J].Blood,2005,105:4096-4102.
[21]ZOLLER H,KOCH R O,THEURL L,et al.Exp ression of the duodenal iron transporters divalent-metal transporter 1 and ferroportin1 in iron deficieney and iron overload[J].Gastroenterology,2001,120:1412-1419.
Selecting the Genetic Markers for Response to Left Ventricular Functions for Aerobic Endurance Train ing from FPN1 Genetic Screen
WU YUN Gerile1,HU Yang2,L I Yan-chun2,N IE Jing3,XI Yi4,WEN Li5
Objective:To study the association between polymo rphism in FPN 1 gene and response to left ventricular functional parameters after aerobic endurance training,in order to screen genetic markers of aerobic endurance training and p rovide evidence to genetic individual p rogram.Methods:102 health males were comp leted 18-weeks aerobic endurance training. Echocardiography was used to measured parameters of left ventricular functions on resting state befo re and after training,and incremental exercise.The genotypes were examined in SNP rs1123110,rs4145237 by PCR-RFLP and association between gene polymorphism and parameters of left ventricular function were adop ted association studies w ith training response phenotypes.The increment of 100W/SV and 100W/SV Iw ith CC genotype in rs1123110 were significantly higher than TT genotype,and decrease in the amount of CO and COIwere significantly higher than TT and TC genotype.Result:The rs1123110 and rs4145237 polymorphism of FPN 1 gene can be used as genetic markers of the response to left ventricular function to aerobic training.
FPN1;geneticpolymorphism;training;leftventricularfunction;geneticmarker
G804.7
A
1000-677X(2010)10-0041-05
2010-06-02;
2010-07-05
科技部奥运攻关课题(2006BAK12B01)。
乌云格日勒(1963-),女,蒙古族,内蒙古人,副教授,博士,研究方向为运动分子生物学,E-mail:wy_grl@163com。
1.内蒙古师范大学,内蒙古呼和浩特010022;2.北京体育大学,北京100084;3.江西师范大学,江西南昌330027;4.深圳大学,广东深圳518060;5.天津体育学院,天津300381 1.Inner Mongolia Normal University,Huhhot 010022,China;2.Beijing Sport University,Beijing 100084,China; 3.Jiang Xi Normal University,Nanchang 330027,China; 4.Shenzhen University,Shenzhen 518060,China;5.Tianjing University of Sport,Tianjing 300381,China.

