密苏里游动放线菌葡萄糖异构酶基因xylA的克隆及其表达条件的优化
王 贺,杨瑞金,华 霄,钱婷婷,张文斌,蒋孝燕
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学食品学院,江苏 无锡 214122)
密苏里游动放线菌葡萄糖异构酶基因xylA的克隆及其表达条件的优化
王 贺1,2,杨瑞金2,*,华 霄2,钱婷婷1,张文斌2,蒋孝燕2
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学食品学院,江苏 无锡 214122)
为克隆、表达密苏里游动放线菌葡萄糖异构酶(GI)基因xylA,并对其诱导表达条件进行初步优化。采用Slowdown PCR方法克隆得到密苏里游动放线菌(Actinoplanes missouriensis)CICIM B0118(A)的葡萄糖异构酶基因xylA,构建pET-28a(+)-xylA表达载体,并转化至E. coli BL21 (DE3),经异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达,并对其表达产物进行SDS-PAGE电泳。结果表明,融合蛋白分子质量约为45kD。在诱导时间9h、0.6mmol/L IPTG、30℃和OD600nm值为0.8的最适培养条件下,酶比活力最高达到62.42U/mL。
密苏里游动放线菌;葡萄糖异构酶;表达;Slowdown PCR
Abstract:The xylA gene encoded glucose isomerase (GI) was amplified from genomic DNA of A. missouriensis CICIM B0118(A) by Slowdown PCR and subcloned into the expression vector pET-28a(+) to obtain an N-terminus His-tagged fusion expression plasmid pET-28a(+)-xylA. pET-28a(+)-xylA was then transformed into E. coli BL21 (DE3). The recombinant protein was actively expressed in E. coli BL21 (DE3) in the presence of isopropy-β-D-thiogalactoside (IPTG). SDS-PAGE analysis showed that the partially purified recombinant protein exhibited a major band with an apparent molecular weight of 45 kD in, which was consistent with the molecular weight calculated from the amino acid sequence. When the induction conditions were time 9h,IPTG 0.6mmol/L, temperature 30℃ and OD600nm 0.8, the enzyme activity of recombinant GI were 62.42 U/mL. These results can offer an experimental basis for the further investigation of directed evolution of GI into an artificial enzyme with the ability to isomerize lactose into lactulose.
Key words:Actinoplanes missouriensis;glucose isomerase;expression;slowdown PCR
葡萄糖异构酶(glucose isomerase,GI)又称木糖异构酶,可异构化D-葡萄糖、D-木糖等醛糖为相应的D-果糖、D-木酮糖等酮糖,是目前工业上生产果葡糖浆(HFCS)和发酵生产乙醇的关键酶[1]。产葡萄糖异构酶的工业菌株主要有玫瑰暗黄链霉菌(Streptomyces roseofulvus)、密苏里游动放线菌(Actinoplanes missouriensis)[2]和链霉菌M1033(Streptomyces diastaticus M1033)[3]等。
密苏里游动放线菌(A. missouriensis)是一种中温菌,所产的葡萄糖异构酶位于细胞质中,属于木糖异构酶家族Ⅰ。近20年来,已有不同学者先后开展对其作用机理的研究[4-6],截至目前关于该葡萄糖异构酶的催化部位、金属离子结合位点及其底物结合位点都已阐述清楚。
本研究组试图通过定向进化改造葡萄糖异构酶,以期直接将异构乳糖中的葡萄糖单元转化为果糖,从而一步制得乳果糖。乳果糖(β-D-Gal-(1→4)-β-D-Fru)具有调节肠道菌群、提高免疫力、改善新陈代谢等独特生理功能,是一种药食两用的功能性低聚糖。由于现有乳果糖规模化生产所采用的化学异构法[7]给乳果糖产品带来了安全性风险,因此生物酶法已成为生产乳果糖的发展方向。目前该领域研究正处于起步阶段,韩国Deok-Kun Oh研究组报道了一系列利用β-半乳糖甘酶合成乳果糖的工作[8],实验室中得到乳果糖产量约为50g/L。
本实验以A. missouriensis CICIM B0118(A)为出发菌株克隆xylA基因,目前尚未见该基因片段在酿酒酵母(Saccharomyces cerevisiae)中成功表达的先例,Amore等[9]曾尝试把源于A. missouriensis的xylA克隆至S. cerevisiae中进行表达,尽管能够检测到编码葡萄糖异构酶的mRNA,但却测不到葡萄糖异构酶的活力。而且国内外鲜见报道该酶基因在大肠杆菌中的表达。鉴于此,本研究选取pET-28a作为表达载体,进行对A. missouriensis CICIM B0118(A)葡萄糖异构酶基因xylA在E. coli BL21(DE3)中的表达,并对其诱导表达条件进行研究,旨在为下一步利用和改造该酶提供参考。
1 材料与方法
1.1 材料与试剂
限制性内切酶NdeⅠ和HindⅢ、T4 DNA连接酶、DNA Ladder Marker、LA-Taq聚合酶、异丙基-β-D-硫代半乳糖苷(IPTG)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal) 大连宝生物公司;酵母提取物、胰蛋白胨、质粒抽提试剂盒和低熔点琼脂糖 上海生物工程技术服务有限公司;胶回收试剂盒 北京索来宝科技有限公司;细菌基因组提取试剂盒 天根生化科技(北京)有限公司;核酸染料(Gelgreen) 上海开放科技发展有限公司;低分子质量标准蛋白 上海晶天生物科技有限公司;其他试剂均为国产分析纯。
1.2 菌株和质粒
A. missouriensis CICIM B0118(A)由中国高校工业微生物资源数据平台提供;E. coli DH5α、E. coli BL21(DE3)和表达载体pET-28a(+)均由江南大学食品生物技术研究中心保藏;克隆载体pMD18-T购自大连宝生物公司。
1.3 培养基
LB液体培养基和LB固体培养基配方见文献[10],大肠杆菌重组子在含50μg/mL卡那霉素的LB培养基中培养。
1.4 方法
1.4.1 基因组DNA的提取
采用天根细菌基因组提取试剂盒提取A. missouriensis CICIM B0118(A)基因组的DNA。
1.4.2 引物设计
按照已公布的A. missouriensis葡萄糖异构酶基因序列[11]设计引物,委托上海博尚生物技术有限公司合成。考虑到大肠杆菌对密码子的偏好,在设计引物时将原起始密码子GTG改为ATG。
上游引物:AATTCCATATG TCTGTCCAG GCCACACGCGAAGACAAG,下划线部分为NdeⅠ酶切位点;
下游引物:CCCAAGCTT CAGCGGGCTCCGAG CAGGTGCTC,下划线部分为HindⅢ酶切位点。
1.4.3 葡萄糖异构酶基因的克隆
以抽提的A. missouriensis CICIM B0118(A)基因组DNA作为PCR扩增模板,加入合成引物扩增目的基因xylA。采用Slowdown PCR[12],用适合扩增高碱基对GC含量模板的LA-Taq聚合酶对目的片段进行扩增。PCR反应体系(20μL):2×GC bufferⅠ10μL,模板DNA 2μL,浓度为20μmol/L的上游引物和下游引物各0.4μL,2.5mmol/L dNTP Mixtures 3.2μL,LA-Taq聚合酶0.2μL,超纯水补至总体积为20μL,混匀。反应条件:95℃预变性5min,95℃变性1min;72~62℃退火1.5min,72℃延伸1.5min,每3个循环退火温度降低1℃,共循环30次;95℃变性1min,62℃退火1.5min,72℃延伸1.5min,循环15次;最后72℃再循环10min。
1.4.4 克隆载体的构建、鉴定及序列分析
采用胶回收试剂盒对Slowdown PCR产物进行纯化,得到A. missouriensis CICIM B0118(A)葡萄糖异构酶基因xylA。将回收的目的片段用NdeⅠ和HindⅢ双酶切并纯化,然后以适当比例与用同样限制性内切酶酶切并纯化的pMD18-T载体混合(具体方法按pMD18-T载体试剂盒说明书进行)构建重组克隆质粒pMD18-T-xylA。然后将重组质粒转化E. coli DH5α,筛选阳性克隆子,进行序列测定。
1.4.5 重组大肠杆菌pET-28a(+)-xylA表达载体的构建
将测序正确的xylA片段和pET-28a(+)质粒分别用NdeⅠ和HindⅢ进行双酶切,酶切产物用琼脂糖凝胶回收试剂盒纯化回收,16℃过夜,连接目的片段和质粒片段,然后将连接产物转化E. coli BL21(DE3)感受态细胞,得到重组E. coli BL21(DE3)/pET-28a(+)-xylA。
1.4.6 诱导表达及表达产物SDS-PAGE检测
将经鉴定后的阳性重组质粒转入表达宿主E. coli BL21(DE3)菌株,同时以空白质粒pET-28a(+)转入相同宿主作为对照,挑取单菌落到含50μg/mL卡那霉素的LB培养基,在37℃摇床中进行振荡培养至对数期,以体积分数1%接种量转接于新鲜的50mL含有50μg/mL卡那霉素的LB培养基的250mL三角瓶中,置于30℃摇床,200r/min振荡培养,培养至OD600nm约为0.8时,加入IPTG至终浓度为0.6mmol/L,6~8h后停止培养。取一定体积菌液,4℃、10000r/min离心10min,沉淀用去离子水洗涤两次,然后重悬于磷酸盐缓冲液后,冰浴中超声破壁。4℃、10000r/min离心10min,弃沉淀,上清液继续在70℃水浴下热处理20min以除去其他大部分杂蛋白,之后4℃、10000r/min离心10min,所得上清即为粗酶液。取上述诱导表达的粗酶液,进行SDS-PAGE电泳[13],分析重组蛋白的表达情况。
1.4.7 葡萄糖异构酶活力的测定
标准酶反应体系组成为:2.5mL 3.0mol/L葡萄糖溶液、0.5mL 0.03mol/L硫酸镁、0.5mL 0.003mol/L硫酸钴、1.5mL粗酶液(0.3mol/L pH7.0磷酸氢二钠-磷酸二氢钠),70℃反应1h,取反应液按一定倍数稀释。果糖含量的测定参照半胱氨酸-盐酸盐-咔唑法[14]。在标准反应混合物中,酶活力单位(U)定义为1h内催化产生1mg果糖所需的酶量。蛋白质量浓度测定:以牛血清白蛋白(BSA)为标准,采用Bradford法测定[15]。
1.4.8 重组葡萄糖异构酶E. coli BL21(DE3)/pET-28a(+)-xylA表达条件的优化
1.4.8.1 诱导剂IPTG浓度
将重组转化子接种于10mL含50μg/mL卡那霉素的LB培养基中,37℃摇床振荡培养过夜,然后按体积分数1%接种量转接于6个含50mL LB液体培养基的250mL三角瓶中,37℃、200r/min继续培养至OD600nm约为0.8时,加入IPTG至终浓度分别为0.2、0.4、0.6、0.8、1.0、1.2mmol/L,继续培养12h,每个重复3次。取样测酶比活力。
1.4.8.2 诱导菌体起始浓度(OD600nm)
将重组转化子接种于10mL含50μg/mL卡那霉素的LB培养基中,37℃摇床振荡培养过夜,然后按体积分数1%接种量转接于6个含50mL LB液体培养基的250mL三角瓶中,37℃、200r/min继续培养至OD600nm分别为0.2、0.4、0.6、0.8、1.0、1.2时,加入IPTG至终浓度为0.6mmol/L,继续培养12h,每个重复3次。取样测酶比活力。
1.4.8.3 诱导温度
将重组转化子接种于10mL含50μg/mL卡那霉素的LB培养基中,37℃摇床振荡培养过夜,然后按体积分数1%接种量转接于4个含50mL LB液体培养基的250mL三角瓶中,分别在25、30、34、37℃条件下200r/min继续培养至OD600nm约为0.8时,加入IPTG至终浓度为0.6mmol/L,共培养20h,每个重复3次。取样测酶比活力。
1.4.8.4 诱导时间
将重组转化子接种于10mL含50μg/mL卡那霉素的LB培养基中,37℃摇床振荡培养过夜,然后按体积分数1%接种量转接于5个含50mL LB液体培养基的250mL三角瓶中,30℃、200r/min继续培养至OD600nm约为0.8时,加入IPTG至终浓度为0.6mmol/L,分别诱导3、6、9、12、16h。取样测酶比活力。
2 结果与分析
2.1 葡萄糖异构酶基因xylA扩增结果
应用Slowdown PCR方法克隆了编码葡萄糖异构酶基因xylA,所用的聚合酶为LA-Taq酶,此酶专用于扩增高GC含量的模板,它附带的两种GC Buffer有利于模板解链和引物的结合,电泳结果显示,在1000~1500bp之间出现一条亮带(条带2和3),与目标条带大小吻合,见图1。相比之下,其他普通DNA聚合酶则很难扩增得到目的片段。Slowdown PCR的优点在于:降低PCR循环过程中的升温和降温速率,尤其是降温速率低至1.5℃/s,目的是让引物和模板充分退火结合,这一点是常规PCR、Touchdown PCR和梯度PCR所没有的。
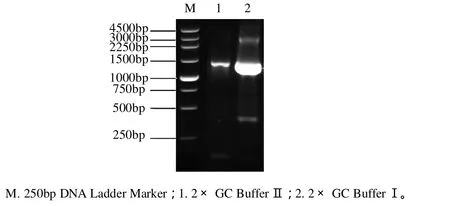
图1 Slowdown PCR产物琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of the slowdown PCR product of the xylA gene from A. missouriensis CICIM B0118
2.2 目的片段xylA的克隆与测序
将胶回收的目的片段与pMD18-T载体连接,构建克隆载体pMD18-T-xylA,并转化至E. coli DH5α受体菌,涂布于含Amp、IPTG、X-gal的LB琼脂平板上,37℃培养过夜后,随机挑取白色菌落提取质粒进行测序(结果未列出)。将该序列提交ExPASy网站服务器(www.expasy.ch),应用Protparam软件对蛋白质一级结构的一些理化性质进行了分析。该基因长度为1185bp,GC含量为67.9%,密码子第三位上的碱基约94%都是G和C,编码394个氨基酸,理论相对分子质量为43498.8,理论等电点为5.12。该基因序列已被Genebank收录,登录号为FJ858194。与GeneBank中已公布的两个(登录号分别为X16042和A10241)源于A. missouriensis编码的葡萄糖异构酶基因具有较高的同源性,分别达到99.92%和99.75%,同X16042仅在834位的碱基发生改变,由C突变为T,但氨基酸仍未改变,属于同义突变。FJ858194比A10241序列多一个终止密码子TGA,其余序列则完全相同。
2.3 表达载体的构建
将2.2节中扩增的xylA基因片段及载体pET-28a(+)分别用NdeⅠ和HindⅢ双酶切,酶切产物纯化后进行连接,构建表达载体pET-28a(+)-xylA,结构示意图见图2。
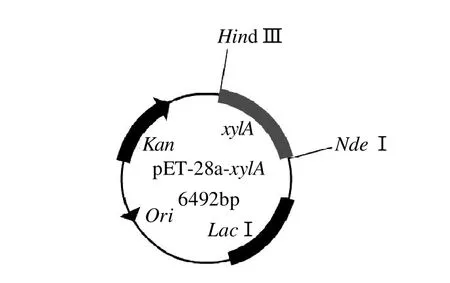
图2 重组质粒pET-28a(+)-xylA构建示意图Fig.2 Construction map of recombinant plasmid pET-28a(+)-xylA
将构建好的表达载体转化至E. coli BL21(DE3)受体菌,37℃培养过夜,随机挑取6个转化子接种到含50μg/mL卡那霉素的LB培养基中,提取重组质粒,用限制性内切酶对重组质粒进行鉴定,pET-28a(+)-xylA能被NdeⅠ和HindⅢ双酶切获得一条长约1200bp的片段,见图3。初步证明目的基因xylA已成功同载体pET-28a(+)连接并转入到表达宿主菌E. coli BL21(DE3)中。
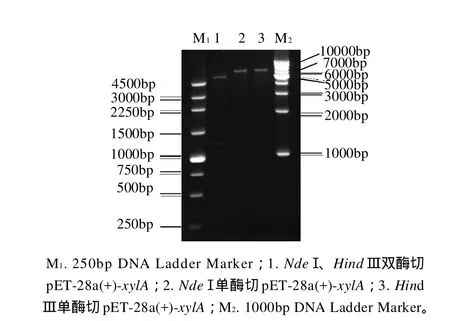
图3 重组质粒pET-28a(+)-xylA限制性酶切分析Fig.3 Double restriction enzyme digestion analysis of recombinant plasmid pET-28a(+)-xylA
2.4 SDS-PAGE检测
取诱导培养9h后的菌液离心,收集菌体,加上样缓冲液煮沸10min,进行SDS-PAGE电泳。与未插入目的基因的空载体pET-28a(+)相比,含有重组质粒pET-28a(+)-xylA的E. coli BL21(DE3)在43kD左右处有明显的蛋白表达条带,见图4。

图4 重组蛋白SDS-PAGE电泳分析Fig.4 SDS-PAGE analysis for the expression of pET-28a(+)-xylA in E. coli BL21(DE3)
2.5 E.coli BL21(DE3)/pET-28a(+)-xylA表达条件的优化
2.5.1 诱导剂IPTG最适浓度的确定
工程菌体在诱导过程中,物质能量代谢及生理生化状态都发生了很大的变化,xylA在大杆菌中的表达需要诱导剂IPTG,但其浓度过高反而会对菌体生长不利[16],因此获取合适的诱导剂量对xylA的表达很重要。为了研究最适的诱导浓度,选取了0.2~1.2mmol/L之间的IPTG,然后分别测葡萄糖异构酶比活力,结果见图5。
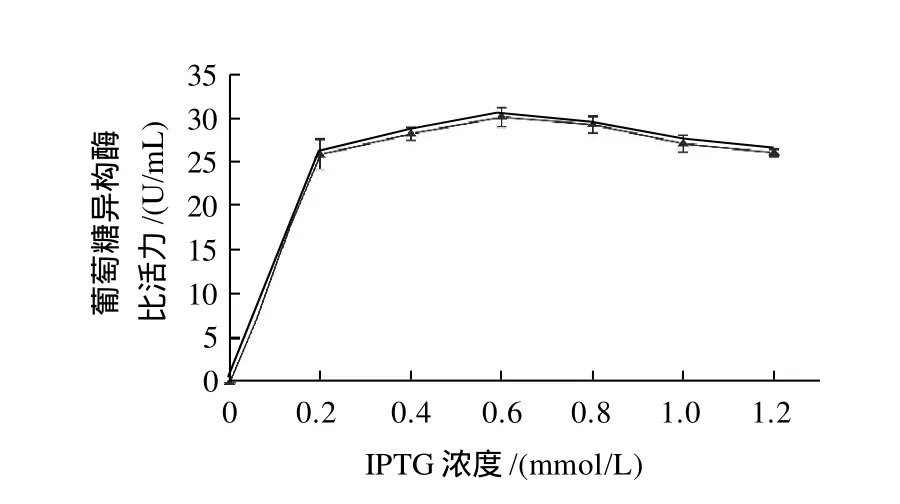
图5 IPTG浓度对葡萄糖异构酶比活力的影响Fig.5 Effect of IPTG concentration on GI activity
由图5可知,未加IPTG时,基本上测不到葡萄糖异构酶比活力,表明pET-28a(+)的T7lac表达系统十分严谨。当IPTG终浓度为0.6mmol/L时,葡萄糖异构酶比活力达到最高值,表明表达量最高。但随着IPTG浓度进一步增高时,酶比活力有所下降。
2.5.2 菌体外源基因诱导时机的确定
外源蛋白的表达将与宿主本身代谢所需要的前体和能量进行竞争,若诱导过早或过晚,由于菌体早期活力不足或晚期有害代谢产物的累积都会使外源蛋白的表达水平下降,因此,考察最佳的起始诱导时机对目的蛋白的表达非常关键。葡萄糖异构酶比活力与菌体浓度OD600nm之间的关系见图6。

图6 工程菌菌体浓度(OD600nm)对葡萄糖异构酶比活力的影响Fig.6 Effect of engineered strain density (OD600nm) on GI activity
由图6可知,随着菌体浓度的增加,酶比活力逐渐升高,当重组菌OD600nm约为0.8时,酶比活力达到最大值,这与Joo等[17]报道相一致。OD600nm再进一步增加时,酶比活力反而降低。
2.5.3 诱导温度对葡萄糖异构酶表达的影响
由于T7属于强启动子,往往会使外源蛋白过量表达,但易生成无活性的包涵体。将重组菌分别在25、30、34、37℃条件下进行诱导表达,20h取样测酶比活力,所得工程菌产酶比活力与温度的关系见图7。Knappik等[18]曾报道低温诱导条件下,蛋白质合成速率虽下降,但形成正确折叠构象的活性蛋白含量却在增加;而且Kosinski等[19]也指出低温诱导,由ATP介导的和非ATP-介导的蛋白酶解水平都会降低,这些原因促使低温诱导条件下外源蛋白产量增加。所以,本实验发现温度太高对葡萄糖异构酶的活性表达很不利,而在30℃条件下酶比活力却很高。
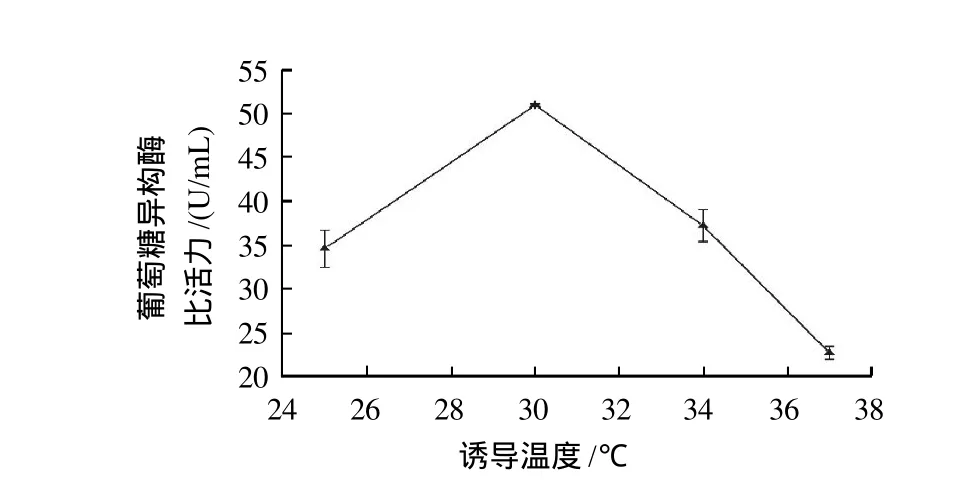
图7 诱导温度对葡萄糖异构酶比活力的影响Fig.7 Effect of induction temperature on GI activity
2.5.4 诱导时间对葡萄糖异构酶表达的影响

图8 诱导时间对葡萄糖异构酶比活力的影响Fig.8 Effect of length of induction time on GI activity
重组菌产生葡萄糖异构酶的量会随着诱导时间的延长而相应增加,当加入0.6mmol/L IPTG,诱导9h,酶比活力达到最高,为62.42U/mL,结果见图8。
由图8可知,随着诱导时间的进一步延长,酶比活力反而有所下降,这与培养后期发酵液pH值偏碱性有关。
3 讨 论
葡萄糖异构酶一直是研究的热点,曾有许多学者先后对来自大肠杆菌(E. coli)、高温产硫化氢梭状芽孢杆菌(Clostridium thermohydrosulfuricum)、节杆菌属(Arthrobacter)、紫红链霉菌(Streptomyces violaceoruber)、淀粉酶链霉菌(Streptomyces diastaticus)、赤色链霉菌(Streptomyces rubiginosus)、嗜热栖热菌(Thermus thermophilus)、海栖热袍菌(Thermotoga maritima)等菌的葡萄糖异构酶进行了研究,发现在大肠杆菌中成功表达的例子很多,而在酵母中成功表达的相对很少,国内鲍晓明等[20]曾将高温产硫化氢梭状芽孢杆菌(Clostridium thermohydrosulfuricum)和嗜热栖热菌(Thermus thermophilus)的木糖异构酶导入酿酒酵母中并得到活性表达。目前,国内外已开始由对葡萄糖异构酶的催化机理研究转移到对提高酶的耐热性、拓宽底物特异性、降低果葡糖浆反应pH值及发酵木糖生成乙醇上来。
产自A. missouriensis的葡萄糖异构酶具有活力比较高、最适pH值为7.0和pH值稳定范围为6~9等特点,这些都有利于生产果葡糖浆。更为重要的是现有的研究结果已清楚地表明该酶的活性部位、底物结合位点等关键信息,并有学者通过对底物结合位点附近的氨基酸残基进行定点突变,提高了突变体酶对L-核糖的反应速率。这些相关信息促使本课题组选择了A. missouriensis作为改造葡萄糖异构酶的出发菌株。
鉴于Amore等[9]、鲍晓明等[20]的实验结果,本研究选取大肠杆菌作为表达宿主菌。来源于A. missouriensis CICIM B0118(A)的葡萄糖异构酶基因xylA,其片段中GC含量达70%,扩增如此高GC含量的目的片段一直是PCR扩增中的一个难题,解决此问题的常用办法是加入增强剂如DMSO、甲酰胺、甘油、甜菜碱等,但本研究发现效果并不理想。采用Slowdown PCR方法并使用合适的LA-Taq酶(含两种GC buffer),成功克隆得到了A. missouriensis CICIM B0118(A)葡萄糖异构酶基因xylA,并实现了其在E. coli BL21(DE3)中的高效表达。
外源蛋白在大肠杆菌中的成功表达不仅需要加入诱导剂IPTG,而且优化产酶条件也很重要。通过对工程菌诱导表达的主要产酶影响因素:IPTG浓度、诱导起始菌体浓度(OD600nm)、诱导温度、诱导时间等优化研究,得到最适培养条件为:0.6mmol/L IPTG、OD600nm值为0.8、30℃和诱导时间9h。其中诱导温度对酶比活力影响很大,结果表明,30℃是非常适宜的诱导温度。在上述最适条件下,发酵液酶比活力达到62.42U/mL,较野生型提高了12倍。
[1] BHOSALE S H, RAO M B, DESHPANDE V V. Molecular and industrial aspects of glucose isomerase[J]. Microbiological Reviews, 1996, 60(2): 280-300.
[2] 邬显章. 酶的工业生产技术[M]. 长春: 吉林科学技术出版社, 1988:472-475.
[3] 王玉珍, 黄震, 戴新华, 等. 7号淀粉酶链霉菌M1033木糖异构酶基因序列分析[J]. 生物工程学报, 1994, 10(2): 118-123.
[4] REY F, JENKINS J, JANIN J, et al. Structural analysis of the 2.8 A model of xylose isomerase from Actinoplanes missouriensis[J]. Proteins,1988, 4(3): 165-172.
[5] JENKINS J, JANIN J, REY F, et al. Protein engineering of xylose(glucose) isomerase from Actinoplanes missouriensis. 1. crystallography and site-directed mutagenesis of metal binding sites[J]. Biochemistry,1992, 31(24): 5449-5458.
[6] LAMBEIR A M, LAUWEREYS M, STANSSENS P, et al. Protein engineering of xylose (glucose) isomerase from Actinoplanes missouriensis. 2. site-directed mutagenesis of the xylose binding site[J].Biochemistry, 1992, 31(24): 5459-5466.
[7] AIDER M, HALLEUX D. Isomerization of lactose and lactulose production: review[J]. Trends Food Sci Tech, 2007, 18(7): 356-364.
[8] KIM Y S, PARK C S, OH D K. Lactulose production from lactose and fructose by a thermostable β-galactosidase from Sulfolobus solfataricus[J]. Enzyme Microb Tech, 2006, 39(4): 903-908.
[9] AMORE R, WILHELM M, HOLLENBERG C P. The fermentation of xylose: An analysis of the expression of Bacillus and Actinoplanes xylose isomerase genes in yeast[J]. Appl Microbiol Biot, 1989, 30(4):351-357.
[10] 萨姆布鲁克J, 拉塞尔D W. 分子克隆实验指南[M]. 3版. 黄培堂,王嘉玺, 朱厚础, 等, 译. 北京: 科学出版社, 2002: 1595.
[11] AMORE R, HOLLENBERG C P. Xylose isomerase from Actinoplanes missouriensis: primary structure of the gene and the protein[J]. Nucleic Acids Res, 1989, 17(18): 7515.
[12] BACHMANN H S, SIFFERT W, FREY U H. Successful amplification of extremely GC-rich promoter regions using a novel ‘slowdown PCR’technique[J]. Pharmacogenetics, 2003, 13(12): 759-766.
[13] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[14] DISCHE Z, BORENFREUND E. A new spectrophotometric method for the detection and determination of keto sugars and trioses[J]. J Biol Chem, 1951, 192(2): 583-587.
[15] BRADFORD M M. A rapid and sensitive method for the quatitiation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72: 248-254.
[16] WENG Yiping, HSU F C, YANG W S, et al. Optimization of the overexpression of glutamate mutase S component under the control of T7 system by using lactose and IPTG as the inducers[J]. Enzyme Microb Tech, 2006, 38(3/4): 465-469.
[17] JOO G J, SHIN J H, HEO G Y, et al. Molecular cloning and expression of a thermostable xylose (glucose) isomerase gene, xylA, from Streptomyces chibaensis J-59[J]. J Microbiol, 2005, 43(1): 34-37.
[18] KNAPPIK A, KREBBER C, PLUCKTHUN A. The effect of folding catalysts on the in vivo folding process of different antibody fragments expressed in Escherichia coli[J]. Bio-technology, 1993, 11: 77-83.
[19] KOSINSKI M J, BAILEY J E. Temperature and induction effects on the degradation rate of an abnormal beta-galactosidase in Escherichia coli[J].J Biotechnol, 1991, 18: 55-68.
[20] 鲍晓明, 高东, 王祖农. 嗜热细菌木糖异构酶基因xylA 在酿酒酵母中的高效表达[J]. 微生物学报, 1999, 39(1): 49-54.
Cloning of Glucose Isomerase Gene from Actinoplanes missouriensis and Its Expression in Escherichia coli
WANG He1,2,YANG Rui-jin2,*,HUA Xiao2,QIAN Ting-ting1,ZHANG Wen-bin2,JIANG Xiao-yan2
(1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Q786
A
1002-6630(2010)15-0171-06
2009-12-28
国家“863”计划项目(2006AA10Z336);江南大学食品科学与技术国家重点实验室目标导向资助项目(SKLF-MB-200804);以乳糖异构化为目标的葡萄糖异构酶定向改造研究(SKLF-TS-200903);江南大学博士研究生科学研究基金项目
王贺(1983—),男,博士研究生,研究方向为食品酶的生物改性。E-mail:wanghe.0918@163.com
*通信作者:杨瑞金(1964—),男,教授,博士,研究方向为食品生物技术。E-mail:yrj@jiangnan.edu.cn

