高分子缓、控释材料的研究进展
梁良,胡小玲,西珊,钱立伟
(西北工业大学理学院应用化学系,陕西西安710129)
高分子缓、控释材料的研究进展
梁良,胡小玲,西珊,钱立伟
(西北工业大学理学院应用化学系,陕西西安710129)
高分子缓、控释材料因其原材料来源广泛、复合改性能力强、受环境影响因素多而成为调节药物释放载体材料的研究重点,极具发展前景。分类祥述了各种药用高分子缓释材料与控释材料以及它们的性能特点和应用,并简明介绍了药用高分子缓、控释材料的研究价值与动向。
高分子;缓释材料;控释材料
前言
近年来,为了提高药物使用效率,缩短治疗时间,减少频繁用药给病人带来的痛苦和不便,人们研究发明了药用高分子缓、控释材料,这些材料最大的特点在于:能较长时间维特体内有效的药物浓度,从而可以大大提高药效和降低毒副作用,使病人得到最佳治疗。其中高分子类药物缓、控释材料是这方面研究课题的热点[1],例如亲肤性聚氨酯作为医用胶黏剂,当遇到渗出的体液、血液等后,其高反应性异氰酸基迅速进行复杂的交联反应,可灵活地对伤口进行保护,是一种外用高分子控释材料[2]。
1 高分子缓释材料
药用高分子材料的研究之所以能成为目前国内外药剂领域的一个重要课题[3],主要是因为:传统药物刚被使用时释放浓度过高,容易引起毒副作用,并且随着人体新陈代谢而快速衰减导致药物利用率低。药物缓释就是将小分子药物与高分子载体以物理或化学方法结合,进入病灶区后通过扩散、溶出等方式,将小分子药物以接近零级速率即恒定速率的方式持续释放出来,以便长时间保持治疗所需的药物浓度,从而使药物功效得到充分发挥,如图1所示[4]。作为药物释放载体的高分子材料,在筛选时应当具备以下基本条件:无毒或低毒,良好的生物相容性和生物降解性等[5]。

图1 乳酸低聚物缓释材料的缓释作用图Fig.1 The sustained-release action of lactic acid oligomers
目前正在开发的生物降解型药用缓释高分子材料主要是天然高分子和合成高分子。天然高分子主要有多糖类(如壳聚糖及其共混物、环糊精及其衍生物等)、蛋白质类(如白蛋白、丝素蛋白等);合成高分子主要有聚乳酸、聚酸酐、多肽与氨基酸类聚合物等。
1.1 天然高分子
1.1.1 壳聚糖及其共混物
壳聚糖是甲壳素脱乙酰化产物,广泛存在于植物细胞壁和甲壳类动物及昆虫的甲壳中,其降解产物无毒,且能被生物体完全吸收[6]。但单纯的壳聚糖作为药用辅料效果不是非常理想。为获得综合性能优异的载体材料,可以将壳聚糖与其它材料通过交联、接枝以及共混的方式复合在一起使用。
常海涛[7]利用聚乙烯醇对人体无毒副作用,以及良好的生物降解性和生物相容性,将其与壳聚糖微球通过交联的方式制成复合载体,这样使载体的控释放性能更强,而且比单纯壳聚糖载体成本更低。另外,壳聚糖复合海藻酸微囊应用于多肽蛋白质的控释效果更佳,近年来已引起重视[8]。
1.1.2 环糊精及其衍生物
环糊精(Cyclodextrin,简称CD,)如图2[9]是直链淀粉在由芽孢杆菌产生的环糊精葡萄糖基转移酶作用下生成的一系列环状低聚糖的总称,通常含有6~12个D-吡喃葡萄糖单元。由于CD分子立体结构为环状中空圆筒,外部是亲水性的表面,内部则是一个具有一定尺寸的手性疏水管腔,因此CD是天然的“分子胶囊”,能将一定大小的疏水性药物分子包含在其环状空筒中,从而可以改变药物的溶出速率,达到缓释的效果。而对其衍生物的研究,则进一步拓宽了CD在药学领域的应用,能够制备出根据实际需要而具有相应缓释特点的载体[10]。
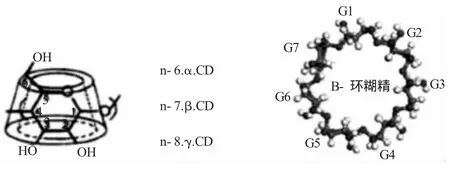
图2 环糊精结构图Fig.2 The structure of cyclodextrin
夏芸等[11]采用具有温敏性的β-环糊精衍生物包合吲哚美辛,以达到此药物在体温下能缓慢溶出的目的,目前研究已取得初步进展。王齐放等[12]以苯甲酸为模型药物,以疏水性乙酰基β-环糊精缓释材料作为载体,成功抑制了药物的升华,阻滞溶媒的浸入,延缓了药物的释放。
1.1.3 白蛋白
白蛋白(又称清蛋白)是一种球蛋白,由肝实质细胞合成。它在人体内最重要的作用是维持胶体渗透压。这种可以生物降解的天然高分子材料,在被制备成缓释微球载体后,除具备相当的缓释作用外,还拥有一定的靶向性,能针对性地将药物运载至病灶区释放。在治疗肿瘤、癌症方面作用明显。
陈锋等[13]以人血清白蛋白为主要原材料,丝裂霉素为药物模型,采用热固法,制备出了具有明显缓释特性的丝裂霉素白蛋白微球,这种微球可以减少药物在溶液中的游离,提高药物的包封率。
1.1.4 丝素蛋白
丝素蛋白是一种源于蚕丝的天然高分子材料。稳定、无毒、廉价易得,具有优异的生物降解性和生物相容性[14]。同时,丝素蛋白还具有良好的机械性能和理化性质,如柔韧性、透气透湿性、缓释性等,因而可以通过处理得到不同的形态,如纤维(如图3[15])、粉、膜以及凝胶等[16]。

图3 经水蒸气处理后的丝素蛋白纤维扫描电镜照片Fig.3 SEM image of silk fibroin fiber treated by steam
刘纯等[17]以丝素蛋白复合壳聚糖为载体材料,双氯芬酸钠为模型药物,采用乳化-化学交联固化法制备出了丝素蛋白-壳聚糖双氯芬酸钠微球,这种微球的持续释药时间可以达到200h,缓释效果比单一壳聚糖微球显著加强。
1.2 合成高分子
1.2.1 聚乳酸及其共聚物
聚乳酸也称为聚丙交酯,是由多个乳酸分子在一起脱水缩合而成。聚乳酸除具备优良的生物降解性和生物相容性外,还拥有很好的热稳定性与抗溶剂性,使得在制备成装载药物的缓释载体时,选择制备方法或方式的余地更大。另外,聚乳酸还具有一定的耐菌性、阻燃性和抗紫外性,增强了其制品的储存性能。
近年来,众多学者对于星型聚乳酸类生物降解材料的研究表现出浓厚的兴趣,分别以季戊四醇[18~22]、环三磷腈[23]、多糖等为核,制备出了多臂星型聚乳酸。例如,罗玉芬等[24]以廉价易得的D,L-乳酸和无毒的肌醇为原料,采用直接熔融聚合法合成了以肌醇为核的星形聚D,L-乳酸,对于降低缓释材料价格有积极的作用;无独有偶,赵海军等[25]以具有多个反应点的胆酸和D,L-乳酸为原料,采用相同方法制备出以胆酸为核的星形聚乳酸药物缓释材料,这种趋于成熟的制备方法有利于缓释材料的快速、大量生产,能进一步降低成本,具有理想的市场前景。
1.2.2 聚酸酐
聚酸酐是一类新型生物可降解高分子合成材料,分子中含有的酸酐键具有不稳定性,能水解成羧酸,具有生物降解特性[26]。分子结构为∶根据R基的不同,可将聚酸酐分为脂肪族聚酸酐、芳香族聚酸酐、杂环族聚酸酐、聚酰酸酐、聚酰胺酸酐等[27],它们均具有良好的表面溶蚀降解性、降解速度可调及易加工性等优异性能。例如,苯乙烯—马来酸酐共聚物[28]就是一种性能优良、价格低廉的新型高分子缓释材料,被用于制造缓释骨架片剂、微囊剂及贴布剂等。
但到目前为止,能应用于药物控释等领域的仅有:P(CPP—SA)、P(FA—SA)、P(FAD—SA)、P(RAM一SA)及P(CPH—SA)等少数几类聚酸酐[29],所以针对药用聚酸酐载体的研究还有待拓宽和深化。
1.2.3 多肽与氨基酸类聚合物
多肽通常是指一种或几种氨基酸或其衍生物通过聚合反应得到均聚物或共聚物。由于人工合成的多肽与蛋白质有着相类似的结构,因此能显示出良好的生物相容性,又因为多肽能在人体内降解生成无毒的小分子多肽或氨基酸,所以还具备优异的生物降解性[30]。不同组成的氨基酸类共聚物及多肽的降解性不同,因此应用于药剂载体时可调节聚合物配比来控制其降解性能,形成可调节的缓释系统。例如:Kiew[31]等以聚L-谷氨酸作为缓释载体,通过碳二亚胺反应,与抗癌药物吉西他滨相结合,不但使得药物释放时间明显延长,而且还增强了药物分子在血液中的稳定性,因此所合成的这种药物材料是一款极具前景的潜在抗癌药物前体。
此外,利用氨基酸改性的聚乳酸也是一种重要的药物缓释材料。近来有聚乳酸-丙氨酸共聚物成功应用于植入性药物甲钴胺缓释载体的报道[32]。
除了以上所列举的,还有像聚磷酸酯、聚膦腈等一大批合成高分子材料被不断地应用到药物缓释体系中,并取得了可喜的成效,使得研究药物高分子缓释载体材料的道路越走越宽。
2 高分子控释材料
高分子药用控释材料虽然与缓释材料在许多方面有着类似的定义和功能,但是缓释材料着重考虑药物释放速率,而控释材料则更加侧重对药物溶出的区域控制和时机控制,即控制药物的靶向释放和目的释放。
可用作药物控释材料的高分子材料有很多。在天然高分子材料方面有胶原、海藻酸钠以及淀粉与纤维素衍生物等,例如国外已开发了乳化性、成膜性及致密性良好的淀粉衍生物作为卡氮介微胶囊的壁材[33]。人工合成高分子材料方面主要有聚酯、聚醚、聚酰胺等。这类材料均具有良好的机械性能并且容易通过化学或物理修饰进行改造[34]。控释材料依据其物理化学性质及其释放机理的不同进行划分,可分为溶解型聚合物、非生物降解型聚合物和生物降解型聚合物[35]。
2.1 溶解型聚合物
溶解型聚合物主要用于口服药物控释材料,这些聚合物通常带有羟基、胺基和羧基等极性基团,由于在胃液、肠液、组织液以及血液中溶解性的不同,使药物能够在需要的器官或组织中释放出来,如图4[36]。这类材料主要包括聚乙烯醇、甲基丙烯酸酯和甲基丙烯酸共聚物等[35]。但是,此类材料与药物构成的释药体系容易受到体内复杂环境发生改变的影响(如十二指肠溃疡患者的十二指肠初肠液成分和pH值就已受到胃酸的强烈影响而发生变化),从而导致体系不够稳定。

图4 酸敏型控释材料-聚丙烯酸甲酯的控释过程图Fig.4 Acid-sensitive release materials-release process of PMA
2.2 非生物降解型聚合物
非生物降解型聚合物作为控释材料应具备优异的生物相容性和良好的加工性能,而其中的植入式材料还必须具有很强的物化稳定性,以保证能在体内的复杂环境下稳定存在。例如,聚丙烯酰胺类水凝胶即是一类符合上述条件的药物控释材料,这类水凝胶拥有亲水的酰胺基团和疏水的碳链,所以它可以对温度显示出非连续的变化,像聚N,N-二乙基丙烯酰胺就是这样一种温敏型水凝胶[37]。这类水凝胶还可以与其它材料复合,以丰富药物释放的控制手段,如Satarkar等使用聚N-异丙基丙烯酰胺水凝胶和超顺磁性的四氧化三铁粒子相结合,制备出纳米复合水凝胶控释材料,这种载体材料可以通过改变外部交变磁场的数量达到远程控制药物释放的目的。
然而,非生物降解型聚合物作为植入式药物载体时存在不可忽视的问题是:待药物溶出释放完后,载体材料会留在体内,必须人工将其取出。这势必会给病人带来不必要的麻烦和痛苦。
2.3 生物降解型聚合物
使用生物降解型聚合物作药物载体除能够提高用药稳定性和药物利用率之外,更重要的是当药物释放完毕后载体不必从体内取出,便可在体内降解并代谢排出体外。所以生物降解类聚合物已成为药物控释材料研究和开发的热门方向。生物降解型聚合物主要包括天然生成材料,人工合成材料,以及共混复合材料等。
海藻酸钠[39]是天然多糖类化合物,可生物降解,毒性低,生物相容性良好。由海藻酸钠得到的海藻酸盐凝胶如海藻酸钙凝胶具有pH依赖特性、可防止突释、口服无毒等特点,可作为酸敏感性药物的载体材料。
海藻酸钠和其他单体进行化学或物理方式的结合,可以改善海藻酸钠的部分性能,使共混单体的其他性能得以充分发挥。如海藻酸钠与β-环糊精[40]、壳聚糖[41]、丙烯酸、聚乙烯醇等单体接枝共聚或共混改性,可以制备出具有良好极性、酸敏性和温敏性的生物降解共聚物,为制备新型药物控释材料打开了新思路。
3 现状与趋势
尽管目前针对缓、控释药物的研制已得到相当的重视并取得了可喜的成果,但就药物缓、控释材料的改造还没有取得突破性的进展,未能完全达到高效,速控甚至智能化的要求,同时药物控释的靶向性还远不如人们设想得那么精准。而对于其中被重点研究的生物降解性缓、控材料,要真正在此类药物剂型的制备上取得重大突破,就必须清楚这些降解材料的结构性质、降解规律及降解产物对机体的影响。因此,针对高分子缓、控释材料的研究将会长期深入下去。
∶
[1]胡颖.药用高分子在缓控释制剂中的应用现状[J].实用医药,2008,25(7):861.
[2]蔡志江,成国祥.聚羟基丁酸酯在组织工程中的应用[J].功能高分子学报,2001,14(9):355~359.
[3]LEONG K W,BROTT B C and LANGER R.Bioero-dible polyanhydrides as drug carrier matrices I:Characterization degradationand release characteristics[J].Biomedical Materials Research,1985,19(8):941.
[4]TOMOMI TANIGO,RYOHEI TAKAOKA and YASUHIKO TABATA.Sustained release of water-insoluble simvastatin from biodegradable hydrogel augments bone regeneration[J].Journal of Controlled Release,2010,143(2):201~206.
[5]SINHA V R and TREHAN A.Biodegradable microspheres for protein delivery[J].Contolled Release,2003,90(3):261.
[6]王改娟,周志平,盛维琛.药物缓释用生物降解性高分子载体材料的研究[J].弹性体,2008,18(4):63~66.
[7]常海涛.壳聚糖/聚乙烯醇复合药物缓释微球制备工艺的研究[J].应用科技,2008,16(14):21~23.
[8]舒晓正,朱康杰.壳聚糖一海藻酸钠微囊对蛋白质控制释放的研究[J].功能高分子学报,1999,12(4):423~426.
[9]ZHANG YIMIN,YU SHANBAO and Bao FENG.Crystal structure of cyclomaltoheptaose(β-cyclodextrin)complexes with paminobenzoic acid and o-aminobenzoic acid[J].Carbohydrate Research,2008,343(14):2504~2508.
[10]尹婕,邓盛齐.环糊精及其衍生物在新型给药系统中的应用进展[J].国外医药抗生素,2006,27(5):228~231.
[11]夏芸,邱利焱,金一.温敏性吲哚美辛/β-环糊精包合物的制备及体外评价[J].药学学报,2005,40(2):187~192.
[12]王齐放,徐璐,王中彦.乙酰基β-环糊精包合物的制备及释药性能考察[J].沈阳药科大学学报,2006,10:617~620.
[13]陈锋,李春忠.抗癌丝裂霉素白蛋白微球的制备及体外释药性能[J].华东理工大学学报(自然科学版),2006,2:32.
[14]ALTMAN G H,DIAZ F and JAKUBA C,et al.Silk-basedbiomaterials[J].Biomaterials.2003;24(3):401~416.
[15]JEONG LIM,YEO IN-SU NG,KIM HA NA,et al.Plasma-treated silk fibroin nanofibers for skin regeneration[J].International Journal of Biological Macromolecules,2009,44(3):222~228.
[16]曹阳,王伯初,迟少萍,等.基于丝素蛋白的药物缓释材料[J].中国组织工程研究与临床康复.2009,13(8):1533~1536.
[17]刘纯,金梦瑶,张学农.双氯芬酸钠丝素蛋白-壳聚糖缓释微球的制备及体内外评价[J].中国新药杂志,2009,21.
[18]CAI Q,ZHAO YL,BEI J Z et al.Synthesis and Properties of Star-Shaped Polylactide Attached to Poly(Amidoamine)Dendrimer[J].Biomacromolecule,2003,4(3):828~834.
[19]WANG J L,DONG C M.Synthesis,Sequential Crystallization and Morphological Evolutionof Well-DefinedStar-ShapedPoly(εcaprolactone)-b-poly(L-lactide)Block Copolymer[J].Macromolecular Chemistry and Physics,2006,207(5):554~562.
[20]KNAGAHAMA,YOHYA,T OUCHI.Synthesis of Star-shaped 8 arms Poly(ethylene glycol)-Poly(L-lactide)Block Copolymer and Physicochemical Properties of Its Solution Cast Film as Soft Biomaterial[J].Polym.J.2006,38(8):852~860.
[21]马建华,鲍时根,朱玉俊.L-乳酸-季戊四醇星形聚合物的合成与表征[J].精细与专用化学品,2006,14(9):19~22.
[22]KARIKARI A S,WILLIAMS S R,HEISEY C L,et al.Porous Thin Films Based on Photo-Cross-Linked Star-Shaped Poly(D,L-lactide)s[J].Langmuir,2006,22(23):9687~9693.
[23]YUAN W Z,ZHU L,HUANG X B,et al.Synthesis,characterization and degradation of hexa-armed star-shaped poly(L-lactide)s and poly(D,L-lactide)s initiated with hydroxylterminated cyclotriphosphazene[J].Degrad.Stab.,2005,87(3):503~509.
[24]TAMAKI M,KITAJYO Y,IMAI T,et al.Polym[J].Prepr.,Japan,2005,54(1):485.
[24]罗玉芬,汪朝阳,毛郑州,等.D,L-乳酸-肌醇星形聚合物的合成与表征[J].精细化工,2008,25(9):872~875.
[25]赵海军,汪朝阳,侯晓娜,等.直接熔融聚合法制备以胆酸为核的星型聚(D,L-乳酸)药物缓释材料及其表征[J].化学通报,2007,10:787~792.
[26]陈先红,郑建华.生物降解高分子材料-聚酸酐的研究进展[J].高分子材料科学与工程,2003,3:31.
[27]UHRICH K E,CANNIZZARO S M,LANGER R.Polymeric systems for controlled drug release[J].Chem.Rev,1999,99:3181~3198.
[28]田华,陈志祥,张政委,等.苯乙烯一马来酸酐交替共聚物的合成及其在医药中的应用[J].新疆化工,2004,(2):2~5.
[29]周志彬,黄开勋,陈泽宪,等.生物可降解高分子材料-聚酸酐[J].北京生物医学工程,2001,20(1):76~79.
[30]章苏宁,陈涛,林嘉平,等.聚肽的结构性能及其在生物材料领域的应用[J].高分子通报,2004,03(19):19~20.
[31]KIEW LIK-VOON,CHEONG SOON-KENG,SIDIK KHALIFAH,et al.Improved plasma stability and sustained release profile of gemcitabine via polypeptide conjugation[J].International Journal of Pharmaceutics,2010,391(1-2):212~220.
[32]侯晓娜,汪朝阳,赵海军,等.药物缓释材料聚(乳酸-丙氨酸)的直接法合成与表征[J].化工新型材料,2007,35(11):32~34.
[33]鲍鲁生.食品工业中应用的微胶囊技术[J].食品科学,1999,20(9):6~8.
[34]张粉艳,郝红,梁国正.应用于药物控释系统中的生物降解高分子材料[J].离子交换与吸附,2003,l9(2):189~192.
[35]闫丽丽.高分子药用控释材料研究进展[J].上海生物医学工程,2000,2l(3):44~47.
[36]SHIGERU TOMITA,KATSUHIKO SATO and JUN-ICHI ANZAI.Layer-by-layer assembled thin films composed of carboxyl-terminated poly(amidoamine)dendrimer as a pH-sensitive nano-device[J].Journal of Colloid and Interface Science,2008,326(1):35~40.
[37]林奕,刘建勋,李宇,等.聚N,N-二乙基丙烯酰胺温敏水凝胶的药物释放研究[J].功能高分子学报,1999,12:135~140.
[38]NITIN S SATARKAR and J ZACH HILT.Hydrogel nanocomposites as remote-controlled biomaterials[J].Acta Biomaterialia,2008,(1):11~16.
[39]门晓媛,王一飞.几种药剂辅料的应用进展[J].中国医药工业,2004,35(12):764~767.
[40]乔雪梅.β-环糊精接枝改性海藻酸钠及其控释研究[D].西安,西北大学,2007.
[41]盘茂东,李嘉诚,林强,等.海藻酸钠在药物控释中的应用[J].药学专论,2008,l7(l9):3~5.
Progress in Study on Sustained-release and Controlled-release Polymers Material
LIANG Liang,HU Xiao-ling,XI Shan and QIAN Li-wei
(Department of Applied Chemistry,College of Science,Northwestern Polytechnical University,Xi’an 710129,China)
The sustained-release and controlled-release materials become the research priorities of drug releasing carrier materials and have a very promising development for their wide sources of raw materials,strong ability of compound modification and many factors affected by environment. This article presents the sustained-release and controlled-release polymer materials for pharmacy,and their performance features and applications in detail,and concisely introduces the research value and trends of medicinal sustained-release and controlled-release polymer materials.
Polymers;sustained-release material;controlled-release material
book=193,ebook=193
TQ 322.97
A
1001-0017(2010)06-0055-05
2010-07-15
梁良(1986-),男,汉族,江西景德镇人,硕士研究生,主要从事功能高分子方面的研究。
E-mail∶liangliang@mail.nwpu.edu.cn。

