不补料连续酶解-膜分离耦合制备鱼鳞胶原蛋白抗氧化肽的研究
马海乐,王中斌,骆 琳,何荣海
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.江苏省农产品生物加工与分离工程技术研究中心,江苏镇江212013)
不补料连续酶解-膜分离耦合制备鱼鳞胶原蛋白抗氧化肽的研究
马海乐1,2,王中斌1,骆 琳1,2,何荣海1,2
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.江苏省农产品生物加工与分离工程技术研究中心,江苏镇江212013)
以克服传统酶解技术存在的不足,提高酶解反应效率为目的,研究了鱼鳞胶原蛋白抗氧化肽制备的不补料连续酶解-膜分离耦合反应技术。从实验得到的加酶量、底物浓度和循环泵转速对蛋白转化率的影响规律分析了酶膜耦合反应技术优于传统的酶解技术的原因。通过正交实验,得到最优的酶解工艺条件为:底物浓度4%(W/W)、加酶量1.5%、反应时间30min、反应温度60℃、循环泵转速120r/min和pH9.5,该条件下蛋白转化率高达97.56%。
酶膜耦合,鱼鳞胶原蛋白,抗氧化肽,蛋白转化率
Abstract:To overcome disadvantage of conditional enzymatic hydrolysis and improve reaction effect,continuous coupling of enzymatic hydrolysis and membrane separation without material(CEHMS)feeding was used for preparation of antioxidant peptides from scale collagen.The reason why CEHMS was better than conditional enzymatic hydrolysis was analyzed from effectual rules of enzymatic dosage,substrate concentration and cycle pump speed on percent conversion of protein.The optimal conditions gotten from orthogonal test were:substrate concentration 4%(W/W),enzymatic dosage1.5%,reaction time 30min,reaction temperature 60℃,cycle pump speed 120r/min and pH9.5.Under the optimal conditions,percent conversion of protein reached 97.56%.
Key words:coupling of enzymatic hydrolysis and membrane separation;scale collagen;antioxidant peptides;percent conversion of protein
近年来国内外关于鱼鳞胶原蛋白利用的研究主要集中在提取技术方面[1-3],经过酶解转化成为功能多肽的报道尚较为鲜见。曾少葵[4]、涂宗财[5]等人研究了鱼鳞胶原蛋白酶解技术,研究表明酶解产物具有显著的抗氧化活性。但是实践证明,采用传统的酶解技术,随着反应的进行,会出现产物抑制效应和多肽过度降解等问题。近年大量的研究证明,酶解-膜分离耦合技术可以克服传统酶解技术存在的不足,显著提高酶解反应效率和产物的活性[6-9]。为此,本课题组将酶解-膜分离耦合技术应用于鱼鳞胶原蛋白抗氧化肽的制备,本文重点研究在不补料的情况下,底物浓度、加酶量、反应时间、反应温度、循环泵转速等因素对酶解制备抗氧化肽效果的影响。在此工作的基础上,下一步课题组将研究连续补料的工作情况。
1 材料与方法
1.1 材料与仪器
鱼鳞胶原蛋白 市售;浓硫酸 国产分析纯;Alcalase 2.4L 诺维信(中国)生物技术有限公司。
Pellicon小型超滤系统 包括截留分子量为3kDa的纤维素平板膜,美国Millipore公司;PHS-3C精密pH计 上海精密科学仪器有限公司;AvantiJ-25高效离心机 美国贝克曼公司;凯氏定氮仪 常州诚和仪器设备有限公司。
1.2 实验方法
1.2.1 蛋白质含量的测定与转化率的计算 蛋白含量的测定采用凯氏定氮法(GB/T5009.3-2003)。蛋白转化率以膜过滤透过液中蛋白质含量占原料液中蛋白质含量百分比计算:

式中:X为蛋白转化率,%;C0为原料液蛋白含量,mg/mL;V0为原料液总体积,mL;C1为透过液蛋白含量,mg/mL;V1为透过液总体积,mL。
1.2.2 不补料连续酶膜耦合反应操作的基本流程一定底物浓度的鱼鳞胶原蛋白溶液→调节反应液pH、反应温度→超滤泵转速100r/min循环5min→加酶→进行酶解-膜分离耦合反应一定时间→收集透过液→测定底物蛋白转化率
1.2.3 不补料连续酶膜耦合反应的单因素实验 以Alcalase为反应用蛋白酶,采用截留分子量为3kDa的纤维素平板膜,在不补充料液的情况下,对鱼鳞胶原蛋白进行连续循环的酶解-膜分离耦合反应。在Alcalase推荐的酶解温度和pH下,考察酶解反应时间、底物浓度、加酶量、循环泵转速对鱼鳞胶原蛋白转化率的影响,确定最佳酶解工艺。截留分子量3kDa的多肽由前期酶解产物的抗氧化实验筛选所得。
各单因素的取值分别为:反应时间10、20、30、40、50、60min,加酶量 0.5%、1%、1.5%、2%、3%、4%,反应温度 45、50、55、60℃,循环泵转速 50、100、150r/min,底物浓度0.5%、1%、2%、3%、4%。其实在一般的酶解反应中,反应的温度和pH使用蛋白酶的推荐值即可,但是酶膜耦合反应考虑到外循环可能会引起系统实际温度发生变化,因此有必要研究料液温度的影响。
1.2.4 不补料连续酶膜耦合反应的正交优化实验在单因素实验结果的基础上,以底物蛋白转化率为考察指标,以加酶量、反应温度、反应液pH、反应时间、循环泵转速和底物浓度为实验因素,通过六因素三水平的正交实验[11](如表1所示),优化确定不补料连续酶膜耦合反应制备抗氧化肽的最优工艺参数。
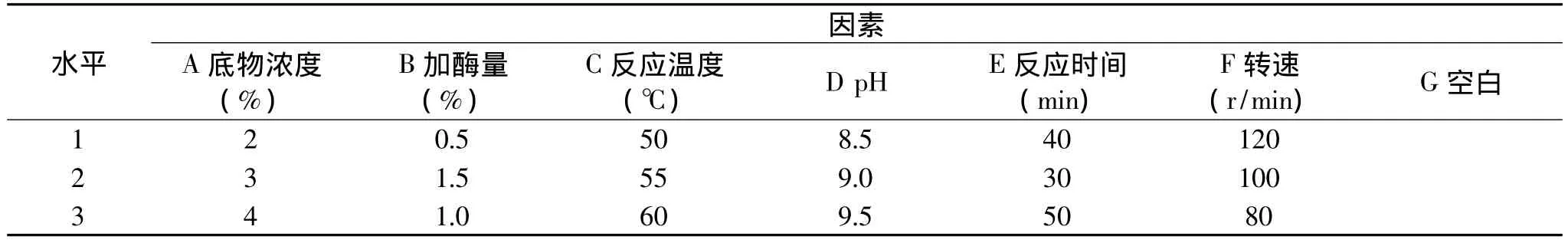
表1 不补料连续酶膜耦合反应正交实验设计
2 结果与讨论
2.1 不补料连续酶膜耦合反应单因素实验结果
2.1.1 酶膜耦合反应时间对蛋白转化率的影响 酶膜耦合反应条件:加酶量3%,反应温度50℃,反应液pH9.0,底物浓度1.5%,循环泵转速100r/min。反应时间对蛋白转化率的影响如图1所示。
由图1可知,当酶膜耦合反应时间较短时,鱼鳞胶原蛋白转化率提高迅速,当反应时间高于40min时,鱼鳞胶原蛋白的转化率提升幅度趋于平缓。反应初期转化率提高迅速的原因一方面是由于底物相对酶量而言比较充分;另一方面由于大分子底物蛋白的不断伸展,肽链的解聚,有利于底物与蛋白酶的充分接触、降解过程的进行。到了反应后期,底物逐渐不足,受酶催化蛋白质的解聚过程趋于结束,已经伸展的大分子蛋白大部分被蛋白酶催化降解,因此蛋白转化率趋于稳定。
2.1.2 加酶量对蛋白转化率的影响 酶膜耦合反应条件:反应温度50℃,反应液pH9.0,底物浓度1.5%,循环泵转速100r/min。不同加酶量下蛋白转化率随时间变化的曲线如图2所示。

图1 酶膜耦合反应时间对蛋白转化率的影响

图2 不同加酶量对蛋白转化率的影响
由图2可知,在相同的反应时间下,当加酶量小于1.5%时,底物蛋白转化率随加酶量的增加而提升较快,当加酶量高于1.5%时蛋白转化率的增加不明显,其直接的原因是此时底物蛋白已经被蛋白酶所饱和。低酶量下转化率随时间增加而增加的速率缓于加酶量高的情况,但超过线性增加阶段的末端以后,低酶量对应的转化率还持续以一个较高的速度增加,这个结果可能与采用酶膜耦合反应有一定的关系。酶膜耦合反应可以在酶解的同时持续不断地将小分子的多肽分离出去,对于低酶量的情况,相对于传统的酶解方法,有利于缓解酶量不足的现象,将蛋白酶继续高效地用于残存的可以被酶解的蛋白质。
2.1.3 反应温度对蛋白转化率的影响 酶膜耦合反应条件:加酶量 1.5%,反应液 pH9.0,底物浓度1.5%,循环泵转速100r/min。不同反应温度下蛋白转化率随时间变化的曲线如图3所示。
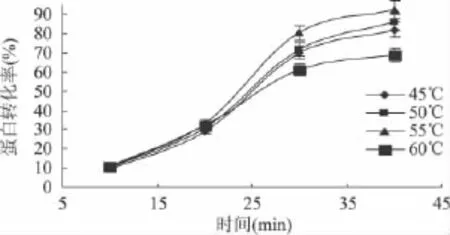
图3 不同反应温度对蛋白转化率的影响
由图3可知,在不同的反应温度下,蛋白转化率随时间的延长均呈现上升趋势。蛋白转化率随着温度的升高,先增加后减小,55℃时达到最大。而这与碱性蛋白酶推荐的最佳温度50℃相差5℃,这主要是因为,推荐的温度是在未使用膜过滤情况下的最适温度,而使用了酶膜耦合反应方案后,料液通过管道到达膜装置,在料液输送过程中存在一定的热量损失,需要予以补充。因此选择55℃为后续实验温度。
2.1.4 底物浓度对蛋白转化率的影响 酶膜耦合反应条件:加酶量1.5%,反应液pH9.0,反应温度55℃,循环泵转速100r/min。不同底物浓度下蛋白转化率随时间变化的曲线如图4所示。

图4 不同底物浓度对蛋白转化率的影响
许学书的实验发现[10],对于传统的酶解反应而言,底物浓度越高反应速率越低,许学书认为由于底物抑制所致,其实高浓度底物会产生高浓度的产物多肽,高浓度产物对反应的抑制效应是降低其反应速率的重要原因。由图4可以看出,在底物浓度达到3%之前,底物浓度越高,反应速率随时间的增加上升越快,这个结果说明酶膜耦合反应很好地消除了产物抑制效应。但当底物浓度超过3%时,酶解产生的多肽量过多因膜的过滤能力不足,出现了产物抑制,导致反应速率下降。因此后续实验底物浓度选择3%。
2.1.5 循环泵转速对蛋白转化率的影响 酶膜耦合反应条件:加酶量1.5%,反应液 pH9.0,反应温度55℃,底物浓度3%。不同循环泵转速下蛋白转化率随时间变化的曲线如图5所示。
由图5可知,循环泵的转速高时,随着时间的增加,蛋白质的转化率迅速上升,但很快达到稳定阶段的转化点,其原因应当是快速循环,一方面有利于酶解出来的小分子多肽及时排出反应系统,另一方面液体循环的强化传质作用有利于促进酶与底物的接触,但20min后底物变得不足,快速的循环反而变得降低酶与底物的有效接触。从100r/min这条曲线可以看出,对于较低的转速,在转化点30min以后,蛋白质的转化率还以一定的速度上升,因此说明反应后期相对较低的循环速度,在不影响多肽排出的情况下,有利于促进蛋白质的酶解。图5的启示为,对于不补料的工作模式,采取先高速后低速的变速循环策略,应当有利于改善蛋白质的转化率。
通过上述单因素实验,得到较优的反应条件是:加酶量1.5%,反应温度55℃,底物浓度3%(W/W),循环泵转速100r/min,反应时间40min,从图5可以看出,该条件下蛋白转化率为92.75%。
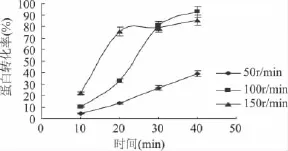
图5 不同循环泵转速对蛋白转化率的影响
2.2 不补料连续酶膜耦合反应正交实验结果
按照表1的实验设计,完成的优化实验研究结果如表2所示。
由表2可知,按照极差大小,影响抑制率的五个因素的主次顺序依次为A>E>C>F>D>B,即影响酶解液抑制率最大的是底物浓度,其次是反应时间,然后依次是反应温度、循环泵转速、反应液pH、加酶量。由于最佳组合没有出现在正交表中,因此对最优组合进行验证实验,该条件下蛋白转化率平均为97.56%,比单因素蛋白转化率提高了5.19%。
3 结论
3.1 加酶量、底物浓度和循环泵转速对蛋白转化率的影响规律,证明了酶膜耦合反应技术在克服传统酶解技术不足方面表现出显著的优势。
3.2 单因素实验得到较优的酶解条件为:底物浓度3%(W/W)、加酶量1.5%、反应时间40min、反应温度55℃、循环泵转速100r/min,该条件下蛋白转化率为92.75%。
3.3 正交实验得到最优的酶解工艺条件为:底物浓度4%(W/W)、加酶量1.5%、反应时间30min、反应温度60℃、循环泵转速120r/min、pH9.5,该条件下蛋白转化率为97.56%,比单因素实验得到的蛋白较优转化率提高了5.19%。
[1]钟朝辉,李春美,梁晋鄂,等.鱼鳞胶原蛋白提取工艺的优化[J].食品科学,2006,27(7):162-166.
[2]Ikoma T,Kobayashi H,Tanaka J,et al.Microstructure,mechanical and biomimetic properties of fish scales from Pagrus major[J].Journal of Structural Biology,2003,142(3):327-333.
[3]周念波,胡耀星,汪倬,等.木瓜蛋白酶酶解鱼鳞提取胶原蛋白的工艺研究[J].武汉生物工程学院学报,2007,3(1):19-21.
[4]曾少葵,蓝海明,章超桦,等.罗非鱼鳞胶原蛋白的提取及其酶解产物的抗氧化性[J].上海海洋大学学报,2009,18(5):299-603.
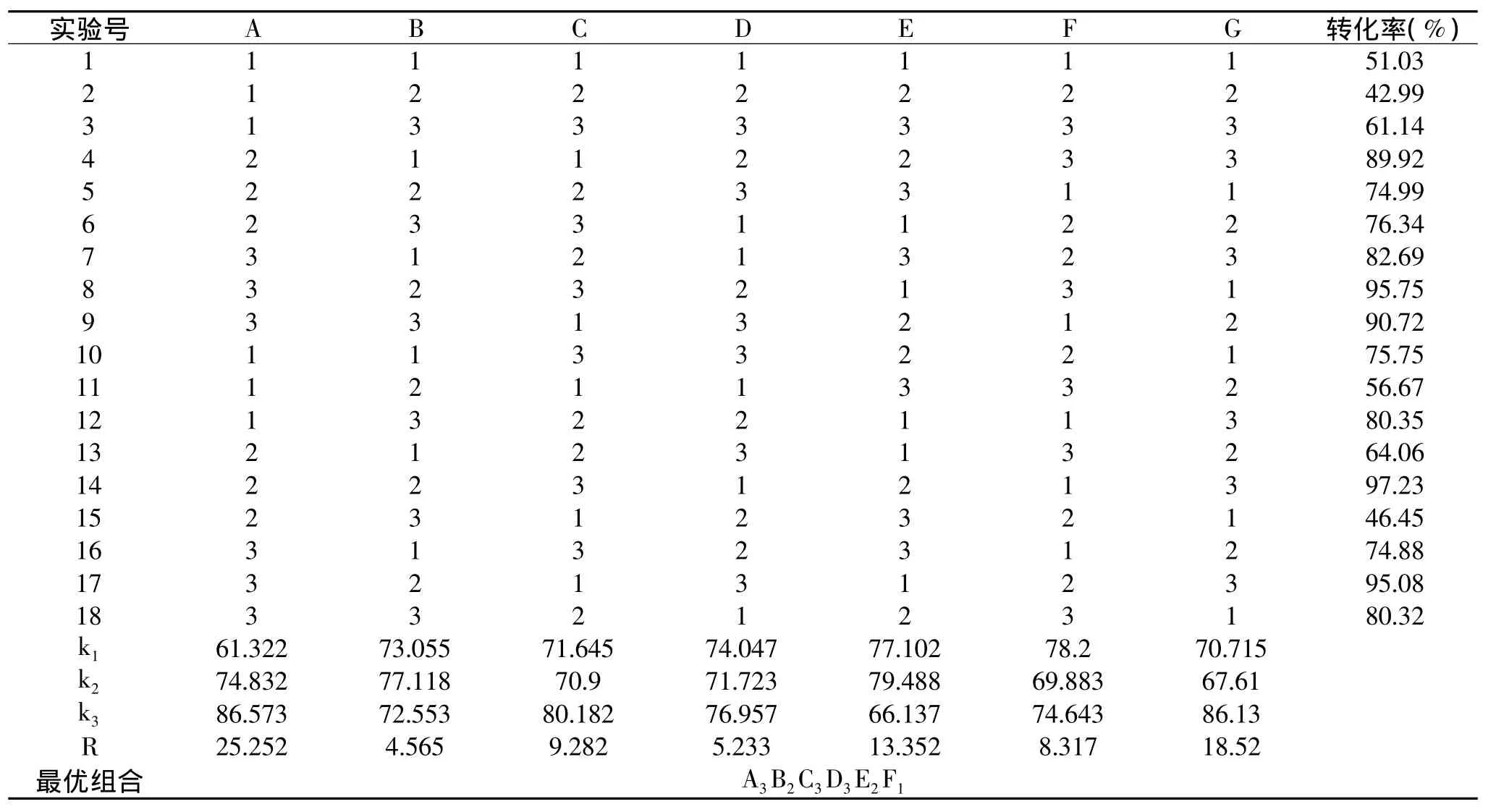
表2 L18(37)正交实验直观分析表
[5]涂宗财,陈剑兵,刘伟,等.酶解鱼鳞胶制备小分子多肽的研究[J].食品科学,2005,8(26):210-212.
[6]丁青芝,马海乐,骆琳,等.酶解-膜分离耦合技术制备米糠蛋白活性多肽的研究[J].高校化学工程学报,2009,23(4):632-638.
[7]Romain Kape,Elhassan Rahhou,Didier Lecouturier,et al.Characterization of an antihypertensive peptide from an Alfalfa white protein hydrolysate produced by a continuous enzymatic membrane reactor[J].Process Biochemistry,2006,41(9):1961-1966.
[8]Chiang,Wen- Dee,Tsou,et al.Angiotensin I- converting enzyme inhibitorderived from soy protein hydrolysate and produced by using membrane reactor[J].Food Chemistry,2006,98(4):725-732.
[9]Antonio Guadix,Fernando Camacho,Emilia M.Production of whey protein hydrolysates with reduced allergenicity in a stable membrane reactor[J].Journal of Food Engineering,2006,72(4):398-405.
[10]许学书,黄慧,廖湘海,等.超滤和反应器偶联组合进行干酪素酶解反应[J].化学反应工程与工艺,2001,17(2):133-137.
[11]BoxG E P,HunterJS,HunterWG.Statisticsfor Experimenters:Design,Innovation and Discovery[M].Wiley,New York,2005.
Preparation of antioxidant peptides from scale collagen by continuous coupling of enzymatic hydrolysis and membrane separation without material feeding
MA Hai-le1,2,WANG Zhong-bin1,LUO Lin1,2,HE Rong-hai1,2
(1.School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,China;2.Jiangsu Provincial Research Center of Bio-process and Separation Engineering of Agri-products,Zhenjiang 212013,China)
TS201.2+1
B
1002-0306(2010)08-0204-04
2010-05-17
马海乐(1963-),教授,博士生导师,研究方向:食品分离及食品生物技术。
863计划重点项目(2007AA100404);国家十一五支撑计划(2006BAD27B06)。

