三疣梭子蟹病原副溶血弧菌的分离与鉴定
阎斌伦,秦国民,暴增海,张晓君,毕可然,秦蕾
(淮海工学院 江苏省海洋生物技术重点实验室,江苏 连云港 222005)
三疣梭子蟹病原副溶血弧菌的分离与鉴定
阎斌伦,秦国民,暴增海,张晓君,毕可然,秦蕾
(淮海工学院 江苏省海洋生物技术重点实验室,江苏 连云港 222005)
从养殖病死三疣梭子蟹肝胰脏及心脏血淋巴液中分离到大量优势生长的细菌,人工感染试验证明分离菌对三疣梭子蟹有较强的致病性;对分离菌进行了形态特征、理化特性、胞外酶及溶血素活性等表型生物学性状及16S rRNA和gyrB两种基因的分子鉴定。菌株(JGX080708-1)所扩增的16S rRNA基因序列长度为1 453bp(GenBank 登录号:FJ824663),所扩增的gyrB基因序列长度为1 191bp(GenBank 登录号:GQ372985);两种基因序列在NCBI通过blast检索,结果均与弧菌属细菌的基因序列自然聚类;根据分离菌的表型及分子特征,判定分离菌为弧菌属(Vibrio Pacini 1954)的副溶血弧菌[Vibrio parahaemolyticus(Fujino et al 1951)Sakazaki Nakamura and Takizawa 1963]。分离菌的药敏试验结果显示,对供试49种抗菌药物中的安曲南等42种药物高度敏感,对林可霉素敏感,对青霉素G等6种药物耐药。
三疣梭子蟹;副溶血弧菌;16S rRNA基因;gyrB基因
Abstract:Dominant bacteria were isolated from diseased Portunus trituberculatus L.,and have strong pathogenicity to Portunus trituberculatus L.by artificial challenge.The phenotypic biological characters were examined,including morphological characteristics,physiological and biochemical characteristics; and the activity of extracellulase and hemolysin.The molecular identification were also conducted,and the 16S rRNA and gyrB genes were partially sequenced and compared with sequences deposited in databases,moreover molecular phylogenetic trees were constructed.The sequenced 16S rRNA gene of strain JGX080708-1 (GenBank accession No.FJ824663)is 1,453bp in length,and the sequenced gyrB gene of strain JGX080708-1 (GenBank accession No.GQ372985)is 1,191bp in length.Blasting of 16S rRNA and gyrB genes in NCBI showed high homogeneity between the isolates and Vibrio sp.from GenBank database.The results showed that the identified strains belonged to Vibrio parahaemolyticus [(Fujino et al 1951)Sakazaki Nakamura and Takizawa 1963]of Vibrio (Pacini 1954)based on their phenotypic and molecular characteristics.Drug resistance of isolates to 49 antimicrobial agents was detected,and the results showed that isolates were high sensitive to 42 agents including aztreonam,and also sensitive to lincomycin,furthermore they were resistant to 6 agents including penicillin G.
Keywords:Portunus trituberculatus L.; Vibrio parahaemolyticus; 16S rRNA gene; gyrB gene
三疣梭子蟹(Portunus trituberculatus)隶属于甲壳纲(Crustacea)、十足目(Decapoda)、梭子蟹科(Portunidae),是一种大型海产经济蟹类,广泛分布于东南亚、东亚、非洲、美洲及澳大利亚等地的海域内,中国沿海从南至北均有分布。三疣梭子蟹肉质鲜美,营养丰富,是人们极为喜爱的水产品,同时也是主要的出口创汇品种,随着梭子蟹人工繁育和养殖技术的突破,养殖发展迅猛,已成为继中国对虾以后中国海水甲壳类养殖的主导品种之一,但由于养殖设施及管理不规范、养殖大环境逐日恶化等因素的影响,导致病害频发,经济损失严重。据王国良等报道溶藻弧菌(Vibrioalginolyticus)和葡萄牙假丝酵母(Candida lusitaniae)可引起三疣梭子蟹肌肉乳化病[1];王高学等报道引起三疣梭子蟹“牛奶病”的病原为恶臭假单胞菌(Pseudomonas putida)[2];许文军等认为三疣梭子蟹“乳化病”由假丝酵母菌(Cnadida oleophila)感染引起[3]。
2008年7月,对江苏赣榆某三疣梭子蟹养殖场所发生的疾病进行了检验,病蟹主要表现为常靠近岸边缓慢游动,体色发红,以附肢最为明显,剥开背甲检查,鳃较混浊且附有污物,肝胰脏色淡。经用显微镜对病梭子蟹肌肉、肝胰脏及鳃的检验,未发现致病性寄生虫,随机取4只被检病蟹的肝胰脏及心脏血淋巴液做细菌学及致病性检验,结果表明其病原为弧菌属(Vibrio Pacini 1954)的副溶血弧菌[Vibrio parahaemolyticus(Fujino et al 1951)Sakazaki Nakamura and Takizawa 1963],尽管副溶血弧菌作为水生动物条件致病菌已多有报道,但目前尚未见有引起三疣梭子蟹感染发病的报道。为丰富该菌在宿主范围、生物学性状及分子生物学等方面的内容,进行了副溶血弧菌对三疣梭子蟹的致病性及其形态特征、理化特性、胞外酶及溶血素活性、16S rRNA基因和gyrB基因序列与系统发育学分析、对抗菌类药物的敏感性等系统研究,旨在对该菌的有效检验及深入研究等提供一定的参考。
1 材料与方法
1.1 细菌分离
病情严重但尚未死亡蟹(4只)经多次用生理盐水冲洗后又经75%酒精棉擦拭消毒,以其肝胰脏及心脏血淋巴液为样品,先经抹片后革兰氏染色镜检细菌;再用普通营养琼脂及 Zobell 2216E海水培养基做划线接种分离培养(28℃培养48 h检查)细菌,取分离菌移接于普通营养琼脂及Zobell 2216E海水琼脂培养基斜面(28℃培养24 h)做纯培养供检验用。
1.2 人工感染试验
试验用蟹选用2个月大小的健康幼蟹。将供试菌株(JGX080708-1)接种于含盐1%的普通营养肉汤,28 ℃过夜培养后作为供试菌液,采用浸浴及腿部肌肉注射两种感染方式。腿部肌肉注射感染:每只接种0.2 mL(菌液浓度调至约3×107CFU/mL),共接种 10只;同时腿部肌肉注射同剂量、同批无菌营养肉汤做对照;浸浴感染:分别取25 mL、50 mL、100 mL的供试菌液(菌液浓度约1×108CFU/mL)加至1 000 mL的试验用海水中使活菌数分别达到2.5×106CFU/mL、5×106CFU/mL、1×107CFU/mL 3个不同浓度,分别浸浴感染健康幼蟹,每组浸浴感染15只幼蟹,同时无菌营养肉汤浸浴幼蟹做对照;全部试验重复进行两次。试验蟹均隔离养殖于试验水族箱中,观察其感染后的发病与死亡情况,以引起试验幼蟹发病死亡并能重新分离回收到原感染菌作为分离菌致病性的判定指标。
1.3 细菌鉴定
1.3.1 形态与菌落特征观察及理化特性检查取纯培养菌分别移接于2 216 E海水琼脂斜面置28 ℃培养20 h,制备涂片标本进行革兰氏染色做形态特征检查;纯培养菌接种于2 216 E海水琼脂及硫代硫酸盐-柠檬酸盐-胆盐-蔗糖琼脂(TCBS)培养基,置28 ℃培养24 h,检查生长情况。
取纯培养菌,分别接种于细菌理化特性鉴定用培养基中,按常规进行氧化酶、接触酶、糖(醇及苷)类代谢、H2S、吲哚、MR、V-P试验、硝酸盐还原、OF试验、枸橼酸盐利用(Simmons)等较系统的理化特性测定,主要参照《常见细菌系统鉴定手册》[4]进行;分离菌的胞外蛋白酶活性、脂酶活性、淀粉酶活性、尿素酶活性及溶血活性采用平板检验方法,明胶酶活性采用试管液化方法。主要参照《人及动物病原细菌学》[5]进行。
1.3.2 16S rRNA 基因序列测定与系统发育学分析
1.3.2.1 PCR 模板DNA的制备 取纯培养菌分别接种于含盐1%的LB肉汤中28 ℃培养16 h,按小量细菌基因组 DNA抽提试剂盒(上海赛百盛基因技术有限公司产)所述方法提取 DNA作为PCR模板DNA。
1.3.2.2 16S rRNA和gyrB基因序列的PCR扩增与测序 16S rRNA基因PCR扩增的两个引物分别为:27F(正向引物):5'-AGA GTT TGA TC(C/A)TGG CTC AG-3',1492R(反向引物):5'-GGT TAC CTT GTT ACG ACT T-3'[6];gyrB基因PCR扩增的两个引物分别为:UP1(正向引物):5'-GAA GTC ATC ATG ACC GTT CTG CAY GCN GGN GGN AAR TTY GA-3',UP2r(反向引物):5'-AGC AGG GTA CGG ATG TGC GAG CCRTCN ACR TCN GCR TCN GTCAT-3'[7]。试验方法参照张晓君等(2009)[8]。
1.3.2.3 16S rRNA和gyrB 基因序列系统发育树构建 对分离菌的16S rRNA基因和gyrB基因序列通过 NCBI的 Blast检索系统(http://www.ncbi.nlm.nih.gov/Blast/)进行序列同源性分析,并使用ClustalX软件与从GenBank数据库中获得的序列相似性较高的菌株的序列进行多序列匹配排列(Multiple Alignments),采用MEGA3(Molecular Evolutionary Genetics Analysis,MEGA)及 PAUP4.0最大简约法(maximum parsimony,MP)构建MP树,并通过 Bootstrap 法(1 000次重复)检验。
1.3.3 菌种分类位置确定 根据细菌形态、培养及理化特性测定的结果,主要依据《Bergey's Manual of Determinative Bacteriology.9th ed》[9]、《Bergey’s Manual of Systematic Bacteriology》[10]及有关资料,并结合细菌发育学分析的结果,进行分离菌的种属分类位置判定。
1.4 药物敏感性测定
经鉴定后的菌株,用常规琼脂扩散(K-B)法进行对常用抗菌类药物的敏感性测定,以是否出现抑菌圈及抑菌圈直径大小作为敏感与耐药的判定指标[11]。
2 结 果
2.1 病变组织中的细菌与细菌分离
在4只被检三疣梭子蟹的肝胰脏及心脏血淋巴液中,均存在大量革兰氏阴性、排列不规则,多数散在、偶尔成双排列,无芽孢、大小多在0.4~0.8 µm×1.0~2.0µm 的杆菌。
自4只被检三疣梭子蟹的肝胰脏中均分离到了大量同种细菌。培养24 h检查其菌落特征为圆形光滑、不透明、隆起、边缘较整齐、直径多在0.5 mm左右,48 h的菌落直径多在1.0 mm左右。随机取 2个菌落做纯培养,其编号为:JGX080708-1~2。
2.2 分离菌的致病性
在两次重复进行的人工感染试验中,分离菌(JGX080708-1)经浸泡及肌肉注射感染健康幼蟹后,供试幼蟹在5 h至12 h全部死亡,部分死蟹出现明显的附肢发红。两种感染方式的对照组幼蟹在48 h观察期内均正常;取上述不同途径感染死亡蟹的肝胰脏及心脏血淋巴液,分别做抹片经革兰氏染色镜检细菌,结果发现均有大量在形态特征上同原感染菌的细菌;同时均分离到了原感染菌的菌落,取感染死亡蟹的分离菌落做纯培养2株,分别进行形态特征及主要理化特性指标的复核鉴定,结果均与原感染菌一致。试验证明分离菌为本次引起三疣梭子蟹大量死亡的病原菌且具有相当强的致病性。
2.3 形态特征与培养特性
2株纯培养菌的形态一致,均为革兰氏染色阴性、杆状、散在(个别成双)、无芽孢、大小多在 0.3 ~ 0.8μm×1.0~ 2.0 μm 的细菌。在 2216E 海水琼脂培养基上边缘较整齐、隆起、光滑、湿润、不透明、直径在2 mm左右;在TCBS琼脂培养基上,28 ℃培养24 h为圆形光滑、稍隆起、表面有光泽、直径多在1.2mm左右的绿色菌落,生长良好。
2.4 理化性状
分离菌所测主要理化性状的反应结果一致(见表1)。酶活性实验结果表明,2株供试菌的胞外产物具有淀粉酶、蛋白酶、脂肪酶活性,但不具有脲酶和明胶酶活性;在含 7%家兔脱纤血液营养琼脂培养基上,呈β型溶血现象。
2.5 16S rRNA 基因序列与系统发育学
分离菌(JGX080708-1)所扩增的16S rRNA基因序列长度为 1 453 bp(GenBank 登录号:FJ824663);所扩增的gyrB基因序列长度为1 191 bp(GenBank 登录号:GQ372985)。
将JGX080708-1株的16S rRNA基因序列在国际互联网上进行同源性检索,结果与弧菌属细菌的16S rRNA基因序列自然聚类,检索出的弧菌有副溶血弧菌(Vibrio parahaemolyticus)、哈氏弧菌(Vibrio harveyi)、溶藻酸弧菌(Vibrio alginolyticus)、需钠弧菌(Vibrio natriegens)及坎氏弧菌(Vibrio campbellii),供试菌与这些弧菌的的基因序列相似性均可达到98%至99%。选取了检索出的部分菌株和1株外围菌(嗜水气单胞菌,登录号:AF468055)的16S rRNA基因序列进行系统发育学分析,其MP系统发育树如图1所示,由图1很难将分离菌进行归属分类。将分离菌(JGX080708-1)所扩增的gyrB基因序列在NCBI通过Blast进行同源性检索,结果检索出的均为弧菌属细菌的gyrB基因序列,主要包括副溶血弧菌(V.parahaemolyticus),相似性在98%~99%;另外检索出的有溶藻酸弧菌(V.alginolyticus)、哈氏弧菌(V.harveyi)、坎氏弧菌(V.campbellii)、需钠弧菌(V.natriegens)及轮虫弧菌(V.rotiferianus),分离菌的gyrB基因序列与这些弧菌的相似性在 84%~88%,未达到种的要求。选择一株嗜水气单胞菌的 gyrB基因序列(登录号:AF208258)作为外围菌进行系统发育学分析,其MP系统发育树如图2所示。在图2的系统发生树中,分离菌(JGX080708-1)和选择的10株副溶血弧菌聚为一个大分支,且自举值为100%。

表1 分离菌的理化特性结果Tab.1 Physiological and biochemical characteristics of isolates
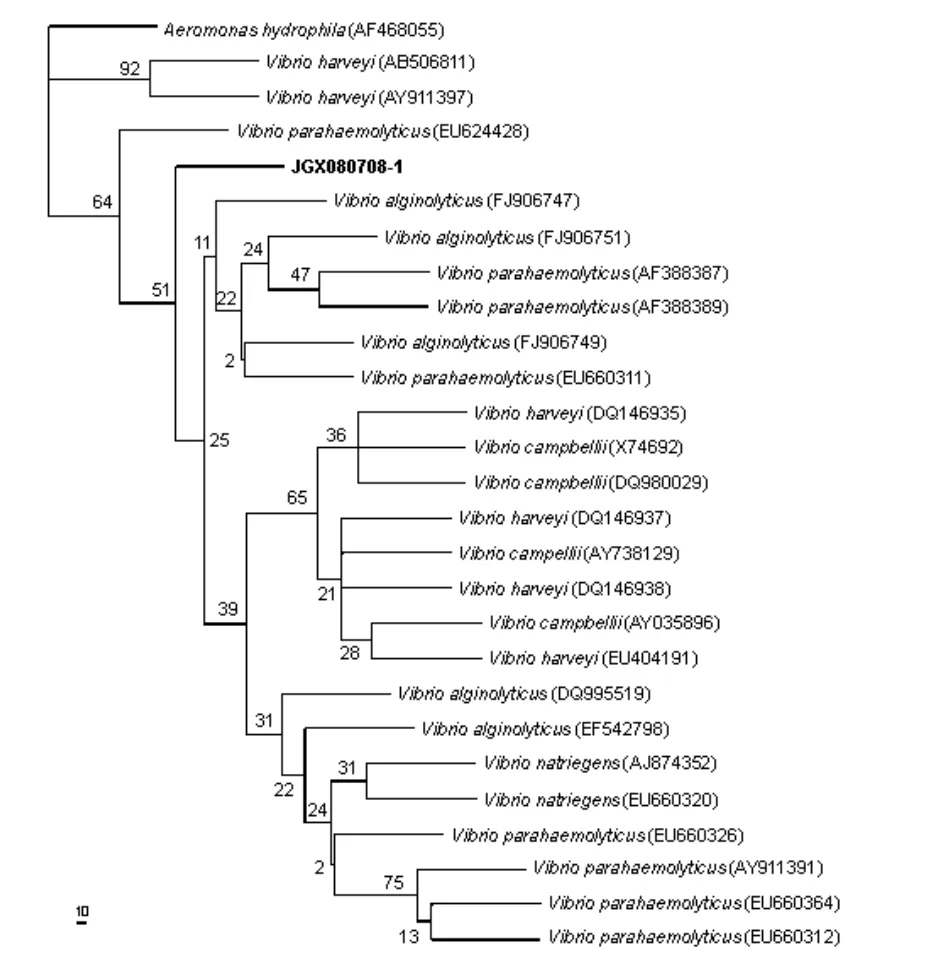
图1 JGX080708-1株16S rRNA基因序列系统发育树 (图中AF468055至EU660312为菌株在NCBI的登录号,数字为自举值)Fig.1 Phylogenetic tree based on JGX080708-1 16S rRNA genesequences (AF468055~ EU660312 were database accession numbers in NCBI,and numbers above branches in the tree are bootstrap values)
2.6 菌种分类位置
结合形态观察、普通的生理生化特征、16S rRNA及gyrB基因的分子特征,判定分离菌为弧菌属(Vibrio Pacini 1954)的副溶血弧菌[Vibrio parahaemolyticus(Fujino et al 1951)Sakazaki Nakamura and Takizawa 1963]。

图2 JGX080708-1株gyrB基因序列系统发育树 (图中AF208258至FM999818为菌株在NCBI的登录号,数字为自举值)Fig.2 Phylogenetic tree based on JGX080708-1 gyrB gene sequences(AF208258~ FM999818 were database accession numbers in NCBI,and numbers above branches in the tree are bootstrap values)
2.7 药物敏感性
2株分离菌对供试49种抗菌类药物敏感性株间无差异,均对安曲南等42种药物高度敏感(抑菌圈直径在20~60 mm);对林可霉素敏感(抑菌圈直径在12 mm);对青霉素G等6种耐药(抑菌圈直径在0~8 mm);具体结果见表2。

表2 药敏纸片名称和规格及病原副溶血弧菌的药物敏感性Tab.2 Name and type of discs and antimicrobial sensitivity of pathogenic V.parahaemolyticus
3 结语与讨论
副溶血弧菌(V.parahaemolyticus)广泛存在于世界各地近海岸的海水、海底沉积物及海生动物中,在河口入海处和盐碱地区也可以分离到。已有研究资料表明,副溶血弧菌可引起人和动物(主要是水产养殖动物如鱼、虾、蟹、贝等)的感染发病,因此也被认为是一种人与水产养殖动物共染的病原菌。有记述该菌可引起大黄鱼、斑节对虾、对虾、河蟹、锯缘青蟹、九孔鲍及文蛤等的感染发病[12-19]。此外,副溶血弧菌在人的感染主要为肠炎或食物中毒,自1950年藤野从日本大阪市发生的食物中毒病例分离到副溶血弧菌以来,世界许多国家如日本、中国、澳大利亚、印度、美国、越南、泰国、多哥、马来西亚、新加坡、俄罗斯、巴拿马、新西兰、罗马尼亚、墨西哥等均陆续报告了副溶血弧菌食物中毒或肠炎。本次通过对发病三疣梭子蟹肝胰脏及心脏血淋巴液抹片直接染色发现细菌,并有规律地分离到优势生长的细菌,人工感染试验能引起健康幼蟹的发病与死亡并回收到原感染菌等方面的研究,以及对分离菌进行了主要理化特性方面较系统的检验及系统发育学分析,表明所检出的细菌为副溶血弧菌且为被检病蟹的相应病原菌,进一步表明了该菌在水产养殖动物中的广泛致病作用。
细菌核糖体中的16S rRNA常用于细菌的鉴定与分类研究,该基因序列几乎可以对所有的细菌进行属水平上的鉴定[20],但由于16S rRNA在进化中高度保守,对于种间水平的鉴定往往分辨率不足,对相似率极高的近缘种无法作进一步的区分[21]。本次对于分离菌在进行常规的形态特征、理化特性等表型生物学性状检验的同时,又进行了16S rRNA和gyrB两种基因的分子鉴定,比较了16S rRNA和gyrB两种基因对副溶血弧菌的鉴别能力。分离菌(JGX080708-1)16S rRNA基因序列在NCBI通过blast检索,检索结果为5种弧菌,即副溶血弧菌、哈氏弧菌、溶藻酸弧菌、需钠弧菌及坎氏弧菌,且分离菌与这些弧菌的16S rRNA基因序列相似性均达到了98%~99%,均可达到种的要求,在系统发生树中(图 1),JGX080708-1未与上述5种弧菌的任何一种聚为一个类群,本研究表明在副溶血弧菌分子鉴定中,用16S rRNA基因序列很难将其与属内亲缘关系很近的种区分开。分离菌(JGX080708-1)gyrB基因序列在NCBI通过blast检索,检索结果为6种弧菌,即副溶血弧菌、溶藻酸弧菌、哈氏弧菌、坎氏弧菌、需钠弧菌及轮虫弧菌,分离菌的gyrB基因序列除与副溶血弧菌的相似性达到98%~99%外,与其他弧菌的相似性均只有84%~88%,未达到种的要求,且在系统发生树中(图2)也明显地与选择的10种副溶血弧菌聚为一个类群。本研究进一步表明在副溶血弧菌的检测和鉴别方面,编码DNA解旋酶B亚单位的gyrB基因比核糖体中的16S rRNA基因更具优越性。
在副溶血弧菌对抗菌类药物敏感性的研究方面,刘荭等(1999)报道分离于斑节对虾“红体病(red body disease)”的副溶血弧菌对氟哌酸、红霉素、青霉素和强力霉素较为敏感[13];李文宽等(1999)报道引起辽宁地区河蟹暴发性流行病的副溶血弧菌对呋喃唑酮、磺胺、链霉素、卡那霉素、磺胺+甲氧苄氨嘧啶敏感[16];毛芝娟等(2001)报道分离于锯缘青蟹的副溶血弧菌对氯霉素、环丙沙星和庆大霉素等抗菌药物表现出强敏感性,对诺氟沙星、磺胺甲异噁唑等中度敏感,对头孢唑啉、呋喃唑酮等不敏感,中草药五倍子和五味子也有较强的抑菌作用[17];张朝霞等(2001)报道分离于九孔鲍的副溶血弧菌对链霉素、丁胺卡那霉素、氯霉素、庆大霉素、壮观霉素、妥布霉素、强力霉素、多黏菌素B、复方新诺明、磺胺甲基异噁唑等药物高度敏感,对四环素、新霉素、头孢噻肟、环丙沙星等中度敏感,对红霉素、新生霉素、万古霉素、氟哌酸、呋喃唑酮、氨苄青霉素、呋喃妥因等耐药[18];本次对分离于三疣梭子蟹的副溶血弧菌进行的对供试 49种抗菌类药物的敏感性测定,结果对安曲南等42种药物高度敏感(抑菌圈直径在20~60 mm);对林可霉素敏感(抑菌圈直径在12 mm);对青霉素G等6种耐药,这些可作为在药物防治副溶血弧菌感染时选择用药及对副溶血弧菌耐药规律研究的参考。
副溶血弧菌作为人食物中毒和肠炎以及水产养殖动物的病原菌已被确认,目前对于该菌的毒力因子尚在研究之中,其中较为明确的是耐热性溶血毒素(TDH)以及不耐热的与 TDH相关的溶血毒素(TRH);副溶血弧菌的胞外产物(ECP)具有多种酶活性,单独注射感染即可导致中国对虾的严重发病及死亡[22];此外,研究发现尿素酶与副溶血弧菌的致病性之间存在一定关系,以往认为副溶血弧菌的尿素酶为阴性,尿素酶阳性的菌株与人的感染联系不大,但有许多实验证实尿素酶阳性菌株与 TRH之间呈正向联系。本次通过对引起三疣梭子蟹感染发病的副溶血弧菌进行胞外酶活性及溶血活性检测,表明本次分离的病原副溶血弧菌具有淀粉酶、蛋白酶、脂肪酶活性,但不具有脲酶和明胶酶活性,且具有溶血活性,可为副溶血弧菌毒力因子的深入研究提供参考。
[1]王国良,金珊,陈寅儿,等.三疣梭子蟹肌肉乳化病的病原及其致病性研究 [J].海洋科学进展,2006,24(4): 526-531.
[2]王高学,黄增荣,袁明.三疣梭子蟹牛奶病病原的分离鉴定 [J].西北农林科技大学学报,2007,35(6): 29-33.
[3]许文军,徐汉祥,施慧,等.梭子蟹假丝酵母菌病初步研究 [J].水产学报,2005,29 (6): 831-836.
[4]东秀珠,蔡妙英.常见细菌系统鉴定手册 [M].北京: 科学出版社,2001: 106-119,353-398.
[5]杨正时,房海,主编.人及动物病原细菌学 [M].石家庄:河北科学技术出版社,2003: 1550-1610.
[6]Martin F Polz,Collen M Cavanaugh.Bias in template to product ratios in multitemplate PCR [J].Appl Environ Microbiol,1998,64(10): 3 724-3 730.
[7]Yamamoto S,Harayama S.PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxomonic analysis of Pseudomonas putida strains [J].Appl and Environ Microbiol,1995,61(3): 1 104-1 109.
[8]张晓君,陈翠珍,阎斌论,等.凡纳滨对虾(Litopenaeus vannamei)病原副溶血弧菌(Vibrio parahaemolyticus)的表型及分子特征 [J].海洋与湖沼,2009,40(5): 654-661.
[9]Holt J G,Krieg N R,Sneath P H A,et al.Bergey’s Manual of Determinative Bacteriology [M].9th Ed.Williams and Wilkins,Baltimore,1994: 190-191,253.
[10]Krieg N R,Holt J G.Bergey’s Manual of Systematic Bacteriology[M].Volume 1.London: Williams and Wilkins,Baltimore,1984:545-548.
[11]叶应妩,王毓三.全国临床检验操作规程(第二版) [M].南京:东南大学出版社,1997: 553-562.
[12]林星,肖懿哲.大黄鱼弧菌病的诊治 [J].水产学报,1998,22(4): 29-30.
[13]刘荭,王侃,彭锦新,等.斑节对虾“红体病”细菌性病原的初步研究 [J].水产科技情报,1999,26(1): 7-9.
[14]宋春华,孟庆显.副溶血弧菌引起中国对虾红腿病的组织病理及防治 [J].齐鲁渔业,1998,15(3): 24-27.
[15]万夕和,裴鸿生,沈怀舜,等.江苏南部河蟹幼苗培育系统中致病性弧菌的分离诊断 [J].水产养殖,2000,(1): 19-21.
[16]李文宽,于翔,闻秀荣,等.辽宁地区河蟹暴发性流行病病原研究 [J].水产科学,1999,18(4): 10-13.
[17]毛芝娟,卓华龙,杨季芳,等.锯缘青蟹细菌性传染病的病原菌研究 [J].台湾海峡,2001,20(2): 187-192.
[18]张朝霞,王军,张蕉南,等.东山九孔鲍细菌性疾病研究 [J].台湾海峡,2001,20(2): 193-199.
[19]刘军义,陈振鸿,阎冰,等.文蛤副溶血弧菌病的研究 [J].微生物学杂志,1996,16(4): 1-5.
[20]Ward D W,Weller R,Bateson M M.16 S rRNA sequences reveal numerous uncultured microorganisms in a natural community [J].Nature,1990,345:63-65.
[21]Wang L,Lee F,Tai C,et al.Comparison of gyrB gene sequences,16 S rRNA gene sequences and DNA-DNA hybridization in the Bacillus subtilis group[J].Int J Syst Evol Micr,2007,57:1846-1850.
[22]牟海津,李筠,包振民,等.副溶血弧菌胞外产物对中国对虾的致病性分析 [J].海洋与湖沼,2000,31(3): 273-279.
Isolation and identification of Vibrio parahaemolyticus from diseased Portunus trituberculatus L.
YAN Bin-lun,QIN Guo-min,BAO Zeng-hai,ZHANG Xiao-jun,BI Ke-ran,QIN Lei
(College of Ocean,Key Laboratory of Oceanic Biotechnology of Jiangsu,Huaihai Institute of Technology,Lianyungang 222005,China)
S945; Q939.1
A
1001-6932(2010)05-0560-07
2009-03-25;
2009-12-29
“十一五”国家科技支撑计划重大项目(2006BAD09A01);江苏省水产三项工程项目(PJ2010-58);淮海工学院江苏省海洋生物技术重点建设实验室研究基金(2008HS016)资助
阎斌伦(1962-),男,教授,主要从事海洋生物技术与应用研究。电子邮箱:E-mail:yanbinlun@yahoo.com.cn

