维生素C和B1对铅致小鼠睾丸损伤保护作用研究
陕 光 张孝斌杨嗣星
(武汉大学人民医院泌尿Ⅱ科 湖北430060)
维生素C和B1对铅致小鼠睾丸损伤保护作用研究
陕 光 张孝斌*杨嗣星
(武汉大学人民医院泌尿Ⅱ科 湖北430060)
目的 探讨维生素C、B1联合用药拮抗铅对睾丸的毒性作用。方法 1.30只雄性小鼠随机分为2组(15只/组):空白对照组和铅染毒组。染铅组雄性小鼠每日腹腔注射醋酸铅20 mg/kg,空白对照组给予等容量的生理盐水,一日一次,第42日结束以上实验。将小鼠取血,用试剂盒检测血浆中谷胱甘肽的含量、谷胱甘肽过氧化物酶(GPx)和谷胱甘肽还原酶(GR)的活性。将睾丸组织经过处理后,在光镜及透射电镜下观察睾丸组织结构变化;2.45只雄性小鼠随机分为3组(15只/组):空白对照组、铅染毒组和维生素联合干预组。染铅组雄性小鼠每日腹腔注射醋酸铅20 mg/kg,维生素干预组在染铅后,即时每组小鼠给予维生素C和维生素B1,一日一次,第42日结束。处死小鼠,取血,用试剂盒检测血浆中谷胱甘肽的含量,谷胱甘肽过氧化物酶(GPx)和谷胱甘肽还原酶(GR)的活性。在光镜以及透射电镜下观察睾丸组织结构变化。结果 1.与空白对照组比较,醋酸铅染毒组小鼠血浆中还原型谷胱甘肽(GSH)的水平降低,GSH/GSSG的比例降低,GPX活性升高,GR活性降低;光镜下睾丸组织生精小管变薄,各级生精细胞、支持细胞减少,部分细胞核出现核固缩;3.电镜下染毒组小鼠睾丸组织超微结构变化明显,支持细胞溶酶体增多,线粒体肿胀空泡化;2.与醋酸铅染毒组比较,维生素干预组小鼠血浆中还原型谷胱甘肽(GSH)的水平升高,GSH/GSSG的比例升高,GPx活性降低,GR活性升高;光镜观察结果:与染铅组相比,维生素B1和C联合干预组中破坏的睾丸生精上皮有所恢复;电镜观察结果:与染铅组相比,维生素B1和C联合干预组睾丸组织超微结构基本恢复正常,生精细胞和支持细胞结构正常,细胞器丰富。结论 1.醋酸铅使体内GSH的水平降低,GPX活性升高,GR活性降低,从而诱导氧化应激的发生,导致染铅小鼠睾丸的损伤;2.维生素干预组小鼠血浆中还原型谷胱甘肽(GSH)的水平升高,GSH/GSSG的比例升高,GPx活性降低,GR活性升高,维生素干预组小鼠血浆中氧化型谷胱甘肽还原为还原型谷胱甘肽,从而发挥抗氧化作用,对小鼠睾丸起到保护作用。
醋酸铅;生精细胞;氧化应激;GSH;GPX;GR;维生素B1;维生素C
铅是自然界普遍存在并被广泛应用的一种金属。在工业革命之前人体对环境中铅的接触相对较少,但随着工业化和大规模的采矿,这种接触日益增加。与其他非必需元素相比,环境中铅的污染相对较高。在体内,铅以稳定的氧化态铅存在,目前尚未发现其有生理功能,理想的血浓度为零[1,2]。人体在摄入铅后,体内的铅可能分布于三个主要部位:体内铅蓄积最多的是在骨骼中,其次是血液和软组织。近30年来,由于精液质量下降从而增加了人们对男性生殖健康的关注,同时人们也逐渐认识到铅对男性生殖的毒性作用[3]。
在铅中毒防治工作中,普遍使用的常规螯合剂(如巯基药和氨羧络合剂)可导致体内一些必需元素如 Zn、Cu、Mn、Fe等的损失[4]。有些药物还会对某些器官如肾脏造成损坏,对低水平的铅暴露亦不敏感5,6]。鉴于以上的副作用,螯合剂的安全和有效性受到了质疑[7]。而维生素作为人类正常的膳食成分,对人体毒副作用较少,因此日益受到研究者们的广泛关注,并超出一般临床治疗范围。维生素C在体内是多种代谢酶的辅酶,在体内参与多种反应,如参与氧化还原过程,在生物氧化和还原作用以及细胞呼吸中起重要作用。此外 Ping等[8]实验表明富含维生素C的饲料有明显拮抗铅吸收的作用,加速铅排泄。
近年来,由于B族维生素尤其是维生素B1的安全性较高,在驱铅治疗中日趋受到关注。虽然已有大量证据证实了维生素B1和C的联合抗铅作用,但关于不同剂量维生素B1和C对铅毒性,特别是对铅致睾丸细胞凋亡的影响,目前国内外的研究较少。谷胱甘肽属于含有巯基的、小分子肽类物质,具有两种重要的抗氧化作用和整合解毒作用。环境毒物可诱导氧化还原状态的改变,接触的环境毒物通过不同的相互连接机制诱导改变细胞的氧化还原平衡。维生素B1、C联合应用可使更多的 GSSG转化为 GSH,而 GSH起到了强大的抗氧化作用。同时另外一方面维生素B1、C联合应用可修复铅对线粒体的损伤,从而抑制更多ROS的产生,并有效的清除·O2-、·OH-和NO,逆转铅对小鼠睾丸组织的损伤。
因此,本实验在探讨铅睾丸毒性作用机制的同时,进一步观察不同剂量维生素B1、C的联合干预作用,为铅中毒防治的人体实验研究和维生素的合理应用提供科学依据,也为铅暴露人群提供安全的保健措施,这对于促进广大人群的健康具有重要的现实意义。
材料和方法
1动物分组及铅染毒小鼠模型的建立
1.1 选用雄性(体重11-19 g)小鼠,适应性喂养一周后,30只雄性小鼠随机分为2组(15只/组):空白对照组和铅染毒组。染铅组雄性小鼠每日腹腔注射醋酸铅20 mg/kg,空白对照组给予等容量的生理盐水,一日一次,第42日结束以上实验。
1.2 选用雄性(体重11-19 g)小鼠,适应性喂养一周后,45只雄性小鼠随机分为3组(15只/组):空白对照组、铅染毒组和维生素联合干预组。染铅组雄性小鼠每日腹腔注射醋酸铅20 mg/kg,维生素干预组在染铅后,即时每组小鼠给予维生素C和维生素B1,一日一次,第42日结束。
2.观察指标及测试方法
在第42日后分别颈椎脱臼处死每组各15只小鼠,立即取睾丸组织。将睾丸组织放入4%的中性甲醛中固定48小时,再经过脱水、包埋等步骤制成4-6μm的石蜡切片。各组小鼠另分别断尾取血分离出血浆,用试剂盒检测 GSH含量,GPx和GR活性。
3.睾丸组织细胞形态学常规 HE染色后镜下观察。
4.血浆谷胱甘肽(GSH)的检测
4.1 血浆总谷胱甘肽(TGSH)的检测
(1)剪尾采血100 l,加入含有肝素的EP管
(2)40℃,1000rpm离心10min。
(3)收集上清50 l即为待测血浆
(4)25℃将50 l血浆加入96孔板与150μL试剂盒反应物(其中包括GR,DTNB和NADPH)作用5min
(5)使用紫外分光光度仪读取412nm波长处的OD值
(6)根据OD值做出标准曲线,得到TGSH值
4.2 血浆氧化型谷胱甘肽(GSSG)的检测
(1)25℃将 50μL 血浆和 GR 抑制剂2-vinylpyridine(108 l of 2-vinylpyridine and 892
l of ethanol)加入96孔板与150μL试剂盒反应物作用5min
(2)使用紫外分光光度仪读取412nm波长处的OD值
(3)根据OD值做出标准曲线,得到GSSG值
4.3 血浆还原型谷胱甘肽(GSH)的检测
TGSH值减去GSSG值既得GSH值
4.4 血浆GPx和GR活性的检测
(1)25℃将 20l血浆和 20l cumene hydroxide加入96孔板混合
(2)与50μL试剂盒反应物和GPx co-substrate作用5min
(3)使用紫外分光光度仪读取340nm波长处的OD值
(4)根据OD值做出标准曲线,得到GPx活性值
GR活性的检测方法根据试剂盒说明书
5.电镜观察睾丸组织超微结构
⑴将各组小鼠睾丸包膜剪开后将睾丸切成数块
⑵2.5%戊二醛前固定,1%锇酸后固定
⑶梯度乙醇脱水,树脂包埋
⑷半薄切片定位,超薄切片机切片,片厚60nm
⑸行醋酸铀、枸橼酸铅双重染色
⑹用 H-600型透射电镜观察睾丸组织超微结构
6.数据处理与统计方法
实验数据多以Mean±SD表示,均数的组间比较采用单因素方差分析(one-way ANOVA),率的组间比较采用χ2检验,P<0.05表示差异具有显著性。
结 果
1.小鼠睾丸组织病理形态学的改变
1.1 铅对雄性小鼠睾丸组织病理形态学的改变
光学显微镜下,空白对照组睾丸组织结构正常,生精上皮完整,各级生精细胞及精子排列有序;支持细胞核仁明显;生精小管之间可见形态正常的圆形或椭圆形睾丸间质细胞,核圆居中(图1)。在醋酸铅染毒6周后,生精上皮完整性严重破坏,精原细胞排列疏松,初级精母细胞及精子细胞锐减;支持细胞和间质细胞数目大量减少,可见大部分细胞核固缩(图2)。

1.2 维生素B1和C联合干预对染铅雄性小鼠睾丸组织病理形态学的影响
光学显微镜下,维生素B1和C联合干预组,破坏的睾丸生精上皮有所恢复,生精小管形态基本规则,各级生精细胞分层排列;支持细胞和间质细胞核固缩细胞减少(图3)。

图3 维生素干预组小鼠睾丸组织形态学变化 HE×200Fig.3 Testis of mouse treated with lead and vitamins(HE staining×200)Reduction in the number of the spermatogenic cells, Sertoli cells was prominent,and part of spermatogenic cells appeared caryolysis(red arrow)in vitamin-protected group;(HE staining×200).
2.小鼠血浆GSH和GSSG水平的影响
2.1 铅对雄性小鼠血浆 GSH和 GSSG水平的影响 空白对照组小鼠血浆中GSH的水平大致是醋酸铅染毒小鼠血浆中 GSH水平的1.6倍,其差异在统计学上有显著性意义(P<0.05);同时醋酸铅染毒组小鼠血浆中 GSSG的水平大致是空白对照组小鼠血浆中GSSG水平的1.4倍,其差异也有显著性意义(P<0.05)(图4)

图4 染铅小鼠血浆GSH水平降低Reduced plasma glutathione levels in Pb-treated group.Fig.4 The levels of plasma GSH and oxidized glutathione(GSH and GSSG)were determined using a glutathione assay kit,and the reduced glutathione(GSH)level was calculated by subtraction of GSSGfrom TGSH.Data represent the mean±SE(n=15/group).*P<0.05 vs Control group
2.2 维生素B1和C联合干预对染铅雄性小鼠血浆GSH和GSSG水平的影响
维生素联合干预组小鼠血浆中GSH的水平大致是醋酸铅染毒小鼠血浆中 GSH水平的1.8倍,其差异在统计学上有显著性意义(P<0.05);而醋酸铅染毒组小鼠血浆中 GSSG的水平大致是维生素联合干预组小鼠血浆中 GSSG水平的1.6倍,其差异亦有显著性意义(P<0.05)(图5)

图5 维生素联合干预组小鼠血浆 GSH水平升高, GSSG水平降低Increased plasma glutathione levels in Pb-treated group.Fig.5 The levels of plasma total and oxidized glutathione(GSH and GSSG)were determined using a glutathione assay kit,and the reduced glutathione(GSH)level was calculated by subtraction of GSSGfrom TGSH.Data represent the mean±SE(n=15/group).*P<0.05 vs Pb-treated group
3.小鼠血浆GPx和GR活性的影响
3.1 铅对雄性小鼠血浆GPx和GR活性的影响
与空白对照组小鼠相比较,醋酸铅染毒小鼠血浆中GPx的活性增加(P<0.05),而 GR的活性降低(P<0.05)(图6)
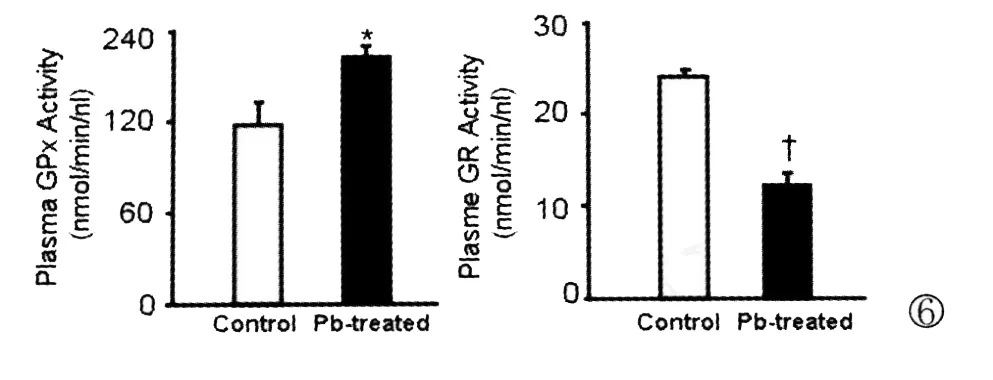
图6 染铅小鼠血浆GPx活性增高,GR活性降低Increased plasma GPx activity and decreased GR activity in Pb-treated group.Fig.6 GPx and GR activity were determined using a glutathione assay Kit.Data represent the mean±SE(n=15/ group).*P<0.05 vs Control group
3.2 维生素B1和C联合干预对染铅雄性小鼠血浆GPx和GR活性的影响
与醋酸铅染毒组小鼠血浆中 GPx的活性相比较,维生素联合干预组小鼠血浆中 GPx的活性降低,其差异在统计学上有显著性意义(P<0.05);同时数据显示,与醋酸铅染毒组小鼠血浆中 GR的活性相比较,维生素联合干预组小鼠血浆中 GR的活性增高,其差异在统计学上有显著性意义(P<0.05)(图7)
4 小鼠睾丸组织超微结构的改变
4.1 铅所致雄性小鼠睾丸组织超微结构的改变
空白对照组睾丸组织超微结构正常,支持细胞胞质丰富、粗面内质网及线粒体较多,精原细胞与基膜和支持细胞之间连接紧密(图8)。染毒组小鼠睾丸组织超微结构变化明显,主要表现为:①支持细胞溶酶体增多,线粒体肿胀空泡化,支持细胞内出现较大空泡;②精原细胞与支持细胞及生精小管的基膜之间出现较多较大空泡;③细胞间紧密连接模糊不清,间隙增宽(图9);

图7 维生素联合干预组小鼠血浆GPx活性降低,GR活性增加Decreased plasma GPx activity and increased GR activity in Pb-treated group.Fig.7 GPx and GR activity were determined using a glutathione assay kit.Data represent the mean±SE(n=15/ group).*P<0.05 vs Pb-treated group
4.2 维生素B1和C联合干预对染铅雄性小鼠睾丸组织超微结构的影响
维生素B1和C联合干预组睾丸组织超微结构基本恢复正常,生精细胞和支持细胞结构正常,细胞器丰富,精原细胞与基膜和支持细胞之间紧密连接层次清楚(图10)
讨 论
氧化应激是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)产生过多,氧化程度超出氧化物的清除,氧化系统和抗氧化系统失衡,从而导致组织损伤[9-11]。
谷胱甘肽属于含有巯基的、小分子肽类物质,具有重要的抗氧化作用和整合解毒作用[12]。谷胱甘肽有还原型(G-SH)和氧化型(G-S-S-G)两种形式,在生理条件下以还原型谷胱甘肽占绝大多数[13]。GSH主要是由细胞产生内源性的抗氧化剂并同时维持外源性抗氧化剂作用[14-16]。如维持VC、VE的还原形式。GSH通过直接结合来自于机体或体外的异质物、致癌物等从而起到解毒的作用。谷胱甘肽(尤其是肝细胞内的谷胱甘肽)具有非常重要的生理作用,就是能与某些药物(如扑热息痛)、毒素(如自由基、重金属)等结合,参与生物转化作用,从而把机体内有害的毒物转化为无害的物质,排泄出体外。
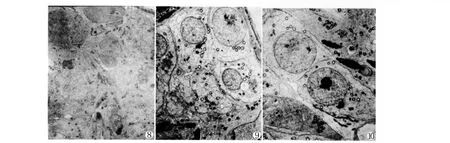
图8小鼠睾丸组织超微结构(EM×8000);图9小鼠睾丸组织超微结构(EM×10000);图10小鼠睾丸组织超微结构(EM×8000)Fig.8 Ultrastructure of mice testis tissue(EM×8000);Fig.9 Ultrastructure of mice testis tissue(EM×10000);Fig.10 Ultrastructure of mice testis tissue(EM×8000)
环境毒物诱导氧化还原状态的改变。接触的环境毒物通过不同的相互连接机制诱导改变细胞的氧化还原平衡已被广泛证明[17]。同时氧化应激也被证明对调节细胞凋亡起着重要的作用[18-20]。
铅已经被证明可以诱导产生活性氧,此外,铅可以导致抗氧化分子的直接消耗。铅实际上被证明直接结合胞浆谷胱甘肽。铅还结合酶,具有功能巯基,从而改变酶的活性和氧化还原平衡。铅暴露触发细胞凋亡在多种细胞系中已经得到证明,其中线粒体发挥关键作用。铅诱导的细胞凋亡已被证明是由谷胱甘肽消耗和产生的ROS介导的[21-22]。
本实验中,0.4%染铅组小鼠血浆中 GSH水平明显低于空白对照组,说明GSH直接与进入到体内的大量醋酸铅结合,消耗了GSH的量,氧自由基的产生增加,打破了氧化系统和抗氧化系统的平衡。我们同时发现相对于空白对照组 GPx的活性在染铅组是增高的,而GR的活性恰好相反。这也说明了机体内的GSH在GPx的作用下转变为了谷胱甘肽的氧化形式 GSSG。由于 GSH的消耗大于自身的合成,从而激活了氧化应激,造成了小鼠睾丸组织的损伤。
线粒体是细胞内产生ROS的主要场所,也是氧化损伤最先打击的靶器官。在生物体内,氧化与抗氧化处于平衡状态,正常情况下细胞代谢需要ROS,如低浓度的ROS能促进细胞增生。某些因素一旦打破这种平衡,使ROS产生增多,即可导致细胞损伤[23]。在金属铅催化下的 Fenton反应和Haber-Weiss反应中,进一步生成OH。在生物体内,OH的氧化性最强[24]。本实验中大量的醋酸铅进入小鼠体内,引发活性氧(ROS)增加,产生氧化应激损伤,造成线粒体结构、功能改变,出现线粒体膜电位降低、线粒体内膜通透性明显增加,可能通过抑制线粒体呼吸电子链,造成氧化及磷酸化作用脱偶联,导致能量代谢紊乱,并进一步导致细胞损伤甚至死亡,电镜下可见线粒体肿胀空泡化,线粒体嵴消失等结构变化。
活性氧(ROS),包括氧自由基:超氧阴离子自由基(·O2-)和羟自由基(·OH-),以及非氧自由基的衍生物,如过氧化氢(H2O2)。·O2-是线粒体中通过半泛醌减少氧分子而产生的,研究表明线粒体是内外凋亡信号诱导产生ROS的主要来源。其它的抗氧化分子(如VC,VE),酶(如磷脂过氧化氢、谷氧还蛋白)作为对抗氧化应激的次级防御。如果解毒系统和抗氧化作用受到损害,或者ROS产生过多将激活氧化应激导致DNA,蛋白质和脂质氧化[25-26]。
维生素C是体内多种代谢酶的辅酶,也是一种自由基清除剂,能干扰铅与重要的生物分子之间的相互作用,有效地清除活性氧(ROS)[27],从而降低铅引起的氧化应激反应[28]。维生素B1含有一个嘧啶环和噻唑核,两摩尔维生素B1中侧链上的羟基(-OH)和噻唑核中的硫(S)原子可能参与铅的螯合,推测维生素B1能够动员细胞内铅进入血流,以维生素B-铅复合物形式排出,从而降低铅在睾丸组织的蓄积[28]。Senapati等研究表明硫胺素具有预防铅诱导的肝脏脂质过氧化作用,从而减少铅损害[29]。推测这可能是硫胺素与含巯基的代谢酶作用有关,但明确的机制仍有待于进一步研究。
当维生素B1、C联合应用时抗铅作用明显增强,从而使生精细胞、支持细胞和间质细胞凋亡减少,睾丸组织损害减轻。光镜和电镜观察显示:损害的睾丸组织得到一定的修复。干预组小鼠血浆GSH水平提高,GPx活性降低,GR活性增强。由此我们可知道维生素B1、C联合应用使更多的GSSG转化为GSH,而GSH起到了强大的抗氧化作用。同时另外一方面维生素B1、C联合应用可能修复了铅对线粒体的损伤,从而抑制了更多ROS的产生,并有效的清除·O2-、·OH-和NO,逆转了铅对小鼠睾丸组织的损伤。此结果证明维生素B1、C联合应用可拮抗醋酸铅的睾丸毒性作用。
[1]The World Health report 2002.Midwifery,2003,19: 72-73
[2]Bellinger,DC.Lead.Pediatrics,2004,113:1016-1022
[3]Jensen TK,Bonde J P,Joffe M.The influence of occupational exposure on male reproductive function.Occup Med(Lond),2006,56:544-553
[4]Long G J,Rosen J F,Pounds J G.Lead impairs the production of osteocalcin by rat osteosarcoma(ROS 17/ 2.8)cells.Toxicol Appl Pharmacol,1990,106:270-277
[5]Bell AN,Mehendale HM.The effect of dietary exposure to a mirex plus chlordecone combination on CCl4 hepatotoxicity.Fundam Appl T oxicol,1985.5:679-687
[6]Geusau A,Schmaldienst S,Derfler K,et al.Severe 2, 3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)intoxication:kinetics and trials to enhance elimination in two patients.Arch Toxicol,2002,76:316-325
[7]Gurer H,Ercal N.Can antioxidants be beneficial in the treatment of lead poisoning?Free Radic Biol Med, 2000,29:927-945
[8]Hsu PC,Guo YL.Antioxidant nutrients and lead toxicity.Toxicology,2002,180:33-44
[9]Pompella A,Visvikis A,Paolicchi A,et al.The changing faces of glutathione,a cellular protagonist.Biochem Pharmacol,2003,66:1499-1503
[10]Pastore A,Piemonte F,Locatelli M,et al.Determination of blood total,reduced,and oxidized glutathione in pediatric subjects.Clin Chem,2001,47:1467-1469
[11]Yang Y,Dieter MZ,Chen Y,et al.Initial characterization of the glutamate-cysteine ligase modifier subunit Gclm(-/-)knockout mouse.Novel model system for a severely compromised oxidative stress response.J Biol Chem,2002,277:49446-49452
[12]Giordano G,Afsharinejad Z,Guizzetti M,et al.Organophosphorus insecticides chlorpyrifos and diazinon and oxidative stress in neuronal cells in a genetic model of glutathione deficiency.Toxicol ApplPharmacol, 2007,219:181-189
[13]McConnachie LA,Mohar I,Hudson FN,et al.Glutamate cysteine ligase modifier subunit deficiency and gender as determinants of acetaminophen-induced hepatotoxicity in mice.Toxicol Sci,2007,99:628-636
[14]Franco R,Sanchez-Olea R,Reyes-Reyes,EM,et al.Environmental toxicity,oxidative stress and apoptosis: menage a trois.Mutat Res,2009,674:3-22
[15]Ryter SW,Kim HP,Hoetzel A,et al.Mechanisms of cell death in oxidative stress.Antioxid Redox Signal, 2007,9:49-89
[16]Wang C,Zhang Y,Liang J,et al.Impacts of ascorbic acid and thiamine supplementation at different concentrations on lead toxicity in testis.Clin Chim Acta, 2006,370:82-88
[17]Quintanilla-Vega B,Hoover D,Bal W,et al.Lead effects on protamine-DNA binding.Am J Ind Med, 2000,38:324-329;
[18]Lloyd DA,Taylor J.Lifetime cumulative adversity, mental health and the risk of becoming a smoker.Health(London),2006,10:95-112
[19]Ben YN,Nouairi I,Ben TS,et al.Cadmium effects on lipid metabolism of rape(Brassica napus L.).C R Biol,2005,328:745-757
[20]West JD,Marnett LJ.Endogenous reactive intermediates as modulators of cell signaling and cell death.Chem Res Toxicol,2006,19:173-194
[21]Filomeni G,Ciriolo MR Redox control of apoptosis:an update.Antioxid Redox Signal,2006,8:2187-2192
[22]Chetty CS,Vemuri MC,CampbellK,et al.Lead-induced cell death of human neuroblastoma cells involves GSH deprivation.Cell Mol Biol Lett,2005,10:413-423
[23]Sharifi AM,Mousavi SH,Bakhshayesh M,et al.Study of correlation between lead-induced cytotoxicity and nitric oxide production in PC12 cells.Toxicol Lett, 2005,160:43-48
[24]Ji LL.Exercise and oxidative stress:role of the cellular antioxidant systems.Exerc Sport Sci Rev,1995,23: 135-166
[25]Chance B,Sies H,Boveris A.Hydroperoxide metabolism in mammalian organs.Physiol Rev,1979,59: 527-605
[26]Franco R,Schoneveld O J,Pappa A,et al.The central role of glutathione in the pathophysiology of human diseases.Arch Physiol Biochem,2007,113:234-258
[27]Kleszczewska E.Biological role of reactions of L-ascorbic acid with metals.Postepy Hig Med Dosw,2001, 55:81-94
[28]Upasani C D,Khera A,Balaraman R.Effect of lead with vitamin E,C,or Spirulina on malondialdehyde, conjugated dienes and hydroperoxides in rats.Indian J Exp Biol,2001,39:70-74
[29]Senapati SK,Dey S,Dwivedi S K,et al.Effect of thiamine hydrochloride on lead induced lipid peroxidation in rat liver and kidney.Vet Hum Toxicol,2000,42: 236-237
PROTECTIVE EFFECT OF ASCORBIC ACID AND THIAMINE SUPPLEMENTATION AGAINST DAMAGE CAUSED BY LEAD IN TESTES OF MICE
Shan Guang,Zhang Xiaobing*,Yang Cixing
(Department of Urology,The People’s Hospital of Wuhan University,Hubei430060,China)
Objective To investigate the protective effect and apoptosis-related mechanism of ascorbic acid and thiamine supplementation against damage caused by lead in the testes of mice.Methods 1.30 male mice were randomly assigned into 2 groups(15/group):(1)Control group:Animals served as negative controls and received tap water alone;(2)Pb-treated group:Animals were treated with Pb(20 mg/ kg)and received lead acetate by intraperitoneal injection daily.All the mice were anaesthetized with ether and killed by cervical dislocation on the 42nd test day.The activity of GPx and GR in the plasma were determined with activity assay kits according to the manufacture′s instructions.Under light microscope and transmission electron microscope(TEM),cytoarchitecture changes of specimens stained with hematoxylin and eosin(HE)were observed.2.45 male mice were randomly assigned into 3 groups(15/group):(1) Control group:Animals served as negative controls and received tap water alone;(2)Pb-treated group: Animals were treated with Pb(20 mg/kg)and received lead acetate by intraperitoneal injection daily;(3) Vitamin-protected group:Animals were injected VitC 420 mg/kg combined with VitB130 mg/kg daily afer Pb treatment.Bood was collected in tubes containing ethylene diamine tetraacetic acid as anticoagulant, the level of glutathione was measured using a glutathone assay kit.The activity of GPx and GR in the plasma was determined with activity assay kits.Testes were fixed in cold fixative for 48 h,and then paraffin sections were made.Under light microscope and transmission electron microscope(TEM),cytoarchitec-ture changes of specimens stained were observed.Results 1.The GSH level in the Pb-treated group decreased compared with that of the control goup,GSH/GSSG ratio also decreased,and the activity of GPx increased while that of GR decreased.Under light microscopy,many seminiferous tubules became thin, and disappearance of most spermatids and spermatozoa was also observed in the Pb-teated group.Under TEM,the testis ultrastructure of the Pb-treated group changed significantly,with increased lysosome of sertoli cells and swelling and vacuolization of mitochondria.2.The GSH level in the vitamin-protected group increased when compared with that of the Pb-treated goup,GSH/GSSG ratio also increased,and the activity of GPx decreased while that of GR increased.Under light microscopy,the pathologic changes in seminiferous tubules had partly recovered,and some displayed a full spermatogenic component.Under TEM,the testis ultrastructure in mice exposed to vitamin B1 and C returned to normal testicular tissue, germ cells and Sertoli cells were normal,and organelles were rich in spermatogonia.Conclusion 1.The GSH level in the Pb-treated group decreased,GSH/GSSG ratio decreased,the activity of GPx increased while the activity of GR decreased,which may induce oxidative stress.2.The GSH level in the vitaminprotected group increased,GSH/GSSG ratio increased,the activity of GPx decreased while the activity of GR increased.GSSG is converted to the reduced form(GSH)by vitamin B1and C.
Lead;Testis;Oxidative Stress;GSH;GPx;GR;Vitamin C;Vitamin B1
R698
A
10.3870/zgzzhx.2010.04.018
2010-04-12
2010-06-01
陕光,男(1980年),汉族,博士。
*通讯作者(To whom correspondence should be addressed)

