维生素C对A549细胞增殖、凋亡及Caspase-3、Survivin表达的影响
翟鹏勇 曾锦荣 谭宁 王绩英 黄岚珍 佘巍巍
维生素C(Vitamin C, Vit C)是一种具有6个碳原子的酸性多羟基化合物。其分子中2位和3位碳原子的两个烯醇式羟基极易解离,释放出H+,而被氧化成脱氢Vit C。Vit C和脱氢Vit C在人体内形成可逆的氧化还原系统,此系统在生物氧化、还原作用及细胞呼吸中起重要作用。Vit C作为细胞保护剂广泛应用于临床多种疾病(如坏血病、肝硬化等)的治疗。近年来,研究[1]发现Vit C可以促进肿瘤细胞的凋亡,但具体机制尚未完全阐明。本研究将探讨Vit C对肺癌A549细胞株的增殖、凋亡的影响及其可能机制。
1 材料和方法
1.1 实验材料与实验分组
1.1.1 实验材料 肺癌细胞株A549由中山大学附属肿瘤医院惠赠,DMEM培养液(GIBICOL公司),小牛血清(GIBICOL公司),Vit C(广州南国药业有限公司),CCK-8试剂(大连宝生物有限公司),RT-PCR反应体系(Promega公司),Caspase-3 mRNA及Survivin mRNA引物由上海赛百盛生物技术有限责任公司合成。
1.1.2 实验分组 以50×D/5 000×2×103公式[2]计算出Vit C临床用药量为400 μg/mL。实验分为对照组及40 μg/mL、400 μg/mL、4 mg/mL三种浓度Vit C组。
1.2 实验方法
1.2.1 细胞培养 A549细胞置于含10%小牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养液中,在37oC、5%CO2培养箱中传代培养。每两天换一次液,4 d传代。
1.2.2 细胞增殖测定(CCK-8法) 取指数期A549细胞,待生长至近融合状态,经0.25%EDTA的PBS消化后,配成5 000/mL,然后将细胞以1 000/孔接种于96孔板,置于CO2培养箱培养24 h后加药,在培养箱中继续培养24 h、48 h、72 h、96 h、120 h、144 h、168 h后,加入10 μL CCK-8混合液,震荡10 s,继续培养2 h后吸出上清液450 nm测OD值,绘制生长曲线。
1.2.3 细胞集落形成测定(克隆形成法) 取对数生长期的A549细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,离心后,把细胞重悬在10%胎牛血清的DMEM培养液中备用。将细胞悬液稀释成500个/mL,以1 000/孔接种于6孔板中,并轻轻转动,使细胞分散均匀。置37oC、5%CO2培养箱培养1周,当培养皿中出现镜下可见的克隆时,加入以上浓度药物培养1周。终止培养。弃去上清液,用PBS小心浸洗2次。加纯甲醇5 mL,固定15 min。然后去固定液,加适量结晶紫应用染色液染30 min,然后用流水缓慢洗去染色液,空气干燥。将平皿倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆,并在显微镜(低倍镜)计数大于20个细胞的克隆数。
1.2.4 流式细胞术检测细胞周期及细胞凋亡率 用含10%胎牛血清的DMEM培养液调整细胞浓度为1×106/mL接种于10 cm皿中,置于5%CO2、37oC培养箱中培养12 h后,用含0.5%小牛血清的DMEM培养液继续培养24 h,使细胞周期同步化。加入Vit C(400 μg/mL),对照组不加药,分别作用6 h、12 h、24 h、48 h,收集贴壁细胞,制成单细胞悬液,70%乙醇固定,4oC保存过夜,-20oC保存(有效期为1周)。检测前用PBS洗去固定液,加入20 μL RnaseA,37oC孵育30 min后,暗处加PI染液,冰浴30 min,染色后以300目筛网过滤。调整细胞浓度为1×105/mL-1×106/mL,采用流式细胞仪检测,激发光源为氩离子,激发波长488 nm,用Multicycle DNA分析软件行细胞周期的测定。
1.2.5 RT-PCR检测Caspase-3 mRNA、Survivin mRNA的表达水平 取对数生长期A549细胞加入400 μg/mL的Vit C作用6 h、12 h、24 h、48 h后TRIzol一步法提取总RNA,取1 μL总RNA以10 μL体系逆转录,制备cDNA,并稀释30倍备用。Caspase-3 mRNA上游引物:5’-TGACCGAGGC TACATTCAGATGACACC-3’,下游引物:5’-CAAGAGAG TTGGGCTGACCAGAAACAC-3’,扩增产物365 bp;Survivin mRNA上游引物:5’-CCCTTTCTCAAGGACCACC GCATC-3’,下游引物:5’-CACTGAGAACGAGCCAGACT TGGC-3’,扩增产物133 bp;β-actin上游引物:5’-AGTGT GACGTGGACATCCGCA-3’,下游引物:5’-ATCCACAT CTGCTGGAAGGTGGAC-3’,扩增产物243 bp。扩增后取扩增产物用琼脂糖凝胶电泳检测。应用凝胶成像系统对电泳条带进行扫描分析,计算相对表达水平(与β-actin比值)。
1.2.6 统计分析 所有实验均重复3次,用Mean±SD表示,经SPSS 10.0进行两两比较的t检验,P<0.05为有统计学差异。
2 结果
2.1 细胞增殖情况及生长曲线 以40 μg/mL、400 μg/mL、4 mg/mL三种浓度Vit C干预A549抑制增殖情况见图1,结果表明400 μg/mL Vit C、4mg/mL Vit C明显抑制A549的增殖(P<0.05),而40 μg/mL Vit C抑制作用不明显(P>0.05);随着浓度的增大,3天抑瘤率明显增大,见图2。
2.2 细胞集落形成观察 A549细胞分别加入40 μg/mL Vit C、400 μg/mL Vit C、4 mg/mL Vit C,肉眼克隆见图3A,镜下计数见图3B,400 μg/mL Vit C、4mg/mL Vit C组明显抑制了肺癌A549细胞克隆的形成,与对照组、40 μg/mL Vit C 组相比有统计学差异(P<0.05)。
2.3 流式细胞仪检测细胞周期及凋亡实相结果 图4可见,临床用药量(400 μg/mL)的Vit C随着作用时间的延长,G0/G1期、S期的细胞明显增多,进入G2/M期的细胞明显减少,说明Vit C可以延长A549的细胞周期,从而抑制其增殖,当作用24 h、48 h后G0/G1期、S期的细胞明显增多,并且随着作用时间的延长细胞凋亡数明显增加。
2.4 RT-PCR检测Vit C对Caspase-3 mRNA、Survivin mRNA水平的影响 取对数生长期A549细胞,加入400 μg/mL的Vit C培养6 h、12 h、24 h、48 h后提取总RNA进行RTPCR,扩增产物用琼脂糖凝胶电泳检测,结果表明Vit C作用6 h后Caspase-3 mRNA的表达增高,随着作用时间的延长表达量无明显增多(P=0.001、0.002、0.002、0.003);随着Vit C作用时间的延长,Survivin mRNA的表达并未明显变化(P=0.959、0.552、0.23、0.173),见图5。
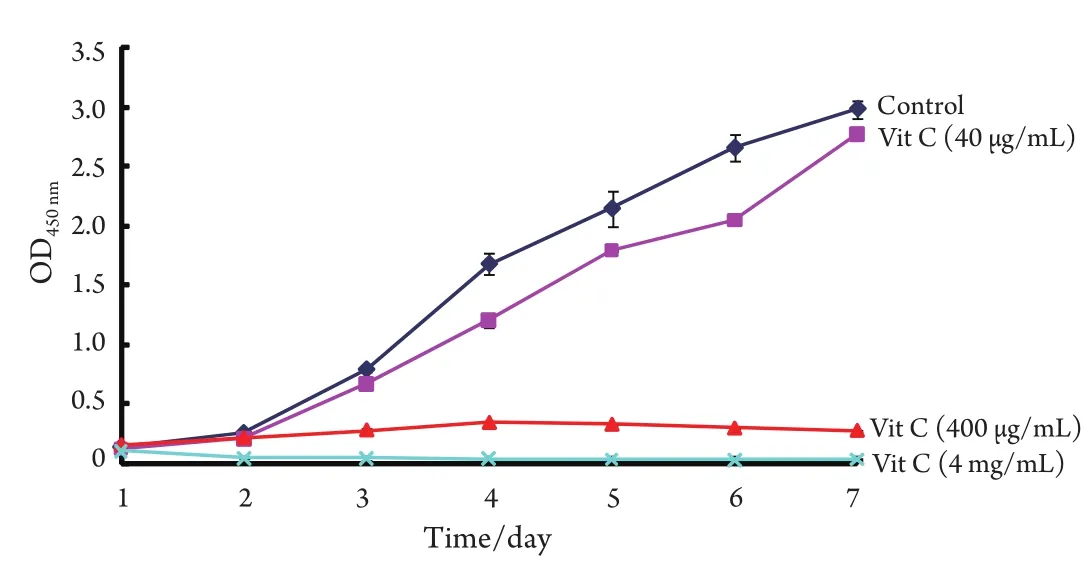
图 1 不同浓度Vit C作用A549细胞生长曲线对照组 vs Vit C(40 μg/mL)组:P>0.05;对照组 vs Vit C(400 μg/mL、4 mg/mL)组:P<0. 05;Vit C(40 μg/mL)组 vs Vit C(400 μg/mL、4 mg/mL)组:P<0.05。Fig 1 Cell proliferation curve of A549 cell with Vit C at different doses Control group vs Vit C (40 μg/mL) group: P>0.05;Control group vs Vit C (400 μg/mL, 4 mg/mL) group: P<0.05;Vit C (40 μg/mL) group vs Vit C (400 μg/mL, 4 mg/mL) group: P<0.05.

图 2 不同浓度Vit C作用A549瘤生长抑制率(第3天)随着Vit C浓度的增加,对A549第3天的生长抑制率也随着增高。Fig 2 Ratio of inhibition of A549 cell with Vit C at different doses (d3)The ratio of inhibition of A549 cell increased with the increase in the concentration of Vit C.
3 讨论

图 3 不同浓度Vit C作用A549后集落形成数Vit C(400 μg/mL)组、Vit C(4 mg/mL)与对照组及Vit C(40 μg/mL)组比明显抑制A549集落形成(P<0.05)。Fig 3 Colony of A549 cell with Vit C at different doses Compared with control group and Vit C group, Vit C (400 μg/mL) group and Vit C (4 mg/mL) group inhibited A549 colonies (P<0.05).
Vit C是具有许多生物学功能的水溶性己糖衍生物,它的分子式是C6H8O6,其分子中2位和3位碳原子的两个烯醇式羟基极易解离,释放出H+。通常情况下,我们普遍认为小剂量Vit C是天然抗氧化剂,通过还原作用清除氧自由基,而大剂量Vit C具有氧化作用[3-4]。而研究也主要集中于Vit C在小剂量时对肿瘤发生的预防作用,对肿瘤的治疗作用的研究还处于初始阶段。本研究发现Vit C在400 μg/mL时即可以明显抑制肺癌A549细胞的增殖(P<0.05),流式细胞仪检测发现400 μg/mL Vit C可以将A549细胞阻滞在G0/G1期及S期,使进入G2/M期的细胞明显减少,从而延长了细胞周期,并且发现随着作用时间的延长,可以明显促进A549细胞的凋亡。

图 4 400 μg/mL Vit C干预A549细胞不同时间后流式细胞仪检测凋亡和细胞周期变化结果与对照组、6 h、12 h组比较,24 h组、48 h组A549细胞明显被阻滞在G0/G1期和S期,凋亡率明显增加(P<0.05)。Fig 4 Changes of cell cycle and apoptosis after 400 μg/mL Vit C treated A549 cell different time Compared with control group, 6 h and 12 h groups, 48 h and 24 h groups blocked A549 cells in G0/G1 and S phase, and induced apoptosis markably (P<0.05).

图 5 400 μg/mL Vit C干预A549细胞不同时间对Caspase-3 mRNA、Survivin mRNA表达的影响Vit C作用6 h后Caspase-3 mRNA的表达增高,随着作用时间的延长表达量无明显增多;随着Vit C作用时间的延长Survivin mRNA的表达未见明显变化。Fig 5 Expression of Caspase-3 mRNA, Survivin mRNA after 400 μg/mL Vit C treated A549 cell different time The relative expression of Caspase-3 mRNA up-regulated when Vit C treated A549 cell 6 hours later and it no longer changced with time prolonged; the relative expression of Survivin mRNA was not significant change after Vit C treated A549 cell.
众所周知,凋亡逃逸是肿瘤发生、发展的重要机制之一。细胞凋亡主要通过线粒体通路、死亡受体通路和内质网通路启动凋亡。线粒体通路主要是含BH3结构域的Bcl-2家族成员与另外的Bcl-2家族成员(Bax亚家族成员Bax、Bak)等作用,导致后者的寡聚并插入线粒体膜,引起线粒体膜通透性改变,跨膜电位丢失,释放细胞色素C(Cyt C)和其它蛋白[5],Cyt C在ATPPdATP存在的情况下,Cyt C与凋亡蛋白酶活化因子(apoptotic protease activating factor, Apaf-1)形成多聚复合体,通过Apaf-1氨基端的Caspase募集结构域(caspase recruitment domain,CARD)募集胞质中的Caspase-9前体,并使其自我剪切活化并启动Caspase级联反应,激活下游的Caspase-3和Caspase-7,完成其相应底物的剪切,引起细胞凋亡[6];死亡受体通路主要机制是死亡配体与死亡受体激活无活性的pro-caspase-8变为有活性的Caspase-8。激活的Caspase-8不仅可激活下游效应Caspase裂解多种蛋白质而最终导致细胞凋亡,同时还可以降低线粒体内膜电位使Bc1-2家族成员裂解,导致Cyt C的释放[7],后者可与Apaf-1结合,在dATP的存在下活化Caspase-9,Caspase-9能激活下游效应Caspase-3[8]。而Caspase-3作为这两条通路上的下游共同基因,在细胞凋亡过程中起着至关重要的作用。本研究发现,随着作用时间的延长Vit C可以上调Caspase-3的表达,提示Vit C可能通过氧化作用进一步减少肿瘤细胞内本来就缺乏的过氧化物酶,并增加过氧化氢(H2O2)的产生[9]从而作用于pro-caspase激活Caspase-3诱导A549细胞凋亡。而作为最强的凋亡抑制基因,Survivin在肿瘤逃逸凋亡过程中有着不可忽视的作用,可直接与Caspase-3、Caspase-7结合并抑制它们的活性[10]而阻止肿瘤细胞凋亡的发生。本研究亦观察了Vit C对Survivin的影响,发现其并不明显下调Survivin mRNA的表达。因此我们认为,Vit C可能虽然未能下调Survivin mRNA的表达,但可能阻止Survivin蛋白与Caspase-3的结合,从而影响肿瘤细胞的凋亡过程。综上所述,我们认为在临床治疗量的Vit C即可以明显抑制肺癌A549的增殖,并将其阻滞在G0/G1期及S期,并且随着作用时间的延长,可以明显诱导肺癌A549的凋亡,其机制可能是通过上调Caspase-3的表达。因此,我们有理由相信Vit C作为肿瘤化疗的辅助用药在临床应用中有广阔的前景。

