BSD2000深部热疗联合PT方案化疗在非小细胞肺癌中的应用
杨孟祥 赵军 王彦文
恶性肿瘤已成为常见病、多发病,其死亡率已跃居所有疾病死因的第二位,其中肺癌在恶性肿瘤中的发病率及死亡率均占居首位,而非小细胞肺癌(non-small cell lung cancer, NSCLC)又约占肺癌的80%,化疗是治疗NSCLC的主要手段之一,但NSCLC对化疗不甚敏感,并且效果差、生存期短。为提高肿瘤的治疗效果,我院引进了目前先进的美国BSD2000相控阵聚焦深部肿瘤热疗系统,采用热疗联合化疗的方法治疗NSCLC 30例,以期取得较好疗效。
1 资料与方法
1.1 病例选择 入组的NSCLC患者,为无手术指征、或不愿手术治疗、或手术等治疗后复发的初次治疗者。入选条件:①经病理或细胞学检查证实为非小细胞肺癌;②有客观观察指标,影像学检查(CT、MRI)有可见肿瘤;③卡氏(Karnofsky, KPS)评分为60分以上,患者年龄≤70岁;④近1月内未接受过其它抗肿瘤治疗;⑤预计生存期>3个月,治疗前肝肾功能检查与心电图结果均正常。将符合以上条件的患者随机分为治疗组(热疗+化疗)和对照组(单纯化疗),每组各30例。两组病例的一般资料见表1。
1.2 治疗方法 治疗组:化疗方案PTX 135 mg/m2ivdirp 3 h qd d1+DDP 20 mg/m2ivdirp qd d1-5,同时于d1、d4化疗结束后2 h内进行BSD2000相控阵聚焦深部肿瘤热疗系统热疗1 h。21天为1周期,共3周期。热疗采用美国产BSD2000相控阵聚焦深部肿瘤热疗系统,其由8组偶极子天线构成环形阵列,产生平行人体长轴线的主电场,所有偶极子天线的辐射场通过相控阵聚集形成总的加热场。通过每组偶极子功率、振幅和相位的调配,在人体不同深度和范围内聚焦形成理想的加热区。让患者平躺在治疗平台上,将患者的CT或MRI数据输入计算机,通过软件计算对治疗靶区进行定位并建立治疗计划、调节治疗平台,使患者身体治疗靶区中心的横截面位于辐射器的中心;将测温探针在病灶体表投射区的中心及其周围区域呈梅花状布置,通过计算机软件进行无损测温,给辐射器水囊充水至满,激活治疗计划,使初始功率为200 W-300 W,依据测温系统数据及病人反应调整功率使病灶靶区温度保持在41oC-43oC。对照组:化疗方案PTX 135 mg/m2ivdirp 3 h qd d1+DDP 20 mg/m2ivdirp qd d1-5,每21天为1周期,共3周期,不进行热疗。
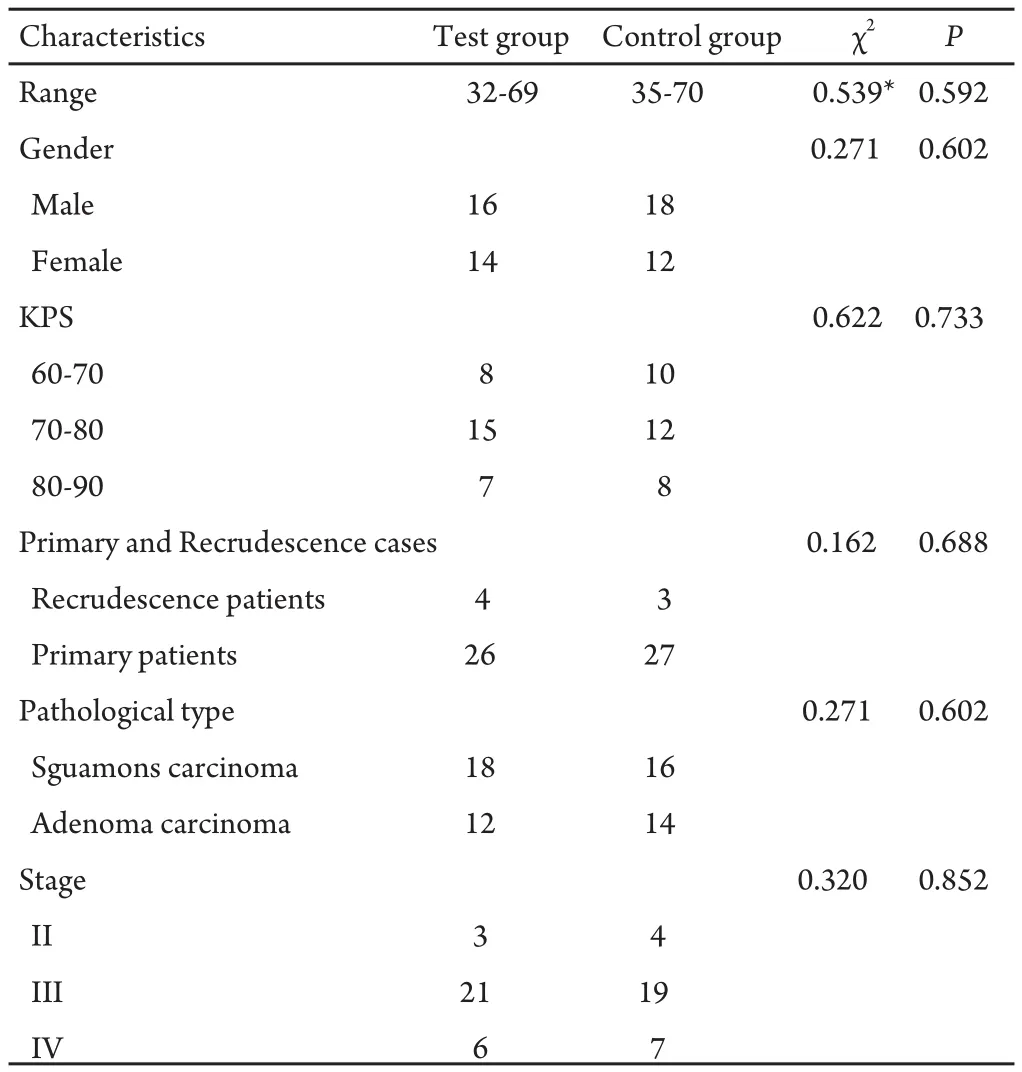
表 1 两组病例一般资料Tab 1 Patients’ characteristics in two groups
1.3 评价标准
1.3.1 近期疗效 两组第3周期治疗结束后及结束后4周各进行1次CT或MRI检查,按照WHO可测量实体肿瘤的近期疗效评判标准进行疗效评判。近期疗效分为完全缓解(complete response, CR)、部分缓解(partial response,PR)、稳定(stable disease, SD)及进展(progressive disease, PD),CR+PR为有效。
1.3.2 生存质量评价 用治疗前后患者一般状况KPS评分的变化反映患者生存质量的改善情况。增高:治疗后KPS评分较治疗前增加10分以上者;下降:治疗后KPS评分较治疗前减少10分以上者;稳定:治疗后KPS评分增加或减少不超过10分者。生存质量的评价以生存质量改善率来反映。生存质量改善率=治疗后KPS评分增高者总例数/每组总病例数×100%。
1.3.3 毒性反应 按照WHO抗癌药物急性及亚急性毒性反应标准进行观察,毒性反应分为0度-IV度。
1.4 统计学方法 两组间比较计数资料采用χ2检验,计量资料采用t检验,以P<0.05为有统计学差异。
2 结果
2.1 近期疗效 治疗后治疗组CR 2例,PR 17例,SD 6例,PD 5例,CR+PR=19例,有效率(response rate, RR)为63.33%;对照组CR 1例,PR 10例,SD 8例,PD 11例,CR+PR=11例,RR为36.67%。治疗组有效率明显高于对照组,两组比较有统计学差异(χ2=4.356, P=0.037)。
2.2 毒性反应 主要为骨髓抑制、胃肠道反应,治疗组与对照组(表2中分别简称T和C)相比无统计学差异(P>0.05)。其它不良反应为热疗时出现出汗、心跳加快和疲乏感,但均可耐受,且热疗结束后很快消失,无因热疗灼伤者。
2.3 生存质量改善率 治疗后治疗组KPS评分增高者为23例,稳定者3例,下降者4例,生存质量改善率为76.67%;对照组KPS评分增高者为12例,稳定者5例,下降者13例,生存质量改善率为40.00%。两组相比有统计学差异(χ2=6.648, P=0.010),治疗组生存质量改善率明显高于对照组。
3 讨论
NSCLC特别是晚期NSCLC预后差,生存期短,是威胁人们生命健康的主要疾病之一,其治疗模式是综合治疗,人们不断尝试及采用各种综合治疗模式来提高NSCLC的临床疗效,延长患者生存时间。热疗于1985年被美国FDA认证为继手术、放疗、化疗、生物治疗之后的第五大肿瘤治疗手段[1]。热疗联合化疗是近年来恶性肿瘤治疗的研究热点之一,热疗是利用物理能量在组织中积聚而产生热效应,使肿瘤组织温度上升到有效治疗温度并维持一段时间,以杀死癌细胞又不损伤正常细胞的一种治疗方法。同时热疗与化疗联合可增强治疗效果,有协同作用。研究[2]表明热疗能改变肿瘤组织的血流灌注及增加肿瘤细胞膜的通透性,提高化疗药在肿瘤细胞中的蓄积,增强化疗药的细胞毒作用,从而增强药物的抗癌效应,体外实验加热42oC、2 h能使一些化疗药物抗癌效果增强10倍-100倍。Mohamed等[3]研究了泰索帝、紫杉醇、草酸铂、吉西他滨和美法仑在中等温度(41.5oC, 30 min)下对小鼠自发纤维肉瘤的细胞毒性,发现热疗增加了泰索帝、吉西他滨的细胞毒性。
热疗还能逆转肿瘤多药耐药。冷卫东等[4]研究发现Tca 8113/CBDEA细胞在热疗后4 h和24 h MDR1、MRP1、GST-π耐药蛋白表达量明显下降(P<0.01),Tca 8113细胞的耐药基因表达在4 h和24 h时亦有明显下降,热疗后肿瘤细胞内阿霉素(ADM)浓度有明显上升,表明热疗联合化疗可以逆转肿瘤细胞的耐药性,提高治疗效果。为了解热疗联合PT方案化疗对NSCLC是否有协同治疗作用,我们对其进行了临床研究,结果显示热化疗组CR 2例、PR 17例,有效率(RR)为63.33%,对照组CR 1例、PR 10例,RR为36.67%,治疗组有效率明显高于对照组(P<0.05),表明热疗与PT方案联合治疗NSCLC能明显提高疗效,二者有协同治疗作用;而且生存质量改善率热化疗组较单纯化疗组亦明显提高(P<0.05),这可能与前者疗效好有关,同时可能也与热疗提高机体免疫力有关,如局部热疗可使NK细胞、T淋巴细胞的活性增强等[5]。毒副作用二者无明显差异,热化疗组未出现热疗常见的皮肤灼伤等副作用,考虑与BSD-2000有先进的定位聚焦、水囊保护及测温系统有关。该研究结果表明热疗联合PT方案化疗是治疗NSCLC的有效方法,其它临床报道也证明热疗联合化疗能提高治疗效果,提示热疗与PT方案联合治疗NSCLC具有可行性。刘海波等[6]对治疗组采用盖诺+顺铂方案化疗,每周期化疗期间联合5次局部区域热疗,共2个周期,而对照组则盖诺+顺铂方案单纯化疗2个周期。结果治疗组33例治疗后有效率63. 6%,对照组32例治疗后有效率37. 5%。孙秀梅等[7]将晚期肺癌所致恶性胸腔积液的初治患者60例分为热化疗组和单纯化疗两组,热化疗组给予吉西他滨1 000 mg/m2,d1、d8,胸腔注射顺铂40 mg/次,隔日1次,共3次,胸腔局部化疗24 h后患侧胸腔深部热疗,治疗4个周期,单纯化疗组同方案化疗4周期,结果热化疗组控制胸水的有效率为90.0%,单纯化疗组为66.7%。
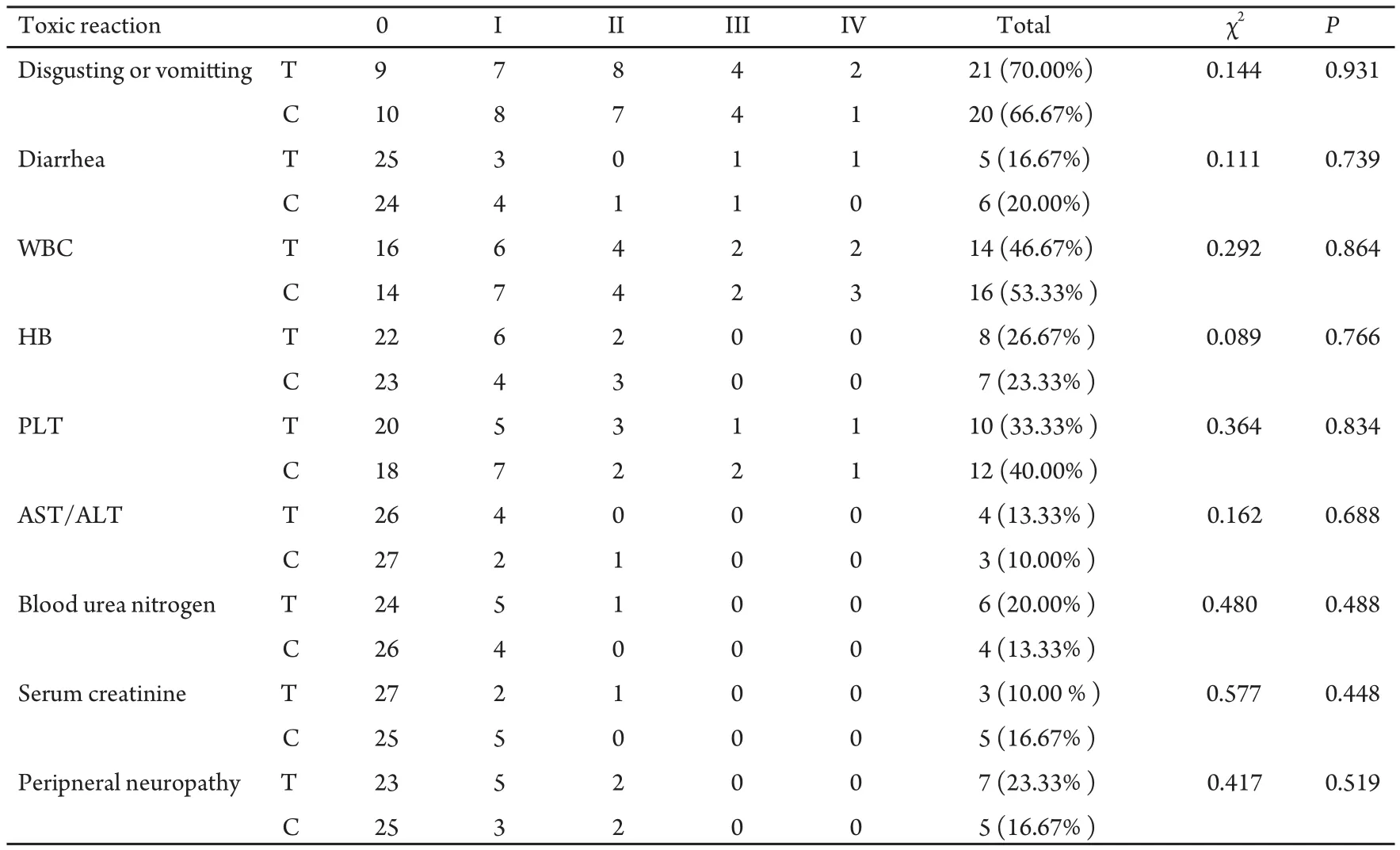
表 2 两组患者毒性反应比较Tab 2 Comparisons of toxic reactin between two groups
总之,研究表明热疗联合PT方案化疗治疗NSCLC能提高治疗效果,可改善病人生存质量,不增加毒副作用,是值得推广和进一步研究的一种治疗方法。

