胃肿瘤MR扩散加权成像中扩散敏感因子选择的初步研究
许传军 ,刘林祥 ,李晓东 ,王金亮 ,蒋学美 ,朱西琪
(1.东南大学附属第二医院,江苏 南京 210003;2.泰山医学院放射学院,山东 泰安 271016;3.天津医科大学总医院放射科,天津 300052;4.山东省临沂市人民医院放射科,山东 临沂 276000)
扩散加权成像是唯一能在活体检测组织内水分子扩散运动的无创影像检查技术,但因其对运动极为敏感,限制了其在胃肠道应用。随着MR快速平面回波成像(EPI)的出现,及并行采集成像技术(ASSET)、分次屏气和多信号平均技术解决了许多与运动相关的问题,在腹部应用的研究已愈来愈多。DWI在腹部的应用,b值的选择至关重要。Ichikawa等[1]及Yamada等[2]研究表明用EPI技术进行扩散成像时用小b值,可反映组织的血流灌注。b值越大,DWI及ADC值受血流灌注因素的影响就越小,也就越接近于水分子的扩散运动。本文笔者初步探讨能够反映接近水分子扩散真实情况的合适b值。
1 材料与方法
1.1 患者资料
回顾分析32例手术病理证实胃肿瘤性病变患者MR原始资料,胃癌病人未进行任何形式的放化疗,检查与手术时间未超过3天。男22例,女10例,年龄24~81岁,中位年龄53岁。其中包括胃癌24例(胃窦癌15例,胃底贲门癌3例,胃体癌2例,全胃癌2例,幽门管癌1例,胃底癌1例);其它肿瘤8例,包括胃间质瘤4例,胃平滑肌瘤2例,胃管状腺瘤2例。
1.2 MR设备及成像方法
检查前8~12小时禁食,如无禁忌症,扫描前10分钟肌注山琅珰碱20mg,饮水 600~800ml,使胃充盈。患者取仰卧位。采取呼气后屏气。采用美国产Signa Twin Speed EXCITEⅡ1.5T MRI System超导型双梯度扫描仪,8通道TORSOPA腹部相控阵表面线圈结合AASET技术,所有病例均进行DWI和常规 MRI。
1.2.1 DWI检查方法
采用单次激发EPI序列,扩散敏感系数b值分别 为 400s/mm2、600s/mm2、800s/mm2、1000s/mm2。 其余 成 像 参 数 相 同 ,TR 1000ms,TE 73.4ms,NEX 4次,层厚 5mm,层间距 1mm,FOV (38~40)cm×(38~40)cm;矩阵 128×128;同时在 x、y、z轴三方向施加敏感梯度脉冲。据病人耐受情况,分2~3次屏气完成,尽量保持屏气基线一致。
1.2.2 常规MRI
采用呼吸门控快速恢复快速自旋回波(FRFSE)序列,TR 6000ms,TE 90.1ms,NEX 2 次, 层厚 5mm,层间距 1mm,FOV 128cm×128cm,矩阵 128×128,翻转角90°。T1WI采用屏气FSPGR序列TR 180ms,TE 1.8ms,NEX 1 次,翻转角 80°,层厚 5mm,层间距1mm,FOV 38cm×38cm,矩阵 320×224。
1.3 图像及后处理方法
将DWI图像信息传输到GE ADW4.2工作站,应用Functool 2.0软件包对弥散图像进行后处理。①感兴趣区(ROI)的选择:参考常规 T2WI、T1WI、和DWI图像,于三个连续层面分别各设置一个ROI(各层面ROI尽量大小一致)进行测量取其平均值作为最终测得值。②ADC值的测量方法:以DWI边缘划线为首选测量方法,在系统自行生成的表观弥散系数(ADC)图上选择ROI,记录ADC值。如果图像由于宏观运动发生,按照公式ADC=[In(S低/S高)]/(b高-b低)计算,式中 S低、S高分别指用低、高 b值成像所测信号值,In为自然对数。分别采用b=1000~0、800~0、600~0、400~0s/mm2计算 4 组 ADC 值。 ③胃肿瘤组织切片的制作和细胞计数的测量:将手术标本取其肿瘤中心部分,制成切片,然后在Olympus三目显微镜(BX-50)下用100倍光镜采图。图像用美国产IPP4.55图像分析系统进行细胞密度统计,每份标本多次计数取平均值。④利用工作站测量胃内自由水的信号,及频率编码方向一致的背景信号。分别计算不同 b值时 SIR水-背景噪声。
1.4 统计学方法
应用SPSS 12.0统计分析软件,对数据进行正态分布性检验。确定正态分布后。采用双向变量相关分析法,分别计算不同b值下获得的胃良恶性肿瘤ADC值与细胞密度相关性。用单因素方差分析对不同 b 值时,SIR水-背景噪声进行统计分析。
2 结果
当 b 值 分 别 为 400s/mm2、600s/mm2、800s/mm2、1000s/mm2时,胃腔内自由水与背景噪声比(SIR水-背景噪声)分别为:2.036、1.541、1.148、1.109, 数据符合正态性分布 (F=40.12,P<0.05)。 当 b 值为 400s/mm2、600s/mm2、800s/mm2时,SIR水-背景噪声之间具有统计学差异(P<0.05),b 值为 800s/mm2、1000s/mm2时,比值接近1,无统计学差异(P>0.05)。采用双变量相关分析,不同b值时,胃肿瘤病变ADC值与细胞密度均呈负相关(P<0.05),与相关文献报道一致,相关系数r分别为:-0.3458、-0.3789、-0.5865、-0.5231,并且在 b 值为800s/mm2时其相关程度最高(r=-0.5865)(见表1)。

表1 不同b值时的ADC、SIR及细胞密度与ADC相关性
3 讨论
DWI在腹部的应用,选择合适的b值至关重要,特别是对扩散成像技术在胃的应用。Ichikawa及Yamada等[1-4]研究表明用EPI技术进行扩散成像时用小b值,测得的水分子的运动主要来自运动较快的血流,故所得的ADC值偏大,所以用小b值可反映组织的血流灌注。而b越大,DWI及ADC值受血流灌注因素的影响就越小,也就越接近于水分子的扩散运动。DWI除反映水分子扩散及血流灌注外,还受到T2透射效应及宏观运动的影响,目前的解决方法仅是利用大b值,但是随着b值的增大,所得图像的伪影会增多,SNR会下降。随着ASSET技术及多信号平均技术的应用,进一步放宽了b值的限制,目前常用的b值为500~1500s/mm2[5]。笔者尝试800s/mm2、1000s/mm2的b值获得较满意的图像。
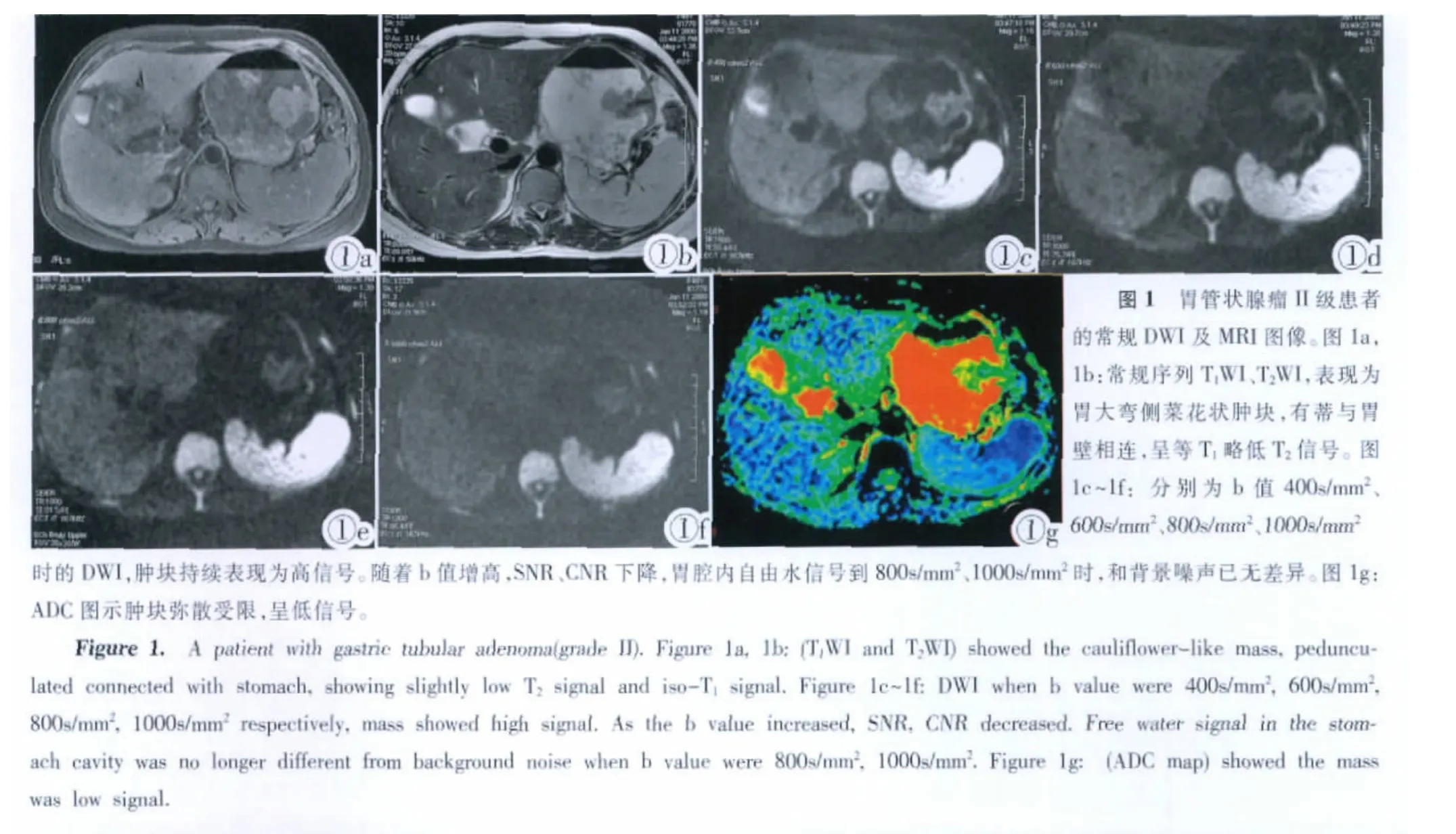
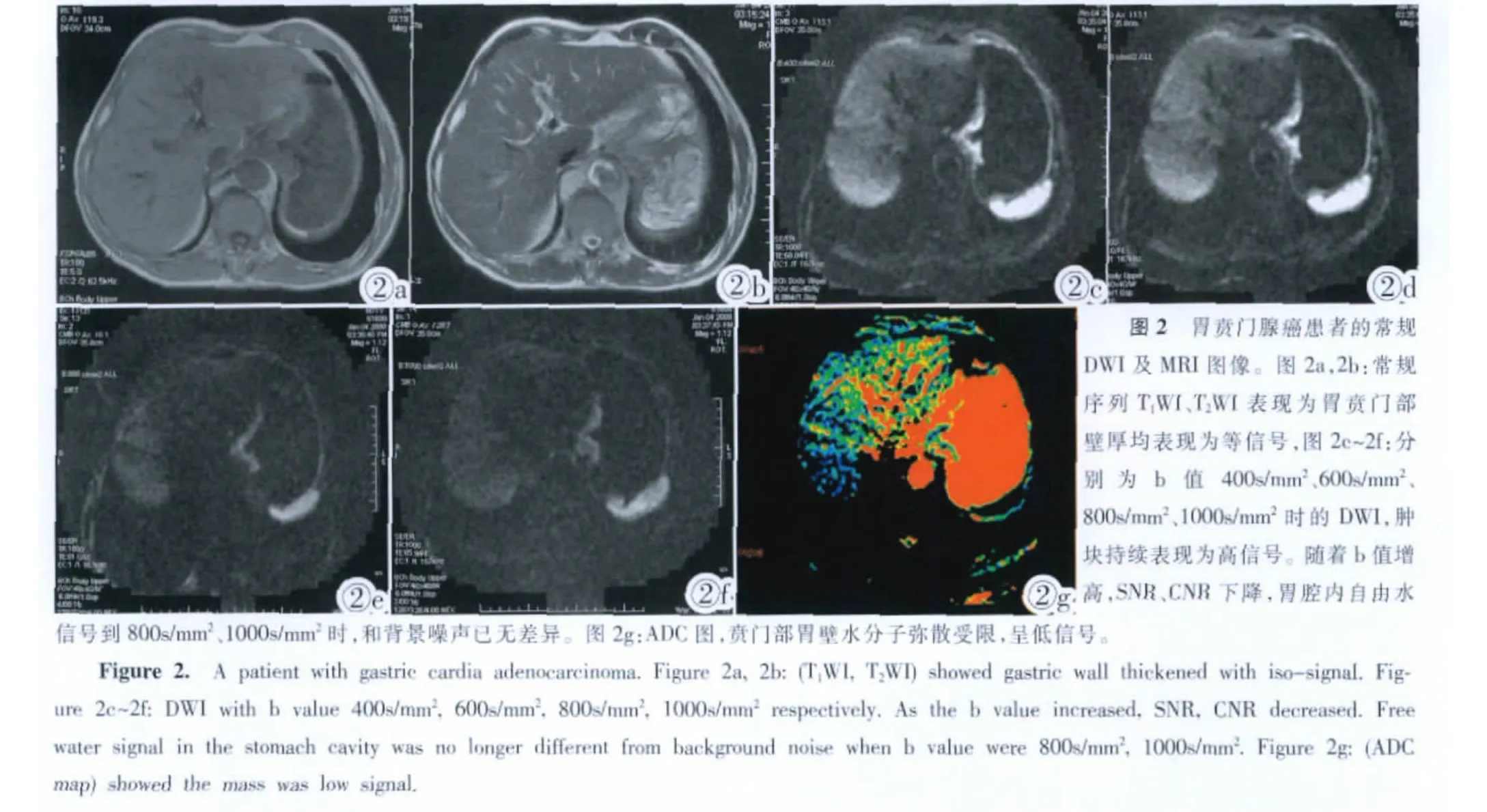
本研究结果发现 b值为 400s/mm2、600s/mm2、800s/mm2、1000s/mm2时所测的ADC值逐渐降低,并且之间存在统计学差异(P<0.05),与上述提及文献报道一致。可能与血流灌注和T2透射效应的影响有关,随着b值的升高,受二者影响逐渐降低。另外本研究对上述不同b值时的胃腔内自由水和背景信号比值进行测量统计,发现随着b值升高,胃腔内自由水信号逐渐下降,水背景噪声比(SIR水-背景噪声)逐渐降低,b 值为 400s/mm2、600s/mm2、800s/mm2时,之间具有统计学差异 (P<0.05),b值为 800s/mm2、1000s/mm2时,比值接近1,二者间无统计学差异(P>0.05)。可以认为此时胃腔内自由水得到较好的抑制,T2透射效应基本消除。
近年来大量的研究证明,肿瘤及组织的ADC值和细胞密度间存在负相关。Sugahara等[3]对脑肿瘤ADC值和细胞密度之间的相关性已经通过组织形态学分析证实。Chenevert等[4]对脑肿瘤化疗过程中ADC值变化的研究也证实细胞密度和ADC值之间的负相关性。有作者报道肝脏、乳腺肿瘤、前列腺肿瘤细胞密度和ADC之间都存在负相关性[6-11]。
笔者对胃肿瘤ADC值与细胞密度之间进行统计分析,发现胃肿瘤的细胞密度与ADC值之间同样存在负相关,与上述文献报道一致。根据以上研究结果,既然二者间存在负相关,笔者将这种相关性利用反证方法用于b值的选择,可以认为胃肿瘤ADC值与细胞密度相关性最佳时,此时b值最能反映水分子扩散的真实情况。不同b值下测量的ADC值与细胞计数进行相关性分析发现b值为800s/mm2时,其相关性最好(r=-0.5865),可近似认为此时能最好的反应组织的水分子扩散的实际状态。
综合以上胃腔内水-背景信号强度比(SIR水-背景信号),及ADC值和细胞密度间相关性的结果,可以认为b值为800s/mm2是胃肿瘤DWI成像的最佳b值。
本研究仅初步从胃腔内自由水背景噪声比及ADC值与细胞密度间的相关性对最佳b值进行间接筛选和评估。但由于DWI生物及物理学机理非常复杂,很多方面尚处于研究阶段,是否会有更佳的评价方法,需待更加深入的研究。另外DWI用于腹部尚存在较多问题:较小肿瘤无法测量ADC值或存在较大偏差;关于b值选择,大b值能提高ADC对分子扩散的真实反映度,但与图像质量的矛盾很难协调,胃的肿瘤性病变DWI目前多应用头部序列或改良序列,存在较多问题。另外由于各家选用的成像仪和参数不同,故各家测得的各脏器、病变的ADC值存在较大的差异[12]。但毋庸置疑 ,随着磁共振软硬件技术的进一步发展,以及对DWI生物及物理学机理的进一步研究,弥散加权成像作为常规MRI序列的补充,可为胃良恶性肿瘤的鉴别诊断提供新的信息,并为肿瘤学的研究提供更新的评价方法。
]
[1]Ichikawa,Haradame H,Hachiya J,et al.Diffusion-weighted MR imaging with single shot echo-planar imaging in the upper abdomen:preliminary clinical experience in 61 patients[J].Abdom Imaging,1999,24(5):456-461.
[2]Yamada I,Aung W,Himeno Y,et al.Diffusion coefficients in abdominal organs and hepatic lesions:evaluation with intravoxel in coherent motion echo-planar MR imaging[J].Radiology,1999,210(3):617-623.
[3]Sugahara T,Korogi Y,Kochi M,et al.Usefulness of diffusion weighted MRI with echo-planar technique in the evaluation of cellularity in gliomas[J].J Magn Reson Imaging,1999,9(1):53-60.
[4]Chenevert TL,Stegman LD,Taylor JM,et al.Diffusion magnetic resonance imaging:an early surrogate marker of therapeutic efficacy in brain tumors[J].J Natl Cancer Inst,2000,9(2):2029-2036.
[5]杨正汉,谢敬霞,章跃武,等.肝硬化的磁共振扩散加权成像研究[J]. 中国医学影像技术,2002,18(9):907-909.
[6]Guo Y,Wang F,Cai Y,et al.Comparison of apparent diffusion coefficient(ADC)with histological cellularity in breast tumors[abstract].Scotland Glasgow:Proceedings of the 9 Annual Meeting of ISMRM,2001.23-26.
[7]Woodhams R,Matsunaga K,Iwabuchi K,et al.Diffusion-weighted imaging of malignant breast tumors:the usefulness of apparent diffusion coefficient(ADC)value and ADC map for the detection of malignant breast tumors and evaluation of cancer extension[J].J Comput Assist Tomogr,2005,29(5):644-649.
[8]Wang XY,Li FY,Xu YF,et al.Diffusion weighted imaging in the evaluation of prostatic cancer recurrence with previous radical prostatectomy[R].RSNA,2005,LPL05-02.
[9]Seitz RJ,Meisel S,Weller P,et al.Initial ischemic event:perfusion weighted MR imaging and apparent diffusion coefficient for stroke evolution[J].Radiology,2005,237(3):1020-1028.
[10]Jacobs MA,Herskovits EH,Kim HS.Uterine fibroids:diffusion weighted MR imaging for monitoring therapy with focused ultrasound surgery preliminary study[J].Radiology,2005,236(1):196-203.
[11]Koinuma M,Ohashi I,Hanafusa K,et al.Apparent diffusion coefficient measurements with diffusion-weighted magnetic resonance imaging for evaluation of hepatic fibrosis[J].J Magn Reson Imaging,2005,22(1):80-85.
[12]周诚,杨正汉,叶晓华.CT、MRI功能成像在肝脏病变的应用进展[J]. 中国医学计算机成像杂志,2004,10(5):329-337.

