缺血性与非缺血性心肌病左室收缩不同步的对比研究
刘东惠,李京杰
(1.黑龙江省双城市人民医院超声科,黑龙江 双城 150100;2.哈尔滨市儿童医院放射科,黑龙江 哈尔滨 150001)
充血性心力衰竭(CHF)是心脏病的终末期表现,也是其致死的主要原因。它不仅表现心肌收缩力下降,同时有相当比例的心肌收缩失同步化,心脏不同步运动部位及程度的判定对治疗方案的制定和疗效的评价均有重要意义[1]。缺血性心肌病(ICM)和扩张型心肌病(DCM)是引起CHF的两种常见原因,本文应用组织同步显像技术(TSI)对比分析ICM和DCM患者左室内不同步性特征,旨在为临床诊疗提供更多参考依据。
1 资料与方法
1.1 研究对象
DCM和ICM患者的诊断符合1995年WHO/国际心脏病学会联合会(ISFC)提出的心肌病诊断标准[2]。DCM组:临床确诊为DCM的患者23例,其中男16例,女7例,年龄35~51岁,平均(44.5±13.79)岁。NYHA分级≥Ⅲ级;左室射血分数(LVEF)≤35%;左心室舒张末期内径≥60mm。所有患者均无冠心病病史,其中17例患者经冠脉造影检查,排除了冠脉病变,另外5人经心电图和实验室检查除外了心肌缺血病变。
ICM组:临床确诊为ICM的患者20例,其中男15例,女5例,年龄 49~73岁,平均(64.2±13.7)岁。 NYHA 分级≥Ⅲ级;LVEF≤35%;左心室舒张末期内径≥60mm;有明确的心绞痛或心肌梗死病史大于3个月,冠脉造影结果阳性;排除了扩张型心肌病、高血压性心脏病等其他原因所致的心脏扩大及心力衰竭者。
对照组:随机选取健康体检患者30例,其中男19例,女11 例,年龄 30~64 岁,平均(48.2±14.2)岁。 经体检、心电图、超声心动图、冠状动脉造影证实无心脏疾患。所有受检者均排除心律失常,各组间临床基本资料比较见表1。

表1 对照组、ICM组和DCM组基本资料比较
1.2 仪器与方法
应用GE公司生产的Vivid 7超声诊断仪,内置Echo PAC数字超声工作站,配有TSI图像分析与后处理软件。受检者左侧卧位,同步监测心电图,常规进行超声心动图检查,采集心尖四腔观、二腔观及左室长轴观3个心动周期的组织速度成像及TSI动态图像,进行实时直接测定或存入E-choPAC工作站留待脱机分析。
图像分析:使用TSI分析软件,将二维超声图像冻结并回放到TSI末期,取样点分别放于左心室前壁、下壁、前间隔、后壁、侧壁、后间隔的基底段和中间段共12个节段的心肌,获取心肌组织的收缩期达峰值速度时间(Ts),仪器自动计算左室收缩同步性参数,包括间隔后壁间延迟(△TS-P)、间隔侧壁间延迟(△TS-L)、基底段最大延迟(△TB-max)、基底段达峰值时间标准差(△TB-SD)、所有节段最大延迟(△Tmax)和左室所有节段标准差(TSD)。以上各值均测量3次,取其平均值。采用双平面Simpson法计算LVEF。
1.3 统计学方法
使用SPSS 11.0软件包,计量资料以均数±标准差表示,组间比较采用方差分析,组间两两比较采用Q检验,ICM组和DCM组最大延迟部位在左室各壁分布比例的比较应用χ2检验,P<0.05为差异有统计学意义。
2 结果
分别计算左室六个壁每个室壁基底段和中间段Ts的平均值。做为该壁的平均达峰值速度时间,如图1所示,与对照组相比,DCM组和ICM组各壁的达峰时间均延长,差异有统计学意义(P<0.05 或 P<001)。
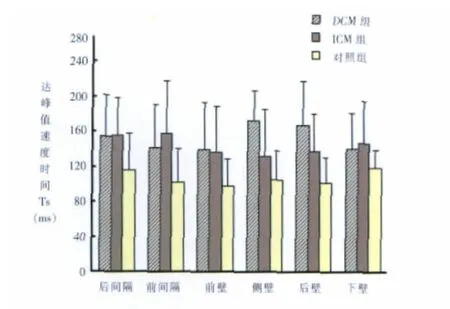
图1 DCM组、ICM组和对照组左室各壁Ts比较Figure 1. Comparison of Ts in left ventricle among the control group,ICM group and the DCM group.
DCM组和ICM组左室壁收缩运动存在差异,收缩最延迟处位于各室壁的百分比如图2,图3所示,DCM组收缩最延迟处位于左室各壁的比例为前壁4%、侧壁38%、后壁21%、下壁17%、后间隔17%和前间隔12%,ICM组收缩最延迟处位于左室各壁的比例为前壁10%、侧壁10%、后壁5%、下壁25%、后间隔15%和前间隔35%,DCM患者收缩最延迟的部位多位于左室侧壁和后壁,ICM患者收缩最延迟的部位多位于室间隔与左室下壁,两组间的构成比存在差异 (P<0.05)。DCM组和ICM组间比较侧壁及后壁的延迟差异有统计学意义。
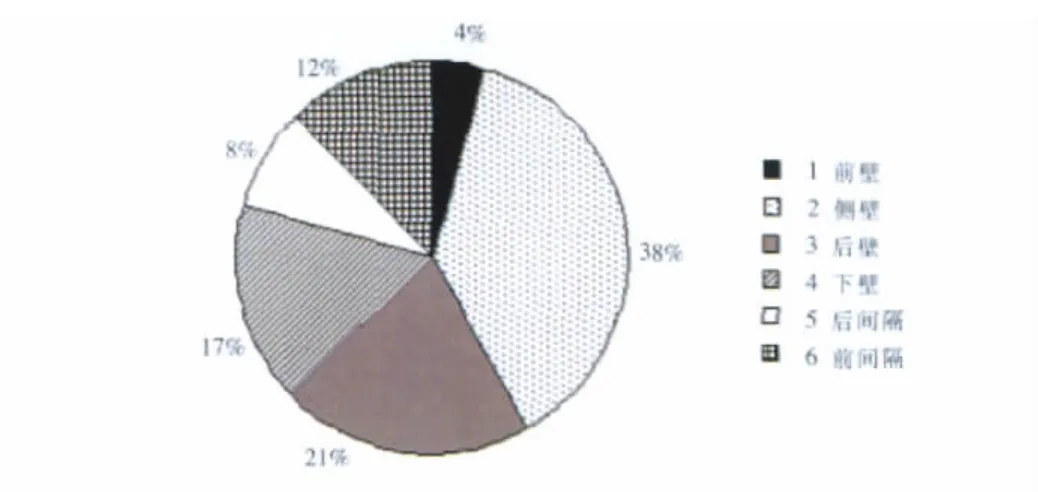
图2 DCM组左室收缩最延迟部位在各壁分布示意图。Figure 2. The distribution of most dalayed left ventricular wall systole in DCM patients.
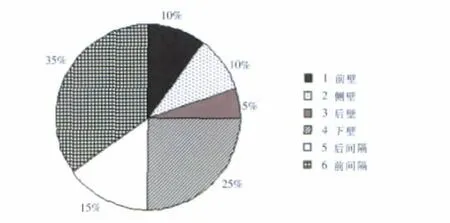
图3 ICM组左室收缩最延迟部位在各壁分布示意图。Figure 3. The distribution of most delayed ventricular wall systole in ICM patients.
与对照组相比,DCM组和ICM组的△TB-max、△TB-SD、△T-max和TSD均明显增高。DCM组和ICM组比较,仅TSD在两组间的差异有统计学意义(表2)。
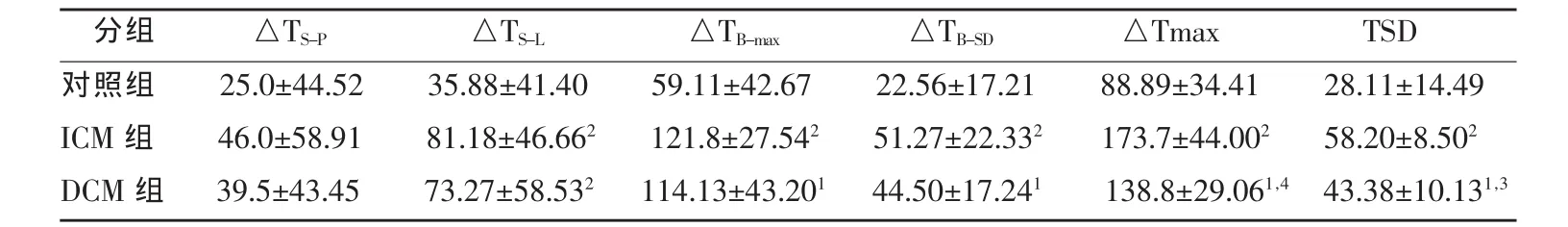
表2 对照组、ICM组和DCM组左室同步性参数比较
3 讨论
研究表明,充血性心力衰竭患者普遍存在不同程度的心室内收缩不同步。心室内收缩不同步与患者的预后密切相关,是不良心脏事件的独立危险因素[3-4]。它对于心脏再同步化治疗(CRT)适应症的选择和疗效判定具有重要意义。目前在临床上超声心动图被认为是评价心肌收缩同步性最方便有效的方法之一,TSI由组织速度显像技术发展而来,它对达峰值流速时间进行彩色编码,可快速定量测量各室壁节段的TS,并自动计算左室整体的同步性参数,是目前评价心脏同步性收缩较为常用的一种方法[5]。
本文应用TSI技术观察DCM和ICM患者左室内不同步运动,并与健康对照组进行比较,研究结果显示,DCM组和ICM组各室壁Ts与对照组相比均有不同程度的延迟,说明DCM和ICM患者普遍存在左室内运动的不同步,这与以往研究结果一致[6],此外,ICM患者最大延迟多发生于间隔和下壁,DCM患者的最大延迟部位多位于侧后壁。这与Vande等[7]和Bax等[8]的研究结果一致,但与Yu等[9]的研究存在差异,Yu等研究结果显示缺血性心肌病患者心脏最不同步的部位多位于后壁,其次为侧壁,不同研究之间的差异同时也说明缺血性心肌病患者中,左心室收缩最延迟的部位变化较大。ICM心肌缺血部位与病变的冠状血管分布走行密切相关,缺血严重的部位往往运动延迟较重,本组病例中,ICM患者均为多支病变,且患者均有不同程度的前降支受累,因此室间隔的延迟程度较重,因此在评价ICM患者心肌运动同步性时应结合其病变部位和程度,有助于准确判定。
本研究还发现△Tmax和TSD是反映左室内收缩不同步的较好指标。尽管DCM患者局部的达峰时间高于ICM组,但整体TSD却略低于ICM组,这可能是因为DCM患者室壁各个部位病变程度较一致,室壁运动幅度减弱程度也相对一致,且DCM患者早期即有收缩功能受损,因此表现为各室壁心肌收缩延迟较重,但TSD是对左室内各节段运动不同步的离散度进行评价,反映了左室整体运动的不同步性,ICM患者以节段性运动异常为主,部分非缺血心肌及侧支循环的建立均有助于减轻部分节段的延迟,因此在整体上表现为不同节段间运动延迟时间的差异较大。
总之,缺血性和非缺血性患者均存在左室心肌运动不同步,且二者的延迟收缩部位的分布存在差异,对左室不同步运动的准确判定才能够为临床诊疗提供更多有价值的信息。
]
[1]Fabian K,Rona KR,Hans JB,et al.Tissue Doppler echocardiography and biventricular pacing in heart failure:Patient selection,procedural guidance,follow-up,quantification of success[J].Cardiovasc Ultrasound,2004,2:17.
[2]Richardson P,McKenna W,Bristow M,et al.Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of Cardiomyopathies[J].Circulation,1996,93:841-842.
[3]Sander GM,Jeroen JB,Lieselot van E,et al.Comparison of Benefits from Cardiac Resynchronization Therapy in Patients With Ischemic Cardiomyopathy Versus Idiopathic Dilated Cardiomyopathy[J].Am J Cardiol,2004,93:860-863.
[4]Chalil S,Stegemann B,Muhyaldeen S,et al.Intraventricular dyssynchrony predicts mortality and morbidity after cardiac resynchronization therapy:a study using cardiovascular magnetic resonance tissue synchronization imaging[J].J Am Coll Cardiol,2007,50:243-252.
[5]Yu CM,Zhang Q,Fung JWH.A Novel Tool to Assess Systolic Asynchrony and Identify Responders of Cardiac Resynchronization Therapy by Tissue Synchronization Imaging[J].J Am Coll Cardiol,2005,45:677-684.
[6]Turner MS,Bleasdale RA,Vinereanu D,et al.Electrical and Mechanical Components of Dyssynchrony in Heart Failure Patients With Normal QRS Duration and Left Bundle-Branch Block:Impact of Biventricular Pacing[J].Circulation,2004,109:2544-2549.
[7]Vande VN,De Sutter J,Van Camp G,et al.Global and regional parameters of dyssynchrony in ischemic and nonischemic cardiomyopathy[J].Am J Cardiol,2005,95(3):421-423.
[8]Bax JJ,Marwick TH,Molhoek SG,et al.Left ventricular dyssynchrony predicts benefit of cardiac resynchronization therapy in patients with end-stage heart failure before pacemaker implantation[J].Am J Cardiol,2003,92(10):1238-1240.
[9]Yu CM,Fung JW,Zhang Q,et al.Tissue Doppler imaging is superior to strain rate imaging and postsystolic shortening on the prediction of reverse remodeling in both ischemic and nonischemic heart failure after cardiac resynchronization therapy[J].Circulation,2004,110(1):66-73.

