肺腺癌组织中IGF-IR表达与患者临床病理因素及预后的相关性
张雪艳 冯久贤 沙惠芳 黄进肃 韩宝惠
近年来,肺癌发病率不断升高,而非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌的80%。其中肺腺癌是NSCLC最主要的组织类型之一,其发病率不断升高,因而,对肺腺癌的细胞起源及癌变机制的研究受到国内外学者的高度关注。胰岛素样生长因子I受体(insulin-like growth factor I receptor, IGF-IR)是多种生长因子调控枢纽,在细胞生长、分化过程中起重要调节作用。越来越多的资料表明,IGF-IR在肿瘤组织中存在不同程度的异常表达,并在肿瘤细胞分化分裂、增殖凋亡中扮演重要角色。本研究旨在探讨IGF-IR在肺腺癌中的表达及其临床意义。
1 资料与方法
1.1 临床资料 收集上海交通大学附属胸科医院1999年1月-2004年6月经外科根治性手术切除且随访资料完整的126例肺腺癌患者纳入本研究。患者年龄22岁-80岁,中位年龄57岁;男性65例,女性61例。按国际抗癌联盟(International Union Against Cancer, UICC)标准进行分期,Ib期30例,II期39例,IIIa期57例。高分化30例,中分化76例,低分化20例。随访从手术之日开始,末次随访日为2009年12月15日,本组患者的随访时间均>5年。所有患者术前均未进行过放疗或化疗,术后接受2次-4次以铂类为主的化疗。手术标本经4%甲醛固定,石蜡包埋,制成4 μm厚切片。由两位病理科主任、副主任对原发病灶的病理切片进行审核,明确病理诊断。
1.2 免疫组化检测IGF-IR表达 免疫组化技术采用Supervision法,肺腺癌患者癌旁的正常肺组织作为阴性对照。具体操作步骤如下:石蜡切片60oC,烘片1 h-2 h;二甲苯脱蜡3次,每次20 min,梯度乙醇水化后蒸馏水冲洗3次;PBS冲洗,5 min×3次;二甲苯脱蜡后,用柠檬酸缓冲液pH 6.0(上海长岛生物技术有限公司)进行高温高压抗原修复,修复时间120 s;用PBS冲洗3次,每次3 min-5 min;切片滴加兔抗人IGF-IR单克隆抗体(DA-KO公司)50 μL,于4oC环境过夜;用PBS冲洗3次,每次3 min-5 min;滴加50 μL第二抗体Supervision(上海长岛生物技术有限公司)(按试剂盒使用),室温下孵育40 min;用PBS冲洗3次,每次3 min-5 min;每张切片滴两滴约100 μL的DAB显色液,显微镜下观察3 min-5 min;苏木精染色5 min,冲洗20 min;1%盐酸酒精分化,冲洗20 min;切片经95%、100%乙醇各两档脱水,放入电热恒温鼓风干燥箱风干;二甲苯透明,中性树脂封固。
1.3 免疫组化评定标准 免疫组化结果由两位病理科主任、副主任对切片进行审核。IGF-IR表达主要以细胞膜及胞质混合型表达为主,阳性染色呈棕黄色颗粒。评定用半定量方法:总的评定分数根据染色阳性细胞数的比率和染色强度。染色阳性细胞定量:<5%为0分,5%-25%为1分,26%-50%为2分,>50%为3分;染色强度:无染色为0分,染黄色为1分,染棕色为2分。最终的表达评定分数为:染色细胞定量分数×染色强度分数,分别为0分-1分为阴性(-),2分-3分为弱阳性(+),4分-6分为阳性(++)。
1.4 统计分析 实验数据应用SPSS 11.0统计软件进行分析处理。组间率的比较采用χ2检验。Kaplan-Meier方法计算生存曲线,用Log-rank进行差异检验。生存分析采用Cox单因素及多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 IGF-IR在肺腺癌组织中的表达 IGF-IR主要以细胞膜及胞质混合型表达为主,阳性染色呈棕黄色颗粒(图1);126例患者中89例表达阳性,其中18例(++),71例为(+)。阳性率为70.63%。
2.2 IGF-IR表达与临床病理特征的关系 IGF-IR表达与肺腺癌患者肿块大小及T分期相关,与患者年龄、性别、吸烟史、肿瘤分化、病理分期及CEA等指标无关(P>0.05)(表1)。
2.3 IGF-IR表达与转移和疗效的关系 126例患者中,95例发生转移,其中69例为IGF-IR阳性表达。85例患者可随访到转移后化疗疗效。IGF-IR表达与否与是否转移、转移途径、转移部位及转移后化疗疗效均无统计学差异(表2)。
2.4 IGF-IR表达与肺腺癌患者生存期的相关性 进一步分析IGF-IR和肺腺癌患者生存期的相关性,用Log-rank进行分析,结果表明,126例肺腺癌患者中,IGF-IR表达情况对生存期的影响无统计学差异。生存曲线趋势也表明,IGF-IR表达对患者生存无明显的影响(图2)。
2.5 肺腺癌患者生存期影响因素的Cox回归模型分析 Cox比例风险回归模型对影响患者预后的多项因素进行单因素分析表明:年龄、病理分期、N分期、CEA、是否转移、转移后化疗疗效均影响患者的生存。进行多因素分析显示,是否转移、转移后化疗疗效均是影响生存期的独立因素。无转移的患者较有转移的患者生存期长(P<0.001),相对危险度为0.005(95%CI:0.001-0.043)。此外,转移后化疗效果好的患者比化疗效果不佳的患者预后好(P<0.001),相对危险度为1.969(95%CI: 1.423-2.726)(表3)。
3 讨论
IGF-IR是一种酪氨酸蛋白受体,它的主要作用是介导IGF-I和IGF-II的促生长活性。当配体与IGF-IR的亚单位中的结合部位结合后,激活位于胞内的酪氨酸激酶,引起胞内信号转导,进一步引起细胞分裂分化和组织器官的生长发育。细胞的正常增殖分化和机体的正常发育均受IGF-IR介导的各信号传导途径的调节,当IGF-IR介导的信号传导失常时,机体可能形成肿瘤。IGF-IR在肿瘤的发生发展过程中起着多方面的作用,如促进细胞向恶性表型转化、促进肿瘤细胞生长和分裂增殖、抑制肿瘤细胞凋亡并与肿瘤的浸润有密切关系。研究发现IGF-IR在肺癌、肝癌、前列腺癌中呈过度表达。
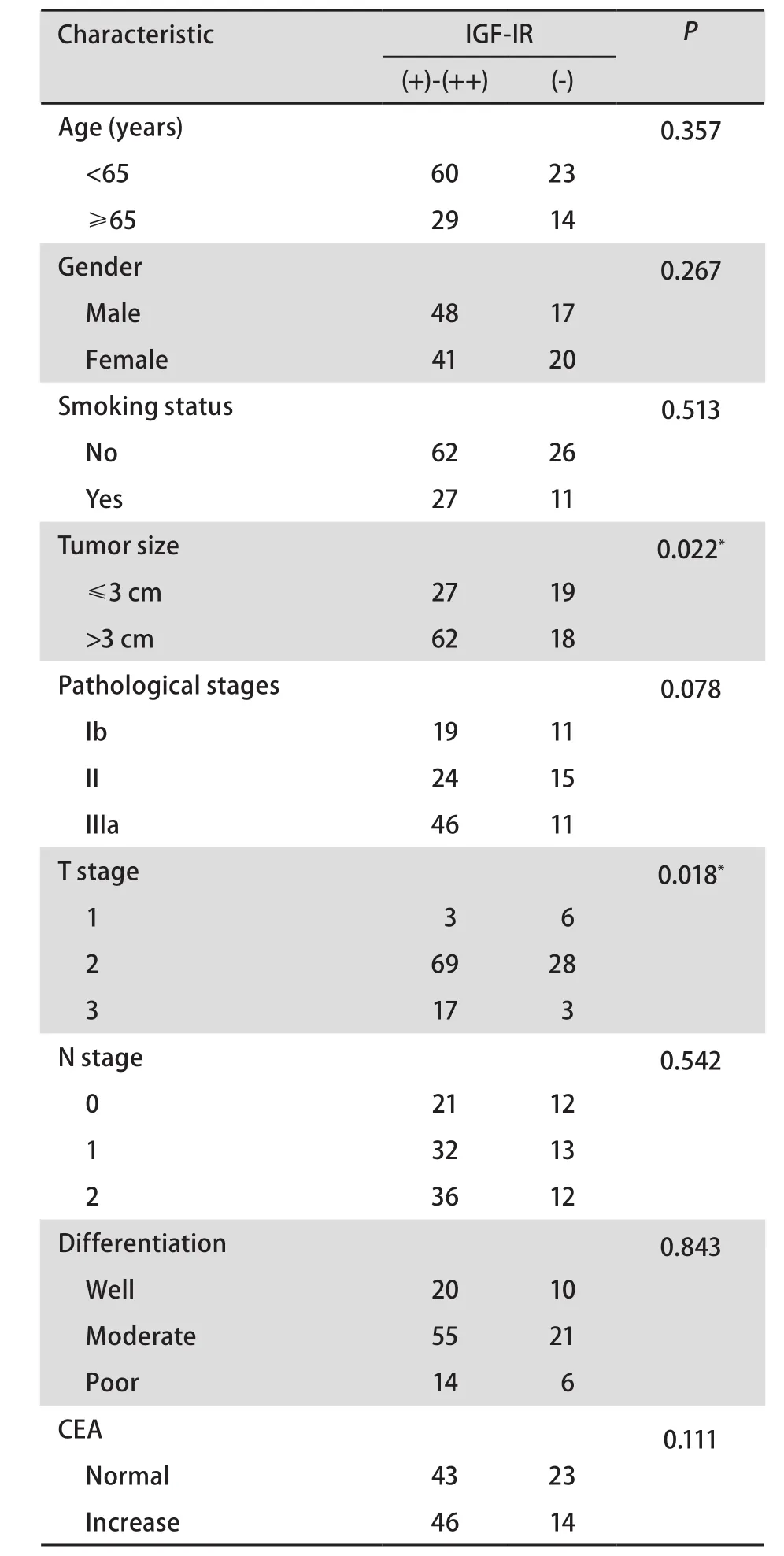
表 1 IGF-IR表达与肺腺癌临床病理特征的相关性Tab 1 Correlation between IGF-IR expression and clinicopathological factors in 126 patients with lung adenocarcinoma

图1 IGF-IR在肺腺癌组织中呈不同程度表达(免疫过氧化物酶染色,×200)。A:IGF-IR表达(++);B:IGF-IR表达(+);C:IGF-IR表达(-)。Fig 1 Immunohistochemical staining of IGF-IR protein in lung adenocarcinoma tissues (immunoperoxidase stain, ×200). A: strong staining in the most of the lung adenocarcinoma cells (++); B: weak-moderate staining in lung adenocarcinoma cells (+); C: negative staining in lung adenocarcinoma cells (-).
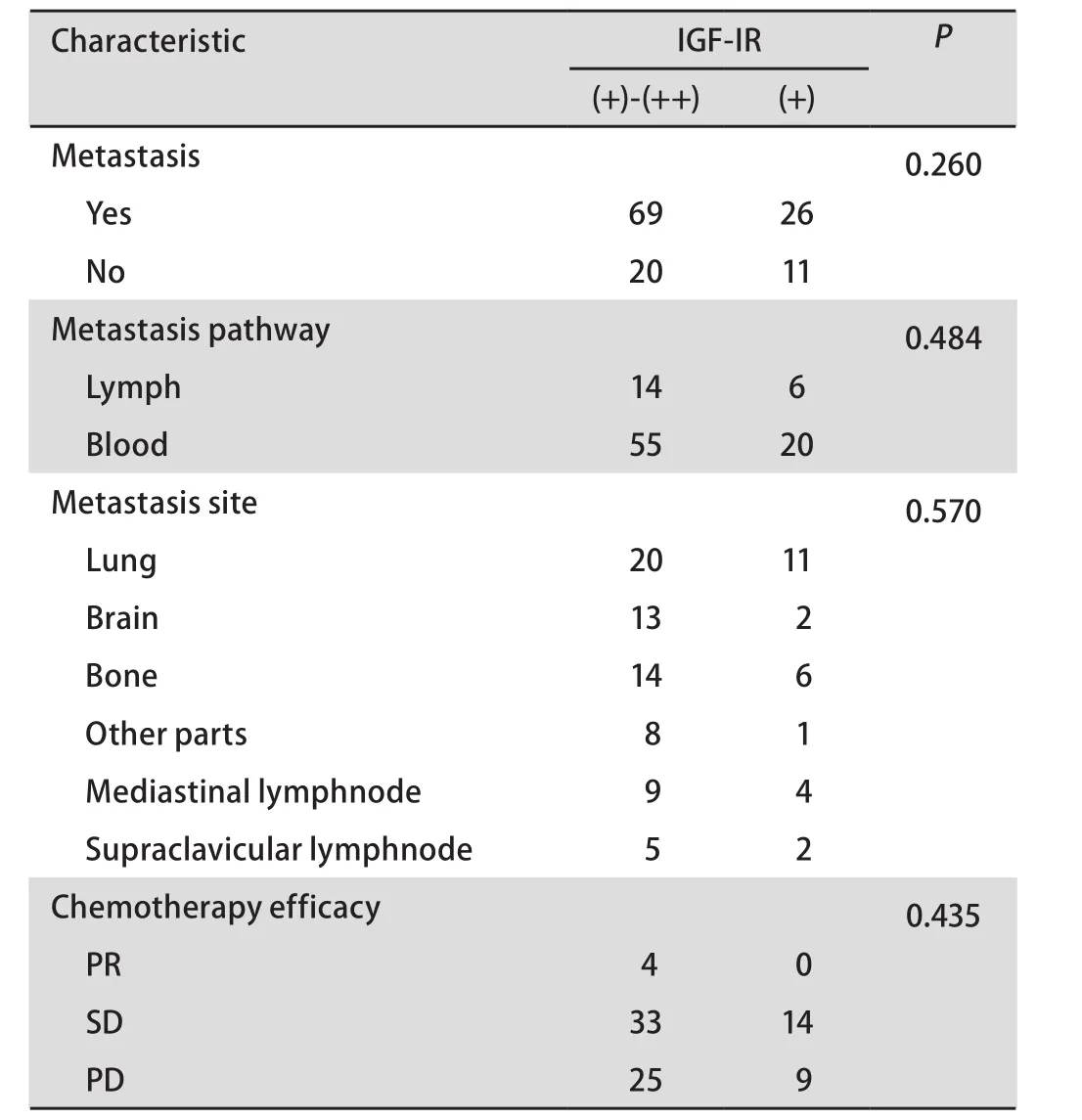
表 2 IGF-1R表达与肺腺癌患者的转移及疗效的相关性Tab 2 Correlation between IGF-1R expression and metastasis and chemotherapy efficacy in 126 patients with lung adenocarcinoma
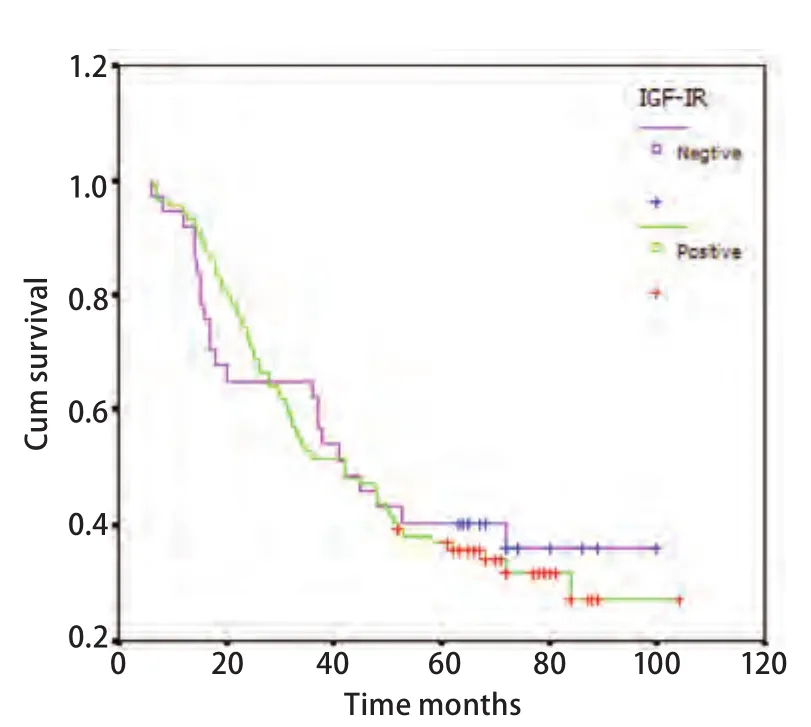
图2 IGF-IR表达与肺腺癌生存期的关系(Logrank=0.08, P=0.775)Fig 2 Cumulative Kaplan-Meier survival curves for patients with IGF-IR (Log-rank=0.08,P=0.775)
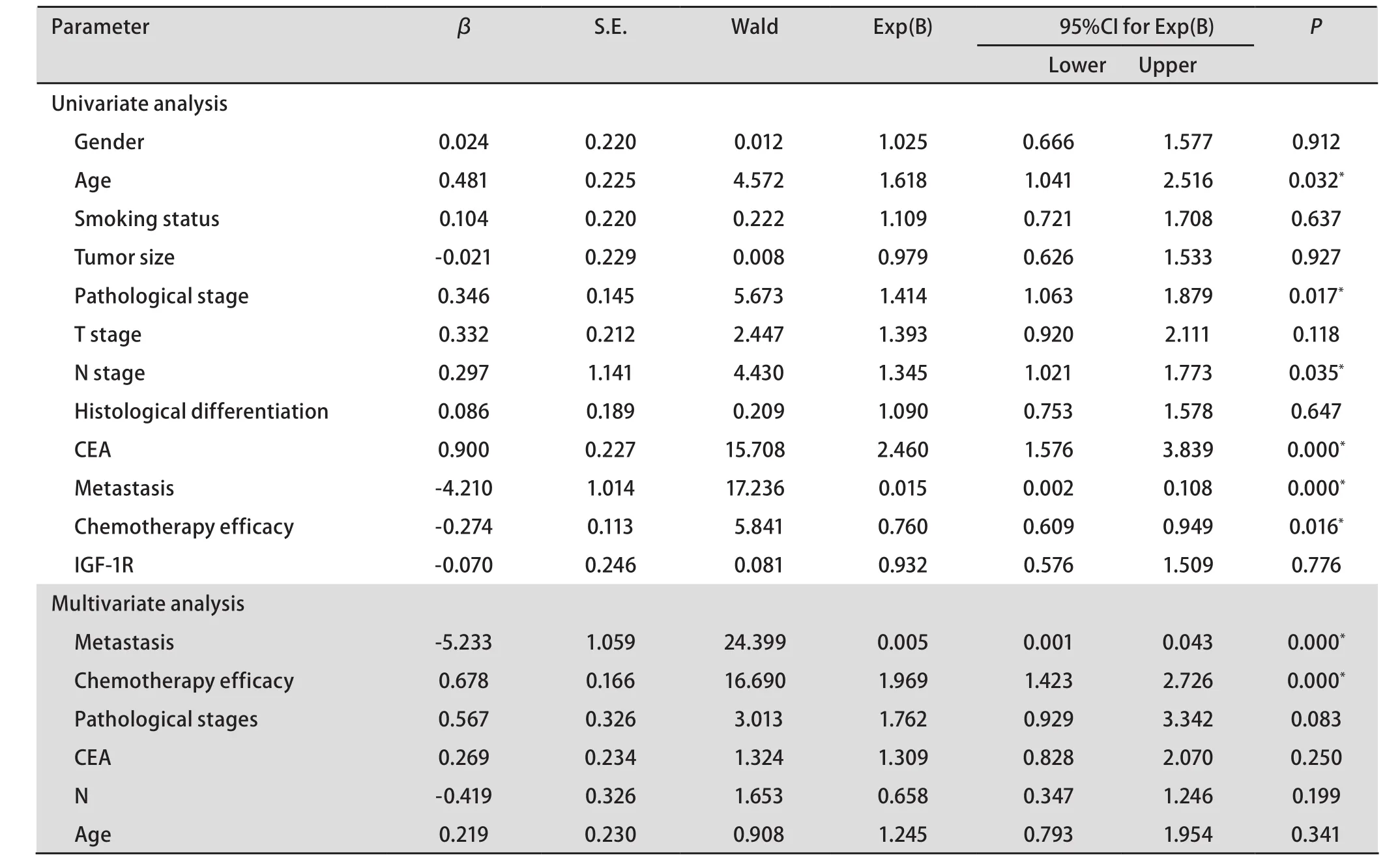
表 3 肺腺癌患者生存期影响因素的Cox回归模型分析结果Tab 3 Univariate and multivariate analysis of clinicopathological factors for the overall survival rate of 126 patients with lung adenocarcinoma
本研究发现,IGF-IR表达与患者肿块大小和T分期相关,病灶大及T分期晚的患者IGF-IR表达增高。其可能的机制为:IGF-IR既可以结合IGF-I,又与IGF-II具有很强的亲和力,在IGF信息传导通路中发挥重要作用。正常情况下,细胞表面的IGF-IR对细胞凋亡无明显的影响。细胞癌变时,各种癌基因和抑癌基因的突变及相互作用而致肿瘤细胞中IGF-IR基因表达异常。表达IGF-IR的肿瘤细胞通过合成和分泌内生性IGFs,借助IGFs/IGF-IR环路刺激肿瘤细胞无限增殖,并维持其恶性表型。IGF-IR的过度表达可以阻止肺癌等肿瘤细胞的凋亡,且与肿瘤的浸润性生长、转移关系密切。在实验研究中发现,通过抗IGF-IR抗体、IGF-I类似物或反义RNA使IGF-IR功能失活或数目减少,均可导致相应肿瘤细胞系大批凋亡,阻止体外增殖,并使其在同源动物或裸鼠体内的致瘤性丧失,可见,IGF-IR在建立和维持肺肿瘤转化表型中扮演着重要角色,可以成为抑制细胞增殖的合适靶点。
本研究也发现,IGF-IR表达与患者肿块大小和T分期相关,而与患者年龄、性别、吸烟史、肿瘤分化、病理分期、远道转移及CEA等指标均无关,且与是否转移、转移途径、转移部位及转移后化疗疗效均无关。生存曲线趋势也表明,IGF-IR表达对患者生存无明显的影响。因此,IGF-IR可能并非有效的预测肺腺癌疗效及预后的标志。近年研究[1,2]发现,IGF-IR在乳腺癌中表达与疾病进展及放疗耐药相关,且预示不良预后。对IGF-IR表达与临床指标及预后的关系,各家报道不一致,目前仍有争论。有关前列腺癌和乳腺癌的研究[3,4]显示,早期肿瘤和正常组织中IGF-IR表达增多,而进展性癌表达减少。IGF-IR表达提示预后良好,而在软组织肉瘤的研究中也支持这一观点[5]。而也有相反的观点认为,IGF-IR揭示不良的预后[6,7]。对肺癌的研究较少,Merrick等[8]的研究表明,IGF-IR在肺腺癌中表达高于其它组织类型,有统计学意义,且与不良预后有关。而Lee等[9]对71例I期NSCLC的研究表明,IGF-IR表达与临床指标(如性别、组织类型、分期、分化等)无相关性,且和患者预后无相关。而最近Ludovini等[10]研究发现VEGF和IGF-IR共表达的患者预后不良,而单独IGF-IR表达和预后无关。最近的一项研究[11]通过对189例NSCLC的手术标本进行检测IGF-IR,发现IGF-IR表达与EGFR表达具有相关性,且IGF-IR蛋白表达与肺癌患者分期有关,但与肺癌患者的生存无关。因此,目前对IGF-IR对肺癌患者预后及临床指标关系的观点说法不一,本研究显示,IGF-IR表达与肺腺癌转移及预后等无关。
Cox单因素和多因素分析表明:年龄、病理分期、N分期、CEA、转移及转移后化疗疗效均是患者生存期的影响因素。高龄患者易进展,这可能与老年患者心肺功能相对较差,以及对手术的耐受性不如年轻患者好等因素有关;CEA也与病情进展有关,而多因素分析表明,是否发生转移及转移后疗效均是影响生存期的独立因素。患者出现转移后,依据转移部位,临床医生所选择的治疗方法不同,包括化疗、放疗、再次手术等。而且转移的部位不同,化疗方案也不尽相同,如DP、D、Meccnu+VM26、GP、TP等。由于方案种类较多,且每种病例数较少,故未进行化疗方案与预后关系的分析。共有85例可随访至有化疗疗效,分析疗效与预后的关系发现二线化疗疗效为预后的独立影响因素,而IGF-IR并非影响患者预后的独立因素。因此,IGF-IR与肿瘤的形成、侵袭、肿瘤细胞增殖等相关,可能成为抑制细胞增殖的作用靶点,但并不适合作为预测疗效及预后的适合指标。

