IL-7/IL-7R在非小细胞肺癌中的表达及与淋巴转移和预后的关系
明健 张清富 姜彦多 邱雪杉 白晓忠
白介素-7(interleukin-7, IL-7)是一种细胞因子,它主要由胸腺细胞[1,2]、骨髓基质细胞、小肠上皮细胞[3]和皮肤角化细胞[4]等分泌,在人体免疫系统的正常发育和维持正常免疫功能中起重要作用。IL-7在维持人体免疫系统稳态中起重要作用。同时,它能诱导造血细胞和血液恶性肿瘤细胞(如:白血病和淋巴瘤)生长和增殖[5-10]。但是,关于它在实体肿瘤中的表达和作用的研究较少。IL-7在肺癌组织中如何表达及其表达与肺癌转移是否存在相关性尚未见报道。本实验将探讨非小细胞肺癌(non-small cell lung cancer, NSCLC)组织中IL-7、IL-7受体(interleukin-7 receptor, IL-7R)和血管内皮生长因子-D(vascular endothelial growth factor-D, VEGF-D)表达与临床病理因素、淋巴结转移和预后的关系。
1 材料与方法
1.1 材料 选取1980年1月-2001年12月在中国医科大学附属第一医院行肺癌根治性切除且有完整随访资料的NSCLC组织95例。同时取相应的癌旁肺组织做对照,所取癌旁肺组织距癌灶边缘5 cm以上,并且经HE染色证实。所有患者术前均未接受过任何放疗或化疗,男性71例,女性24例;年龄32岁-72岁(58.50岁±8.96岁)。按照国际抗癌联盟(International Union Against Cancer, UICC)1997年修订的肺癌pTNM分期标准,I期33例,II期9例,III期53例;中高分化56例,低分化39例;淋巴结转移58例。所有标本的使用均征得患者本人同意。生存时间的计算是从手术日期到由于复发/转移而死亡的日期或末次随访日期为止,随访期1个月-117个月,平均23.84个月,随访中发现47例患者发生血行转移,其中脑转移19例、骨转移14例、肾上腺转移14例。
1.2 方法 95例原发性NSCLC癌组织及癌旁正常肺组织标本,用中性福尔马林溶液固定,石蜡包埋,制成4 μm切片,采用SP法检测组织中IL-7、IL-7R和VEGF-D蛋白表达情况以及微血管密度(microvessel density, MVD)和淋巴管密度(lymphatic vessel density, LVD)。高温高压抗原修复,一抗IL-7(1:100)、IL-7R(1:100)、VEGF-D(1:150)抗体均购自美国Santa Cruz,D2-40抗体和CD34抗体分别购自DAKO和美国Lab Vision。SP试剂盒和二氨基联苯胺(diaminobenzidine, DAB)酶底物显色试剂盒(DAB-0031)购自迈新公司。用PBS代替一抗作为阴性对照。结果判定:IL-7、IL-7R和VEGF-D以细胞质中出现棕黄色颗粒为阳性显色。光镜下每张切片选取癌细胞较多的10个高倍视野计数100个癌细胞中的阳性细胞数,IL-7、IL-7R和VEGF-D的评估为:无阳性细胞为“-” ,阳性细胞数≤5%为“+” ,阳性细胞数占6%-20%为“++” ,阳性细胞数>20%为“+++” ,其中“++”和“+++”为高表达,“-”和“+”为低表达。血管和淋巴管判定标准参考Weinder[11]标准。血管和淋巴管判定标准为:内皮细胞形成条状、裂隙状等孤立结构棕黄染色或有管腔者按一条血管或淋巴管计数。低倍光镜下确定3个微血管或淋巴管高密度区域(热点),然后在高倍镜下分别计数每个热点中3个区域的CD34染色(用于标记MVD)和D2-40(用于标记LVD)染色阳性管腔数均值。MVD=(CD34阳性管腔数-D2-40阳性管腔数)均值;LVD=D2-40阳性管腔数均值。当计数相差10%以上时则重新计数。
1.3 统计分析 采用SPSS 13.0统计软件,采用χ2检验分析IL-7表达和临床病理因素的关系;生存分析采用Kaplan-Meier法,采用Log-rank检验判断差异性。P<0.05为有统计学差异。
2 结果
2.1 IL-7/IL-7R的表达与NSCLC临床病理因素的关系 95例NSCLC组织免疫组织化学检测结果显示:在正常支气管上皮、腺体和肺泡上皮细胞未见IL-7和IL-7R的表达(图1A,图1C)。IL-7主要在癌细胞胞质内表达(图1B),按评分标准,高表达者占63.16%(60/95),低表达者或无表达者占36.84%(35/95);IL-7R主要在癌细胞胞质内和胞膜上表达(图1D),高表达者占61.05%(58/95),低表达者或无表达者占38.95%(37/95)。IL-7的表达水平与IL-7R明显相关(r=47.906, P<0.001)。
对95例NSCLC组织中IL-7和IL-7R的表达情况与临床病理因素进行χ2检验、t检验等统计学分析。结果显示:IL-7和IL-7R的表达与临床分期(P=0.001; P=0.005)和淋巴结转移(P<0.001; P<0.001)均密切相关,而与患者的年龄、性别、组织分型、分化程度无明显关系(P>0.05)(表1)。
2.2 IL-7和IL-7R表达与VEGF-D表达的关系 95例人NSCLC免疫组织化学检测结果显示:在正常支气管上皮、腺体和肺泡上皮细胞均未见到VEGF-D的表达(图1E),在间质的血管、淋巴管内皮细胞内有VEGF-D的表达。VEGF-D主要表达于癌细胞胞质内(图1F),按评分标准,高表达者占58.95%(56/95),低表达者或无表达者占41.05%(39/95)。IL-7的表达水平与VEGF-D表达水平呈正相关(r=19.189, P<0.001);IL-7R的表达水平与VEGF-D表达水平呈正相关(r=9.777, P=0.001)。
2.3 IL-7、IL-7R和VEGF-D的表达与MVD和LVD的关系 我们分别计数IL-7、IL-7R和VEGF-D高表达组和低表达或无表达组的血管和淋巴管数目。肿瘤内的血管和淋巴管分别用CD34和D2-40抗体标记,呈条索或裂隙状。IL-7高表达组的LVD明显高于低表达或无表达组,差异具有统计学意义(P=0.003);IL-7R高表达组的LVD明显高于低表达或无表达组,差异具有统计学意义(P=0.019);VEGF-D高表达组的LVD明显高于低表达或无表达组,差异具有统计学意义(P<0.001)(表2)。结果显示IL-7、IL-7R和VEGF-D的表达与NSCLC组织的LVD有关,而与MVD无关联(图2)。

表 1 IL-7和IL-7R蛋白表达与NSCLC患者临床因素之间的关系Tab 1 Relationship between IL-7 and IL-7R expression in NSCLC and clinical pathological factors
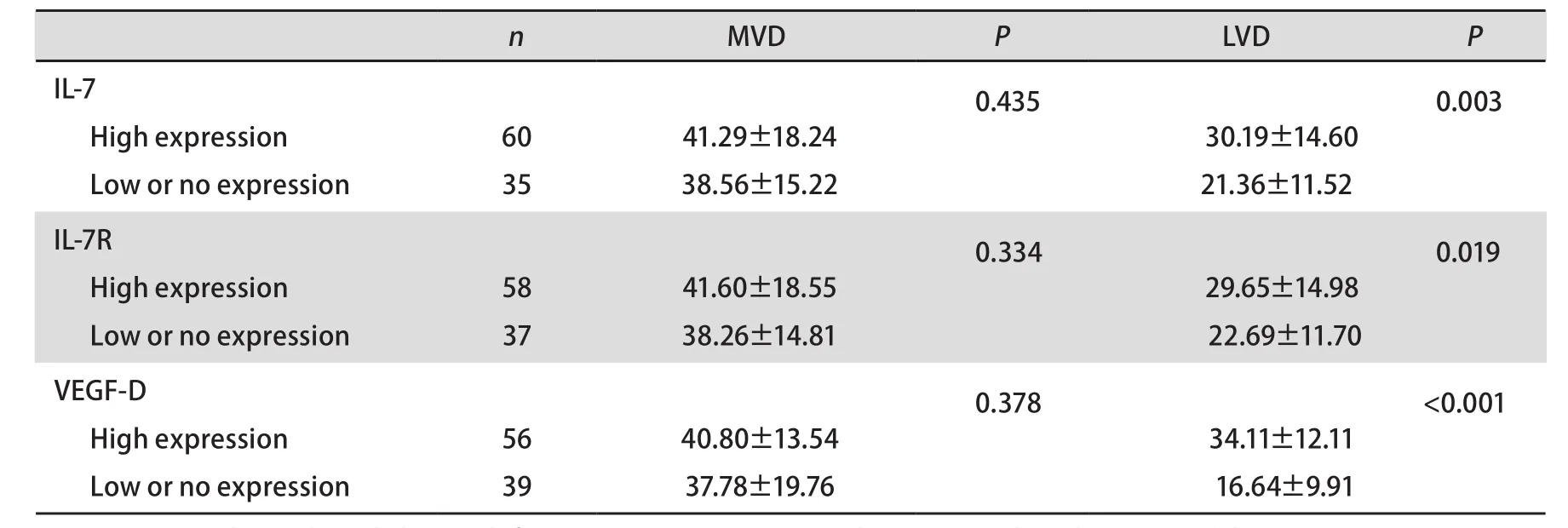
表 2 在NSCLC中IL-7、IL-7R和VEGF-D表达与MVD、LVD的关系Tab 2 Relationship among the expressions of IL-7, IL-7R and VEGF-D with MVD and LVD in NSCLC
2.4 IL-7、IL-7R和VEGF-D表达与NSCLC预后的关系 对95例有完整的术后随访记录的患者进行Kaplan-Meier生存曲线分析显示:IL-7高表达组患的生存时间明显低于低表达或无表达组者(16±4.487 vs 24±4.982, P=0.008);IL-7R高表达组患者的5年生存率明显低于低表达或无表达组(18±4.152 vs 22±3.649, P=0.032);VEGF-D高表达组患者的5年生存率明显低于低表达或无表达组(16±3.813 vs 23±1.369, P=0.028)(图3)。

图 1 在正常肺组织中IL-7(A)、IL-7R(C)和VEGF-D(E)呈阴性表达,肺癌中IL-7(B)和VEGF-D(F)主要在肿瘤细胞质中表达,IL-7R主要在肿瘤细胞质和细胞膜上表达(D)(SP,×400)。Fig 1 The expressions of IL-7 (A), IL-7R (C) and VEGF-D (E) is negative in normal lung tissue; the expressions of IL-7 (B) and VEGF-D (D) are positive in cytoplasm of lung cancer cells; the expressions of IL-7R is positive in cytoplasm and membrane of lung cancer cell (D) (SP, ×400).
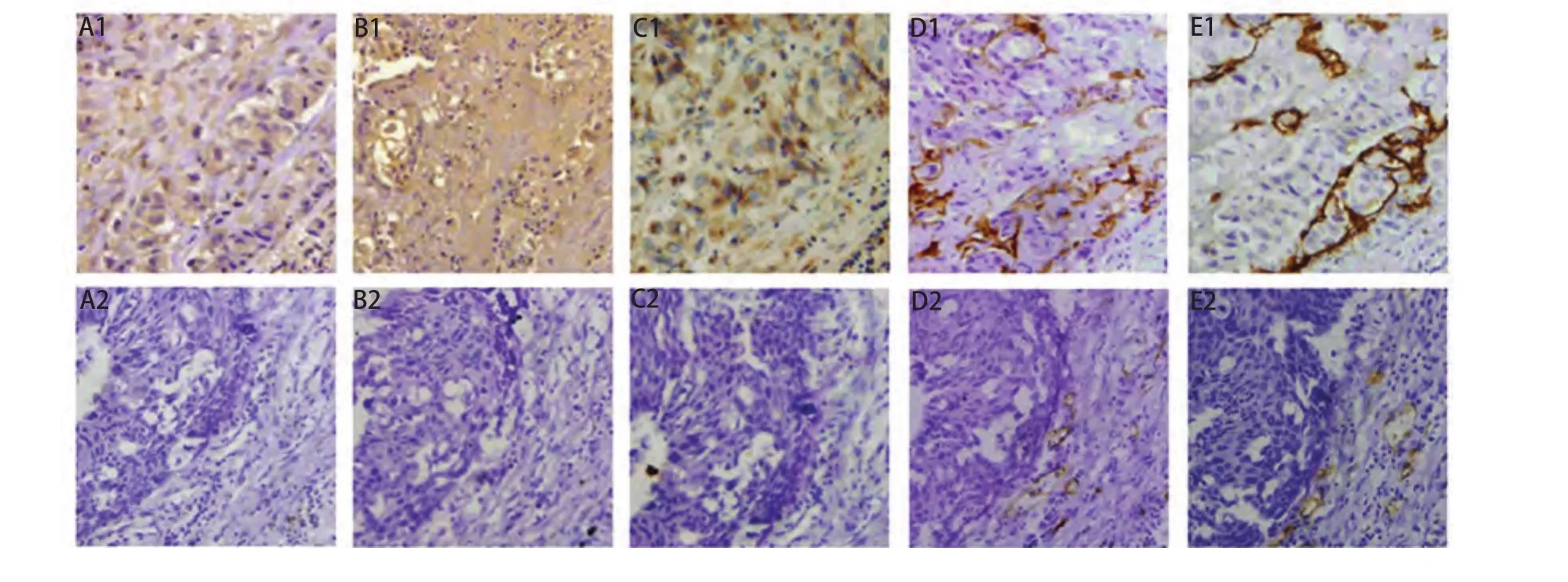
图 2 NSCLC中IL-7、 IL-7R、VEGF-D的表达与MVD和LVD之间的关系。当IL-7(A1)、 IL-7R(B1)、VEGF-D(C1)呈高表达时相应的LVD(E1)也呈高表达;当IL-7(A2)、 IL-7R(B2)、VEGF-D(C2)呈阴性表达时相应的LVD(E2)也呈低表达,而MVD(D1、D2)与三者无关(SP,×400)。Fig 2 Relationship of the expressions of IL-7, IL-7R, and VEGF-D in NSCLC with MVD and LVD. When the expression levels of IL-7 (A1), IL-7R (B1) and VEGF-D (C1) were high, the corresponding LVD was also high (E1); However, when the expression levels of IL-7 (A2), IL-7R (B2), and VEGF-D (C2) were low, the corresponding LVD were significantly low (E2), but MVD was not related with the expressions of IL-7, IL-7R, and VEGF-D (SP, ×400).
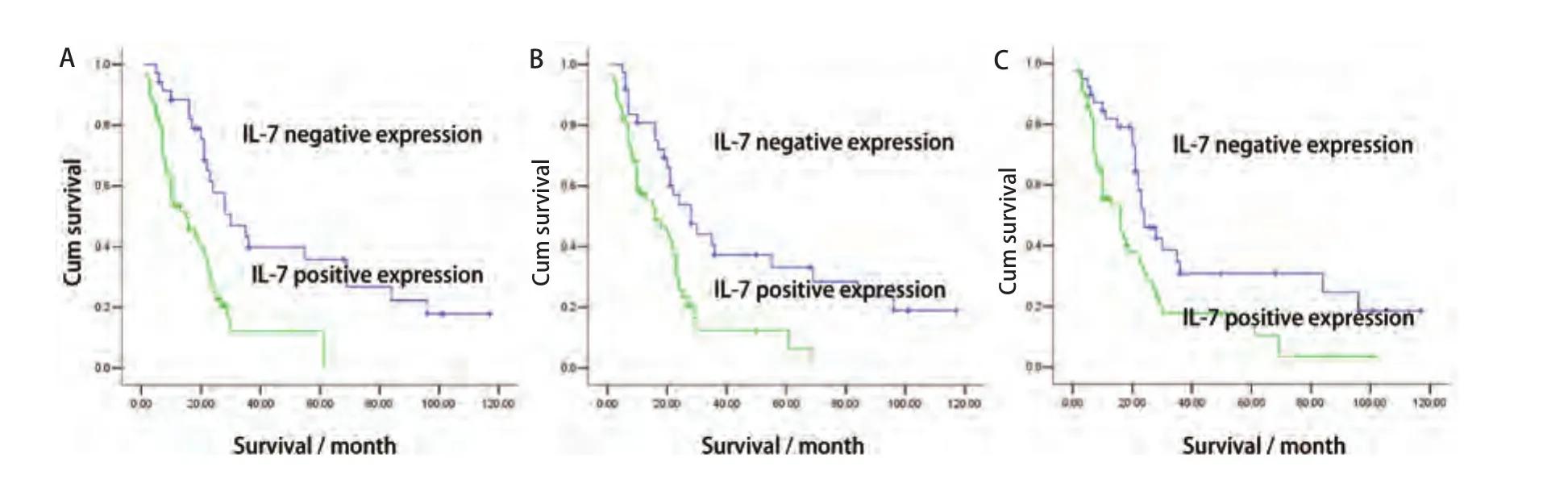
图 3 IL-7(A)、IL-7R(B)和VEGF-D(C)阴性表达组和阳性表达组患者的Kaplan-Meier生存曲线(Log-rank检验,P=0.008,P=0.032,P=0.028)。Fig 3 Survival of NSCLC patients correlates with the expression of IL-7, IL-7R and VEGF-D. Kaplan-Meier survival plots for patients with NSCLC,grouped according to IL-7 (A), IL-7R (B) and VEGF-D (C) protein expression (Log-rank test, P=0.008, P=0.032, P=0.028).
3 讨论
近年研究显示,一些恶性肿瘤,如:慢性淋巴细胞白血病细胞[8]、Burkitt's淋巴瘤细胞[9]和结肠癌细胞[10,12]能产生IL-7;还有一些肿瘤细胞系,如:食道癌[13]、肾癌[14]、头颈鳞状细胞癌[15]和腮腺Warthin's细胞系[16]表达IL-7基因。另外,Al-Rawi[17]研究了乳腺癌组织中IL-7和IL-7R的表达,结果显示在乳腺癌组织中IL-7阴性表达,而IL-7R表达阳性,且IL-7R表达与肿瘤淋巴结转移有关。
IL-7在肺癌组织中表达如何及其表达与肺癌转移是否存在相关性尚未见报道。为了探讨IL-7在肺癌组织中的表达情况,本研究通过免疫组化的方法检测其在95例有完整随访资料的NSCLC以及癌旁组织的表达,结果发现肺癌组织中IL-7呈高表达,在正常支气管上皮、腺体和肺泡上皮细胞中不表达。Al-Rawi[17]研究发现IL-7在乳腺癌组织中不表达,这与我们的研究结果不一致,这可能是组织特异性造成的,而在乳腺癌组织中有IL-7R的表达,IL-7R的表达与肿瘤转移到局部淋巴结有关,这可能是血液中或其它细胞分泌的IL-7作用于IL-7R受体后引起的相关作用。我们发现在肺癌中IL-7和IL-7R均呈高表达,且与分期和淋巴结转移呈正相关。
随着肿瘤淋巴管形成相关分子血管内皮生长因子-C(vascular endothelial growth factor-C, VEGF-C)和VEGF-D被发现,肿瘤淋巴管形成成为人们关注的热点。在动物模型中,VEGF-C和VEGF-D可以诱导肿瘤淋巴管形成[18,19]。在人膀胱癌、甲状腺乳头癌、前列腺癌、胃癌、结直肠癌、乳腺癌、卵巢癌和肺癌[20-28]中VEGF-D高表达与肿瘤淋巴结转移密切相关。另外,免疫组化结果显示在许多肿瘤细胞中VEGF-D呈高表达,这说明肿瘤细胞自身可以产生VEGF-D,促进肿瘤淋巴管形成[29]。
淋巴转移和血行转移是肺癌主要转移途径,新生血管和淋巴管的形成是肿瘤血行转移和淋巴转移的基础,VEGF-D属于VEGF家族,与其受体VEGFR-3结合后可引起淋巴管内皮细胞增生,促进淋巴管形成,VEGF-D在肿瘤淋巴管形成过程中发挥重要作用。我们同时检测了肿瘤组织周围MVD和LVD,发现在肺癌中,淋巴转移和血行转移组肿瘤组织周围LVD和MVD明显高于非转移组,且IL-7和IL-7R高表达组肿瘤中的LVD明显高于低表达或无表达组,而MVD无明显差异。
为了进一步解释IL-7高表达时LVD数目增多的现象,我们又检测了这些组织中VEGF-D的表达,结果发现VEGF-D与LVD呈正相关,且IL-7和IL-7R高表达均与VEGF-D的阳性表达呈正相关。Al-Rawi[30,31]研究发现IL-7可以促进乳腺癌细胞系中VEGF-D的表达,同时促进淋巴管形成。因此我们认为在肺癌中IL-7/IL-7R高表达促进VEGF-D高表达,从而促进淋巴管形成。
对所有具有临床随访资料的患者进行生存曲线分析发现,IL-7和IL-7R低表达或无表达组的患者的5年生存率明显高于高表达组的患者,表明IL-7和IL-7R表达的上调可降低患者的生存时间和生存率。
综上,在NSCLC组织中,IL-7和IL-7R的表达水平与VEGF-D表达、肿瘤分期、淋巴结转移、LVD和预后不良呈正相关。

