ProGRP与NSE对小细胞肺癌诊断价值的meta分析
王纪文 高佳 赫捷
2007年全球肺癌新发病例约150万,占年新发肿瘤的12%;因肺癌死亡的病例数占年癌症致死数的17.6%,是癌症的首位死因[1]。小细胞肺癌(small cell lung cancer,SCLC)约占肺癌总数的20%-25%,其生物学特性和临床特点异于其它病理类型的肺癌。SCLC恶性程度较高,对化疗敏感,其治疗原则与非小细胞肺癌(non-small cell lung cancer, NSCLC)有较大差异。因此寻找能用于SCLC诊断及鉴别诊断的分子标志物具有重要意义。
神经元特异性烯醇化酶(neuron specific enolase,NSE)和胃泌素释放肽前体(pro-gastrin-releasing peptide,ProGRP)均是SCLC相关的血清学诊断标志物。NSE已在临床应用多年,是目前SCLC首选的实验室诊断指标,它在SCLC中的阳性率为60%-81%,但诊断的特异性有待提高,7%-42%的NSCLC和11%-14%的非恶性肿瘤患者,NSE呈假阳性[2]。ProGRP是近年来研究较多的具有临床应用前景的肿瘤标志物。研究[3]表明,它在鉴别SCLC和其他肺部疾病方面具有较高的敏感度和特异度。
ProGRP对SCLC的诊断价值是否优于NSE,各项研究尚未得到一致结论,亦无大样本量的多中心研究予以证实。本研究通过meta分析,综合评价ProGRP与NSE诊断SCLC的价值,以期为ProGRP的进一步研究和临床应用提供参考。
1 材料与方法
1.1 文献检索 检索Pubmed、OVID、Elsevier Sciencedirect、Springer、Cochrane Library、Embase、IFCC、中国生物医学文献数据库和维普医药信息资源系统,收集2010年5月之前公开发表的关于ProGRP与NSE在肺癌中的血清浓度及其诊断意义的文献。使用的检索词包括neuron specific enolase、pro-gastrin-releasing peptide、NSE、ProGRP、Lung Neoplasms、lung cancer、diagnosis、神经元特异性烯醇化酶、胃泌素释放肽前体、肺癌。检索语言为英语与汉语。
1.2 文献纳入与排除标准 文献纳入标准:①研究类型为含有ProGRP和NSE对SCLC诊断价值的前瞻性或回顾性研究;②研究对象涵盖肺癌及肺部良性疾患,采用病理诊断为金标准,文献需明确说明受试者为SCLC、NSCLC或其它病理类型;③文章提供了ProGRP及NSE检测在各病例组的真阳性、真阴性、假阳性、假阴性例数或通过文章提供的数据可以计算;④每组病例数均>20。
文献排除标准:①对照组仅有正常人;②ProGRP或NSE的检测方法不是定量检测;③重复性实验中,发表较早或样本量较小的文献排除。
1.3 资料提取和质量评价 由2名评价者独立按照预先制定的纳入排除标准筛选文献,根据QUADAS(quality assessment of diagnostic accuracy studies)评价标准[4]对纳入文献进行质量评价(总分33分,评分结果见表1),提取数据并交叉核对,意见不统一时协商解决或参考第三方意见。提取的资料包括文献基本信息、实验设计及实验原始数据(真阳性、假阳性、真阴性及假阴性的例数)。
1.4 统计分析
1.4.1 异质性分析 采用Q检验分析纳入研究之间是否存在异质性,以I2估算分析异质性的大小,然后根据异质性分析的结果选择合适的统计分析模型进行后续的meta分析。
1.4.2 meta分析 对各研究的原始数据(真阳性、假阳性、真阴性及假阴性的例数)进行整合,采用DerSimonian Laird随机效应模型分别计算ProGRP和NSE的平均敏感度、特异度、似然比及各自的95%可信区间(confidence interval, CI)。
采用Mose's constant线性模型拟合SROC曲线[5],以诊断比值比(diagnositic odd ratio, DOR)[6]、曲线下面积(aera under curve, AUC)和Q*统计量评价诊断试验ProGRP和NSE对SCLC诊断的准确度,并以Z检验分析二者诊断的准确性是否存在差异。
计算真阳性率和假阳性率的Spearman相关系数ρ,分析是否存在阈值效应。以meta回归(REML法)分别分析ProGRP和NSE异质性的可能来源[7]。
以每次减少1篇文献的方法进行敏感性分析,评价本次分析的稳定性[7]。以漏斗图和Egger线性回归评价纳入的研究是否存在发表偏倚[8,9]。
本文统计用软件为STATA 10和Meta-Disc 1.4,以P<0.05为有统计学差异。
2 结果
2.1 检索结果及纳入文献 通过设定的检索词进行初步检索,共找到164篇文献。阅读文题和摘要排除143篇,初步纳入文献21篇。进一步阅读全文,排除未达到纳入标准的文献6篇,重复文献3篇,无法获得所需全部原始数据的文献2篇,最终纳入文献共10篇。文献的纳入过程详见图1。
2.2 纳入研究的基本特征和质量评价 本文共纳入10项研究,累计病例2 536例(SCLC 935例,NSCLC 1 601例),对照849例。各研究的研究设计详见表1,ProGRP和NSE的检测方法、cutoff值及真阳性、假阳性、假阴性、真阴性的例数参见表2。
2.3 异质性检验 以DOR作为效应量,分别分析ProGRP和NSE的异质性,Q检验显示Cochran-Q分别为23.93和58.37,P均<0.05,I2分别为62.4%和84.6%,研究间均存在异质性,故以下分析均选用随机效应模型。
2.4 ProGRP和NSE检测SCLC的敏感度、特异性和似然比图2所示为ProGRP和NSE对SCLC诊断敏感度的森林图。ProGRP鉴别SCLC和肺部其他肿物(NSCLC与肺良性疾患)的平均敏感度为0.70(95%CI: 0.67-0.73),NSE的平均敏感度为0.61(95%CI: 0.58-0.64)。图3所示为ProGRP和NSE对SCLC诊断特异度的森林图。ProGRP鉴别SCLC和肺部其他肿物(NSCLC与肺良性疾患)的平均特异度为0.93(95%CI: 0.92-0.94),NSE的平均特异度为0.90(95%CI: 0.88-0.91)。
此外,ProGRP和NSE诊断SCLC的阳性似然比(positive likelihood ratio, PLR)分别为11.57(95%CI: 7.71-17.39)和5.67(95%CI: 3.83-8.39);阴性似然比(negative likelihood ratio, NLR)分别为0.32(95%CI: 0.26-0.40)和0.45(95%CI: 0.37-0.55),DOR分别为36.45(95%CI:24.12-55.10)和13.08(95%CI: 7.70-22.23),数据详见表3。
2.5 ProGRP和NSE鉴别SCLC与其它肺部肿物的SROC曲线图4所示为ProGRP和NSE诊断SCLC的SROC曲线。ProGRP和NSE的AUC分别为0.873 7(SEAUC=0.039 1)和0.785 4(SEAUC=0.915 0),Q*统计量分别为0.804 2(SEQ*=0.027 5)和0.723 2(SEQ*=0.065 1)。对Q*统计量进行Z检验(Z=1.146, P>0.05),二者没有明显差异。
2.6 研究间异质性的来源分析
2.6.1 是否存在阈值效应 由ProGRP和NSE的SROC曲线可见,各研究对应的点散在分布,不呈“肩臂”状外观,计算灵敏度对数与(1-特异性)对数的Spearman相关系数ρ,ProGRP和NSE的ρ值分别为0.321和-0.067,P均>0.05,提示不存在阈值效应。
2.6.2 meta回归分析可能的来源 以meta回归(REML法)分别分析ProGRP和NSE异质性的来源,自变量选择如下:发表年限、样本量、研究设计(前瞻性设计或者回顾性设计)、患者的选择(是否随机)、是否采用盲法、检测方法(ProGRP的检测方法是商品化试剂盒或自建ELISA检测;NSE的检测方法是否是ELISA)。结果详见表4。由表可见,检测方法是NSE异质性的来源,将其引入meta回归分析模型后,方差分量(τ)由0.594 3降为0.299 4,表明检测方法可以解释49.6%的异质性来源。
2.7 敏感度分析 以每次减少1篇文献的方法进行敏感性分析,评估单个研究对本次meta分析的影响。表5显示的是,删除1篇文献后计算的合并DOR及其95%CI。可见,无论剔除哪篇文献,剔除之后的合并DOR均未发生明显变化,提示本次分析结果并未过分依赖于某个研究,结论稳定。
2.8 发表偏倚 以DOR对数的标准误(SELogDOR)为纵坐标,以Log(DOR)为横坐标,绘制漏斗图,如图5所示。Egger线性回归显示P>0.05,未发现发表偏倚。

图 1 选择文献流程图Fig 1 Study identification, inclusion and exclusion for meta-analysis
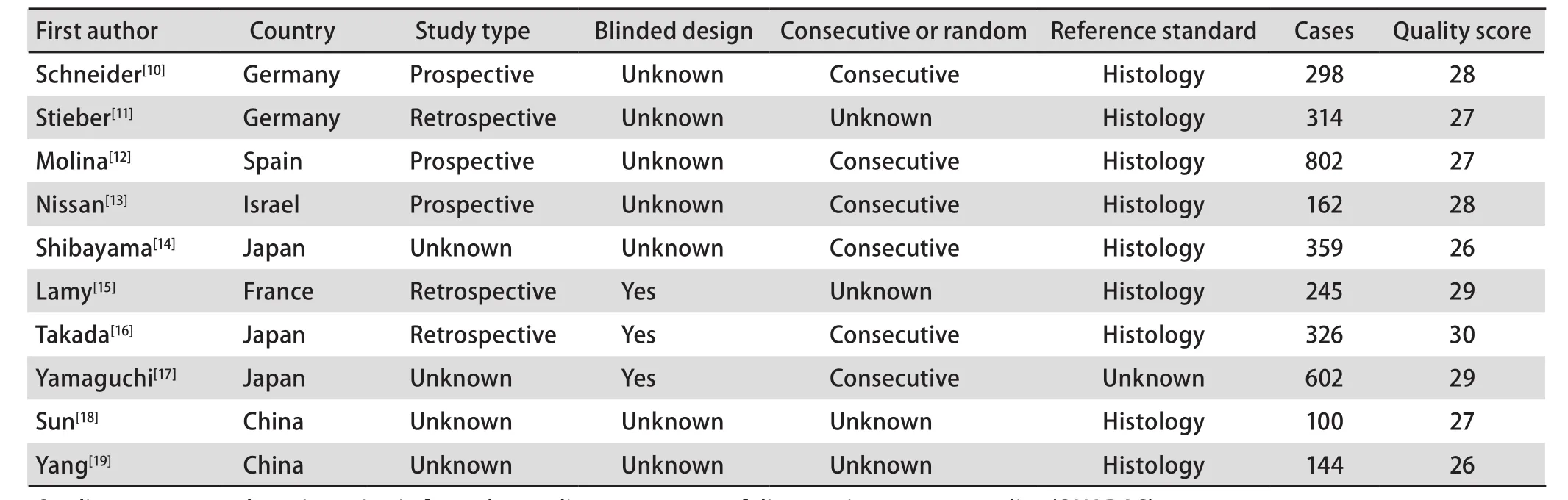
表 1 纳入文献的基本特征Tab 1 General characteristics of included trials

表 2 纳入研究中ProGRP和NSE检测的实验数据Tab 2 Summary of results of ProGRP and NSE in included studies
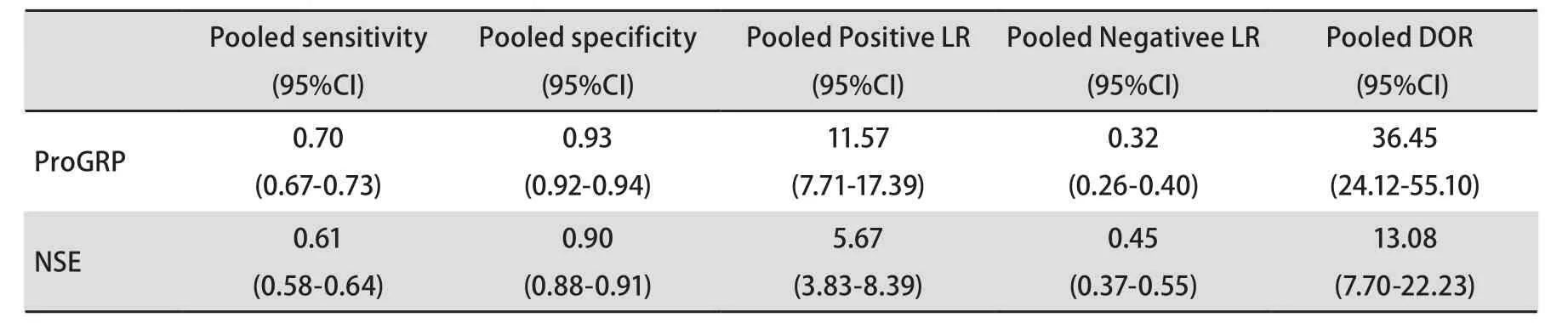
表 3 ProGRP和NSE的合并敏感度、合并特异性、合并似然比Tab 3 Pooled sensitivity, pooled specificity, and pooled likelihood ration of ProGRP and NSE

表 4 meta回归分析异质性的来源Tab 4 Possible sources of heterogeneity of meta-analysis
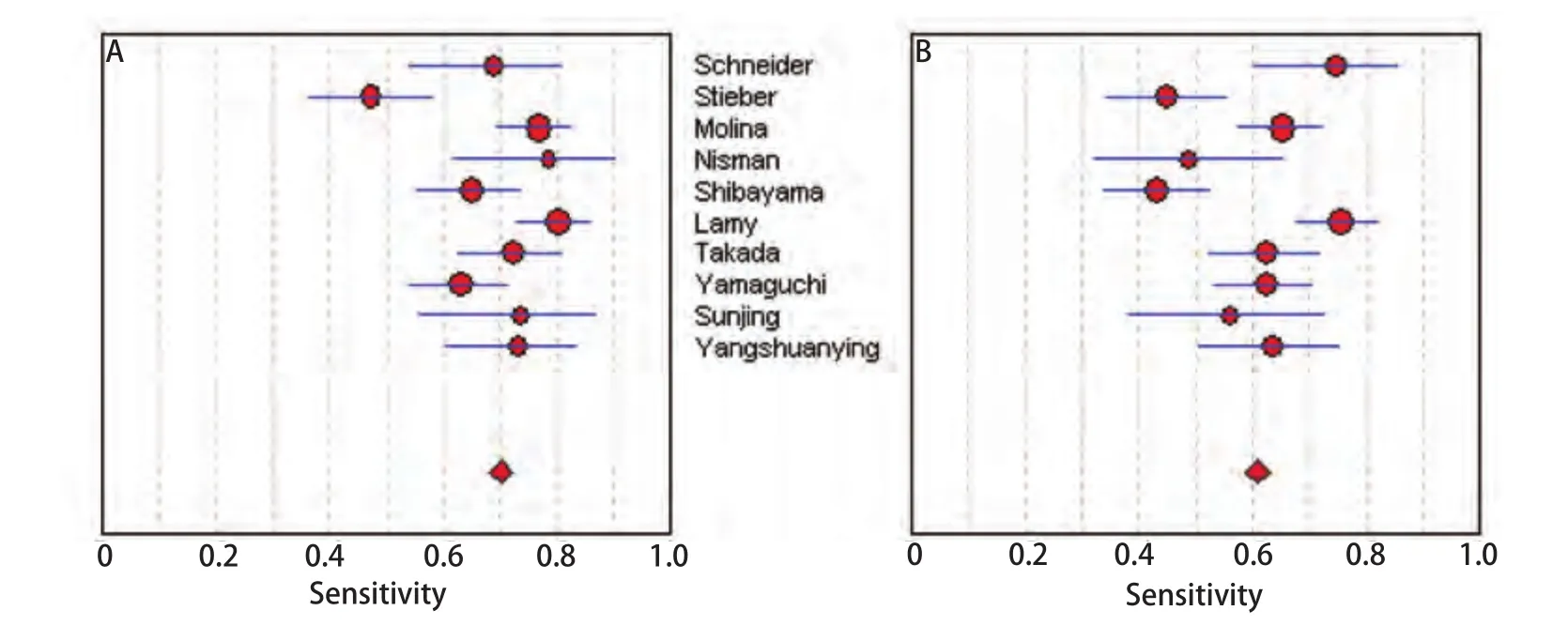
图 2 ProGRP(A)和NSE(B)的敏感度森林图Fig 2 Forest plots of sensitivity of ProGRP (A) and NSE (B)
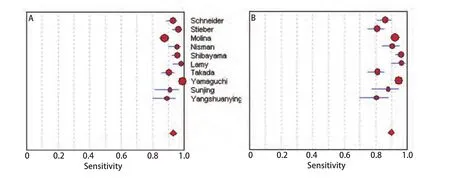
图 3 ProGRP(A)和NSE(B)的特异度森林图Fig 3 Forest plots of specificity of ProGRP (A) and NSE (B)

图 4 ProGRP(A)和NSE(B)的SROC曲线Fig 4 SROC curve of ProGRP (A) and NSE (B)

表 5 各研究对meta分析结果的敏感度分析Tab 5 The influence of each trial for the outcome of the meta-analysis

图 5 ProGRP(A)和NSE(B)的漏斗图Fig 5 Funnel graph for ProGRP (A) and NSE (B)
3 讨论
本文对纳入的10项研究进行meta分析,通过合并诊断效应量、拟合SROC曲线比较ProGRP和NSE对SCLC的诊断效能,通过分析研究间异质性及其来源查找可能影响研究结果的因素,最后通过敏感度分析和检测发表偏倚评估本次meta分析的可信度。
本次评价结果显示,ProGRP和NSE的合并DOR分别为36.45和13.08,提示二者均与SCLC有明显的相关性,且ProGRP的相关性更高。用于鉴别SCLC和NSCLC时,ProGRP的敏感性和特异性均优于NSE,此外,文献资料[20]显示ProGRP的假阳性主要来自肾衰患者,排除肾功能异常患者后,其假阳性率仅为2.5%,较好地弥补了NSE特异度不足的缺点。
SROC曲线显示,ProGRP和NSE的AUC分别为0.873 7和0.785 4,Q*统计量分别为0.804 2和0.723 2,说明二者鉴别SCLC和其它肺部肿物的准确度均较高。尽管ProGRP的AUC和Q*均高于NSE,但Z检验无统计学差异,说明ProGRP的鉴别能力并未明显优于NSE。
由于SROC算法复杂,在临床实际工作中应用较少,相比之下,似然比的应用更为简便。一般认为,PLR>10或NLR<0.1,基本可以确定或排除诊断。本研究得出的ProGRP和NSE诊断SCLC的PLR分别为11.57和5.67,提示ProGRP阳性可以辅助临床医师做出相应判断,具有更高的临床应用价值。但ProGRP和NSE的NLR分别为0.32和0.45,提示二者阴性时不能排除SCLC的可能。
本文纳入的研究间存在高度异质性。经Spearman相关系数检验,异质性与阈值效应无关,因此我们进一步做meta回归,试图寻找ProGRP和NSE异质性的可能来源。结果显示,发表年限、样本量、研究类型、患者的选择是否随机、是否采用盲法均不是异质性的来源,说明试验设计的差异不会造成研究结果的明显变化。然后,我们将检测方法作为协变量进行meta回归分析。由于纳入的研究ProGRP的检测方法均为ELISA,无法在方法学上进一步分类,因此只以是否采用商品化试剂盒作为亚组分析,结果显示这同样不是ProGRP异质性的来源。NSE已在临床应用多年,其检测方法包括ELISA、电发光、化学发光等,在我们纳入的10项研究中,7项采用ELISA方法检测NSE的浓度,2项研究采用电化学发光法检测,1项采用放射免疫分析法检测,meta回归显示检测方法的不同是造成NSE异质性的原因之一,可以解释49.6%的异质性来源。种族或许是异质性的来源,但纳入的文献均未详细报告纳入人群的种族,因此本次研究无法进行分析。
为了判断本研究的稳定性,我们以每次减少1篇文献的方法进行敏感性分析。结果显示,每次减少1篇研究后,合并DOR均未发生明显变化,提示本次分析受单个研究的影响较小,分析结果稳定可信。
本次meta分析的局限性:①meta分析的局限性:检索到的文献不够全面。检索范围局限在已经发表的研究,对于未公开发表的研究,如会议论文无法获取,可能漏检一些灰色文献;检索语种局限于中文和英文,可能会漏检其它语种的相关研究;②纳入研究的局限性:ProGRP和NSE作为诊断性试验,采用盲法检测和盲法判断可尽量减少诊断的倾向性,而多数研究未报告是否采用盲法检测,存在测量偏倚的可能性。多数研究的病例组均为组织学确诊的病例,然而良性疾患对照组的诊断标准,有些研究并未指明,病例组和对照组诊断标准不一致,可能会导致结果的偏差。
综上所述,ProGRP与NSE有相似的诊断效能,但ProGRP的假阳性率更低,较NSE有一定的优越性,具有临床应用前景。

