注射用灯盏花素细菌内毒素检查方法研究
王 璐,张红宇,刘 勤(云南省食品药品检验所,昆明市 650031)
注射用灯盏花素细菌内毒素检查方法研究
王 璐*,张红宇,刘 勤(云南省食品药品检验所,昆明市 650031)
目的:建立注射用灯盏花素细菌内毒素检查方法。方法:按2005年版《中国药典》(一部)要求,采用凝胶法和光度测定法,确定合理的注射用灯盏花素内毒素限值(L),并研究注射用灯盏花素对细菌内毒素与鲎试剂反应的干扰情况,以确定无干扰试验浓度。结果:L=1 EU·mg-1,注射用灯盏花素的无干扰浓度为0.25 g·L-1。结论:该药品采用细菌内毒素检查法代替热原检查法,方法可行。
注射用灯盏花素;细菌内毒素;凝胶法;光度测定法
灯盏花素是从菊科植物灯盏细辛的干燥全草中分离得到的野黄芩苷,为注射用灯盏花素的原料药,以野黄芩苷计其纯度应达到98%以上[1]。注射用灯盏花素具有活血化瘀、通络止痛的功效,临床常用于中风后遗症、冠心病、心绞痛的治疗。云南省食品药品检验所承担了国家评价抽验注射用灯盏花素的检验及探索性研究任务。在2005年版《中国药典》增补本中,注射用灯盏花素细菌内毒素值用热原检查法控制,该法用实验动物家兔进行,为一传统方法。用鲎试剂(TAL)进行细菌内毒素检查法与之比较,具有灵敏度高、重现性好、标准化试验过程短,且可完成多批次供试品检测等优点;同时,国家鼓励以合理的试剂取代实验动物的使用。因此,笔者按照2005年版《中国药典》(一部)细菌内毒素检查法[2],对注射用灯盏花素的热原检查转化为细菌内毒素检查进行了研究。
1 仪器与材料
1.1 仪器
DHG-9075A型电热恒温鼓风干燥箱(上海一恒科技有限公司);ZH-2型旋涡混合器(天津药典标准仪器厂);SUB 28型恒温水浴箱(美国格兰特公司);BET-32M型细菌内毒素测定仪(天津市天大天发科技有限公司)。
1.2 试药
1.2.1 TAL 湛江博康海洋生物有限公司,批号:0901190(λ=0.5 EU·mL-1)、0902270(λ=0.25 EU·mL-1),规格均为每支0.1 mL;湛江安度斯生物有限公司,批号:0908281(λ=0.5 EU·mL-1,规格:每支0.1 mL)、0907102(检测范围:10~0.03 EU·mL-1,规格:每支1.25 mL)。
1.2.2 细菌内毒素检查用水(WBET) 湛江安度斯生物有限公司,批号:0902170、0908030,规格均为每支50 mL;湛江博康海洋生物有限公司,批号:W2003-3,规格:每支10 mL。
1.2.3 细菌内毒素工作标准品(WSE) 中国药品生物制品检定所,批号:200861,规格:每支150 EU。
1.2.4 注射用灯盏花素 衡阳恒生制药有限公司,批号:20071003(规格:10 mg)、20090408(规格:20 mg)、20081210(规格:50 mg);昆明龙津药业股份有限公司,批号:20090210-2(规格:10 mg)、20090106-1(规格:25 mg)、20081124(规格:50 mg)。
2 方法与结果
2.1 凝胶法
2.1.1 TAL灵敏度复核[2]按2005年版《中国药典》(一部)细菌内毒素检查法“TAL灵敏度复核试验”规定进行检查。结果,TAL灵敏度的测定值(λc)均在0.5λ~2λ之间,所用TAL均可用于细菌内毒素检查。TAL灵敏度复核结果见表1(表中,+表示凝胶形成;-表示凝胶未形成)。

表1 TAL灵敏度复核结果Tab 1 TALsensitivity check results
2.1.2 细菌内毒素限值(L)的确定 本品临床用法为肌肉注射及静脉滴注,最大用量为1次20~50 mg,用500 mL10%葡萄糖注射液稀释后使用,1日1次。因此,计算静脉给药的L时还应考虑扣除大输液的细菌内毒素值,故L=K/M=(5 EU·kg-1·h-1-250 EU·(60 kg)-1)·h-1/(50 EU·(60 kg)-1·h-1=1 EU·mg-1。
2.1.3 最小有效稀释浓度(MVC)的计算[3]按公式MVC=λ/L计算(L=1 EU·mg-1,MVC以EU·mL-1表示)。目前,常用TAL最高λ为0.031 25 EU·mL-1,则试验时注射用灯盏花素的MVC为0.031 25 g·L-1。
2.1.4 干扰试验预试验 用WBET对2批注射用灯盏花素进行溶解稀释,使稀释浓度为2、1、0.5、0.25、0.125 g·L-1,取相应浓度样品稀释液加入WSE,制成内毒素浓度为1、0.062 5、0 EU·mL-1的供试品溶液,取TAL(批号:0901190)与上述系列溶液进行反应,每一浓度重复试验2管。结果,供试品溶液≥0.5 g·L-1浓度管加入1 EU·mL-1WSE的各试验管均呈阳性,其余各试验管均呈阴性,表明本品浓度≤0.5 g·L-1即可能对细菌内毒素与TAL的反应无干扰作用,故笔者选择了0.25 g·L-1的浓度进行正式干扰试验。干扰试验预试验测定结果见表2(表中,+表示凝胶形成;-表示凝胶未形成)。
2.1.5 正式干扰试验[2]按2005年版《中国药典》(一部)细菌内毒素检查法“供试品干扰试验”项下规定进行,将2个厂家各3批注射用灯盏花素分别用WBET制成0.25 g·L-1的供试品溶液,用WBET及0.25 g·L-1的供试品溶液将WSE配成浓度为2 λ、λ、0.5λ、0.25λ的试验液,用2个厂家的TAL进行试验。结果,Es均在0.5λ~2λ范围内,且Et也均在0.5Es~2Es范围内,即0.25 g·L-1供试品浓度对细菌内毒素与TAL的反应无干扰作用(Es、Et表示反应终点浓度的几何平均值)。正式干扰试验结果见表3、表4(表中,+表示凝胶形成,-表示凝胶未形成)。

表2 干扰试验预试验测定结果Tab 2 Interference pretest results

表3 正式干扰试验结果(TAL批号:0908281)Tab 3Results of interference test(TALno.0908281)
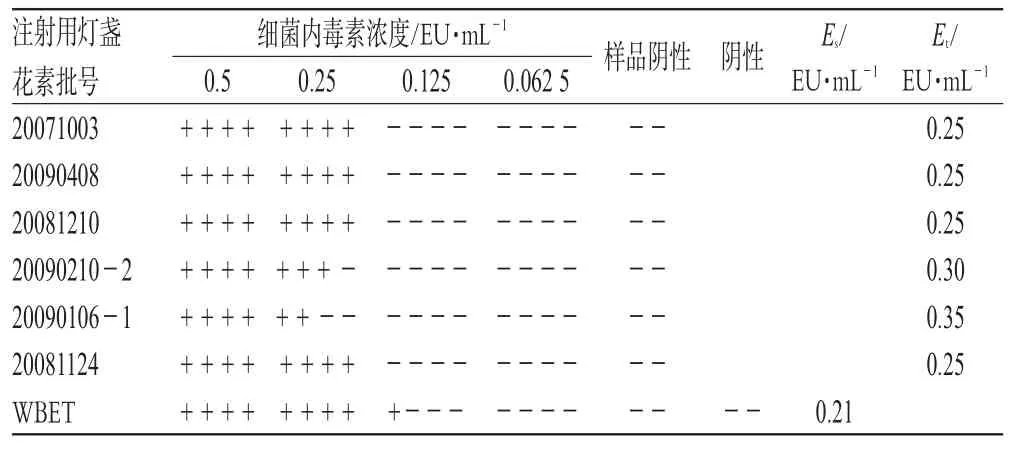
表4 正式干扰试验结果(TAL批号:0902270)Tab 4Results of interference test(TALno.0902270)
2.2 光度测定法
2.2.1L的确定 按“2.1.2”项下方法进行试验。
2.2.2 MVC的计算 按“2.1.3”项下方法进行试验。
2.2.3 检测波长的确定 注射用灯盏花素溶解后为黄色澄明液体,细菌内毒素测定仪有2种波长可供选择(450 nm、660 nm)。因黄色物质对检测光的吸收小,故笔者选择660 nm为检测波长。
2.2.4 标准曲线的可靠性试验 把WSE稀释为0.24、0.12、0.06、0.03 EU·mL-14个浓度的溶液,制备4个点的标准曲线,进行线性回归分析。结果,r>0.98、变异系数<10%时符合要求。用WBET稀释注射用灯盏花素至0.5、0.25、0.125 g·L-1,加入中间浓度为0.12 EU·mL-1的内毒素溶液作标准曲线,摸索供试品溶液在什么浓度下加样回收率最为理想。结果,回收率均在75%~125%之间,获得了较为理想的回收率;各稀释浓度下,样品细菌内毒素含量均<1 EU·mg-1,细菌内毒素检查均符合规定,表明可将注射用灯盏花素在660 nm波长处用光度测定法进行试验。细菌内毒素光度测定法试验结果见表5(表中,#表示内毒素低于检测限。TAL批号:0907102)。
3 讨论
细菌内毒素检查法是用TAL与细菌内毒素产生凝聚反应,以判断供试品中细菌内毒素是否符合规定的一种方法。目前,《美国药典》绝大多数品种已完成内毒素检查替代热原检查的修订。英国、日本也正在收集这一替代过程数据,我国也在加速进行试验研究,以建立更多药品注射液的细菌内毒素检查方法。
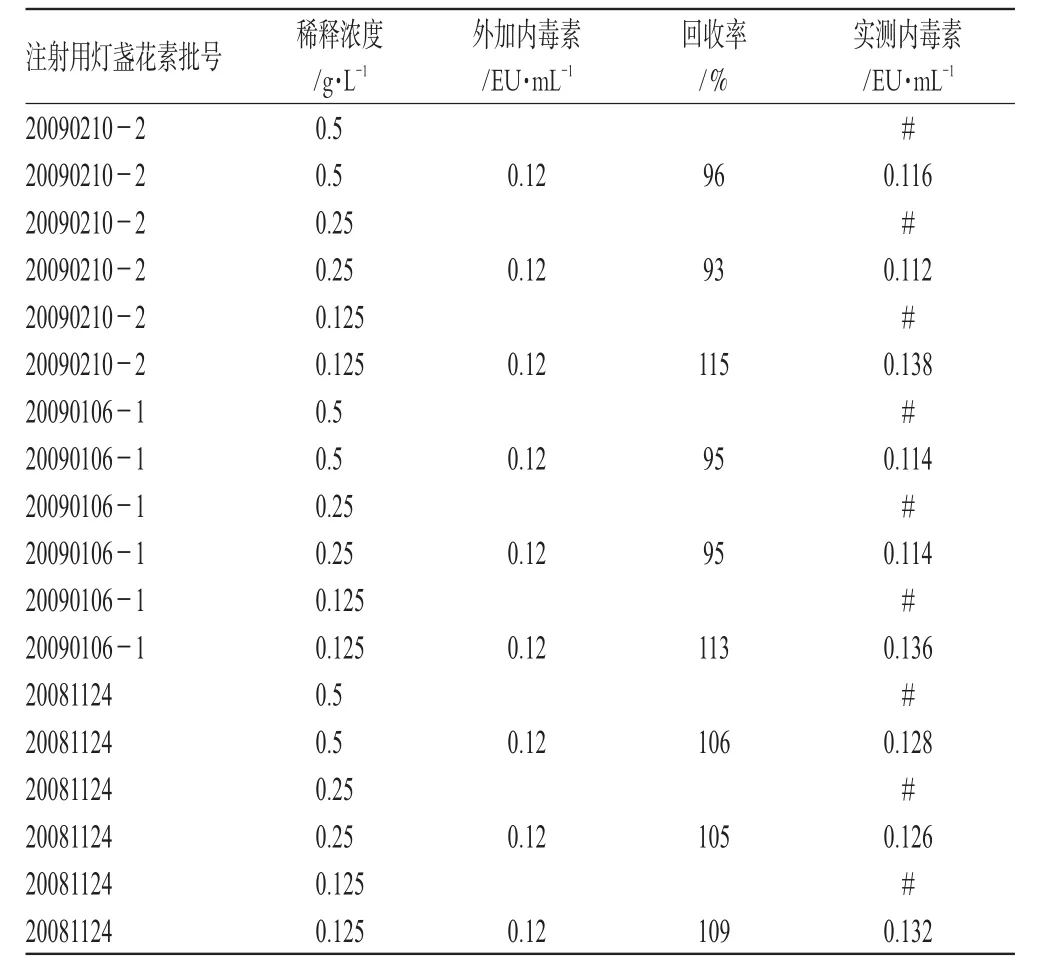
表5 细菌内毒素光度测定法试验结果Tab 5 Photometric technical test Results
细菌内毒素检查法在2005年版《中国药典》(一部)中收载有凝胶法和光度测定法2种。凝胶法是一限量试验,操作简便,主要为检验机构判定供试品细菌内毒素限值是否合格的检验手段。光度测定法是一定量试验,主要为药品生产企业采用,可定量测定供试品中含有的细菌内毒素值,以提高生产质量。注射用灯盏花素目前只有衡阳恒生制药有限公司和昆明龙津药业股份有限公司2个生产厂家,笔者对国家评价性抽验中2个厂家不同规格的6批样品,使用不同生产厂家和不同灵敏度的TAL进行了干扰试验。结果表明,高浓度注射用灯盏花素对于TAL与细菌内毒素的凝集反应有干扰(抑制)作用,经稀释后可以排除;浓度为0.25 g·L-1以野黄芩苷计的注射用灯盏花素对细菌内毒素与TAL的反应无干扰作用。除采用凝胶法进行细菌内毒素检查,亦可在660 nm波长处用光度测定法进行细菌内毒素检查。笔者对衡阳恒生制药有限公司的3批样品采用光度测定法进行细菌内毒素检查,昆明龙津药业股份有限公司的3批样品采用凝胶法进行细菌内毒素检查,所有检查结果与热原检查结果一致,均符合规定。结果表明,该药采用细菌内毒素检查法代替热原检查法,方法可行。
[1]国家药典委员会编.中华人民共和国药典(增补本)[S].2005年版.北京:化学工业出版社,2005:6.
[2]国家药典委员会编.中华人民共和国药典(一部)[S].2005年版.北京:化学工业出版社,2005:附录79.
[3]唐元泰.关于注射剂细菌内毒素检查限值的确定[J].中国药品标准,2003,4(4):5.
Study on Bacterial Endotoxin Test for Breviscapine for Injection
WANG Lu,ZHANG Hong-yu,LIU Qin(Yunnan Institute for Food and Drug Control,Kunming 650031,China)
OBJECTIVE:To develop bacterial endotoxin test for breviscapine for injection.METHODS:The limit of bacterial endotoxin(L)in this product was confirmed according to the appendix Ⅰ ofChinese Pharmacopoeia(2005 edition).We had studied the interference to bacterial endotoxin test by breviscapine for injection in order to confirm the noninterference concentration with gel clot techniques and photomeric techniques.RESULTS:Lwas 1 EU·mg-1Noninterference concentration of breviscapine for injection for bacterial endotoxin test was 0.25 g·L-1.CONCLUSION:It is feasible for bacterial endotoxin test instead of pyrogen test.
Breviscapine for injection;Bacterial endotoxin;Gel clot techniques;Photometric techniques
R915;R927.12
A
1001-0408(2010)39-3726-03
2010-03-03
2010-05-24)

