蛇床子素化合物合成研究进展
厉丹裴文
(浙江工业大学化学工程与材料学院,杭州 310014)
蛇床子素化合物合成研究进展
厉丹裴文
(浙江工业大学化学工程与材料学院,杭州 310014)
叙述了蛇床子素化合物合成方法研究进展,分别对Claisen重排、Freidel-Crafts烷基化、自由基反应和烯烃置换反应合成蛇床子素化合物的方法进行了概括和总结。
蛇床子素;合成;进展
1909年,Herzog和Krohn从伞形科植物欧前胡(Imperatoria Ostruthium L.)的根中首次得到蛇床子素化合物以来,人们对蛇床子素化合物的药理活性展开了大量的研究,发现了蛇床子素化合物的多种药理作用[1]。如抗心率失常、抗癌、抗衰老、抗炎止痒以及增强记忆力等[2-7]。由此,蛇床子素化合物的药理活性和构效关系引起了人们的广泛关注,也展开了一些合成方法学的研究[8-10]。
目前蛇床子素化合物的合成路线概括起来主要分为Claisen重排、Freidel-Crafts烷基化、自由基反应和烯烃置换反应4条合成路线。因此,为了深入开展蛇床子素化合物的合成研究,本文中对蛇床子素化合物的合成方法进行了概括和总结。
1 Claisen重排
1933年,Spath确定了蛇床子素5的结构之后,首次合成了蛇床子素5[11-12]。Spath利用2-羟基-4-甲氧基苯甲醛1钠盐与1-溴-3-甲基-2-丁烯2反应得到烯丙基醚化合物3,然后经Claisen重排得到4,收率为19.6%,最后再通过Perkin缩合反应得到了蛇床子素5:
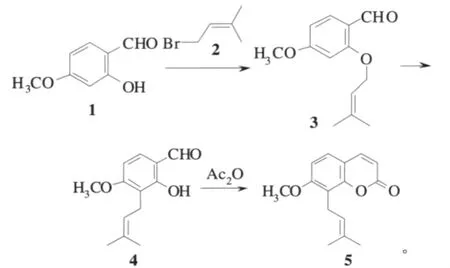
Spath的合成思路为后来的许多学者所采用。但是该反应步骤较多,并且2-羟基-4-甲氧基苯甲醛1进行Claisen重排时,副产物多、收率低。
1972年,Murayama M在直接利用苯甲醛1进行Claisen重排反应的基础上,对4的合成进行了研究,结果1的钾盐在苯溶剂中与2反应,得到了中间产物4,但是收率只有37.2%。在该工作中Murayama M找到了最佳的反应溶剂,提高了中间产物4的收率[13]。
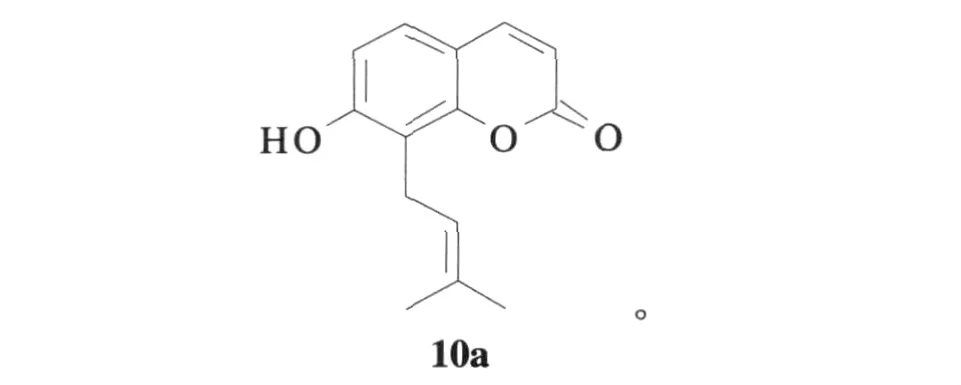
1970年,Murray RDH也采用Claisen重排方法合成蛇床子素化合物10a,利用7-羟基香豆素6a与3-氯-3-甲基-1-丁炔7在丙酮回流条件下反应得到香豆素醚8a,加氢还原得到9a,最后在130℃高温条件下重排得到了10a,收率为74%[14]。反应式为:


其中,a:R1=H,R2=H;b:R1=I,R2=H;c:R1=H,R2=C(CH3)2CHCH2。
Murray RDH直接以香豆素作为底物,利用Claisen重排反应高收率地制得了蛇床子素化合物,但是,仍然存在反应步骤长的问题。
1985年,Borges CJ等以6b为原料与7反应得到了8b,然后8b通过催化加氢得到9b,最后经Claisen重排得到了产物10b[15]。但只是以一种副产物形式得到了蛇床子素化合物。
1987年,Massanet等利用6b合成了9b,然后将9b分别在N,N-二甲基苯胺(DEA)和乙酸酐、醋酸钠溶液中进行Claisen重排得到了蛇床子素化合物10b,收率分别为25%和31%[16]。
1990年,Salva J等直接在香豆素环上进行Claisen重排的方法合成了8-异戊烯基-7-甲氧基-3-(3,3-二甲基丙烯基)香豆素10c,收率为80%。Salva J等还并利用10c反应得到了蛇床子素化合物 11,收率为 92%[17]:

2009年,Hang J和Yasumasa H利用12一步合成了9a(Scheme 4),不需要加氢还原,然后直接Claisen重排反应合成了10a,收率为71%[18-19]:

Hang J和Yasumasa H解决了Claisen重排步骤长的问题,但是原料12不易制得。
2 Freidel-Crafts烷基化
1964年,Schwarz J等利用1-溴-3-甲基-2-丁烯2对7-羟基-6-甲氧基-4-甲基香豆素13a进行烷基化反应得到了8-异戊烯基-7-羟基-6-甲氧基-4-甲基香豆素14a,收率为47%[20]。反应式如下:
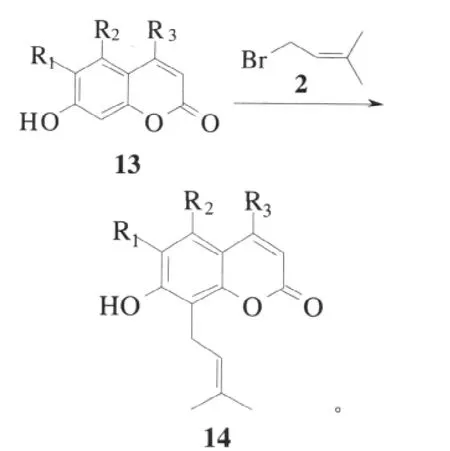
其中,a:R1=OMe,R2=H,R3=Me;b:R1=H,R2=H,R3=H;c:R1=OCH2CHC (CH3)2,R2=OCH2CHC (CH3)2,R3=Ph。
Schwarz J首次利用Freidel-Crafts烷基化一步反应高收率的合成了蛇床子素化合物,但是需要以价格昂贵的无水五氧化二磷为催化剂,反应条件苛刻,限制了它的广泛应用。
1986年,George B等以酸性氧化物三氧化铝为催化剂,得到了7-羟基-8-异戊烯基香豆素14b,产率为29%[21]。George B使用的是一种可重复使用的绿色催化剂,但是此催化剂作用下反应所需时间长,收率较低。
2006年,Imad R等人利用相转移催化剂四丁基氢氧化铵合成了8-异戊烯基-6,7-异戊烯醚基-4-苯基香豆素14c,收率为17%,仍然存在收率较低的问题[22]。
3 自由基反应
2004年,Mourad D等人首先将取代香豆素15溶解于苯和四氢呋喃的混合溶剂(体积比为1:1)中,然后加入2,在四丁基氢化物(THB)和催化剂偶氮二异丁腈(AIBN)条件下回流24 h,后处理得到了蛇床子素化合物16,收率约为40%[23]:

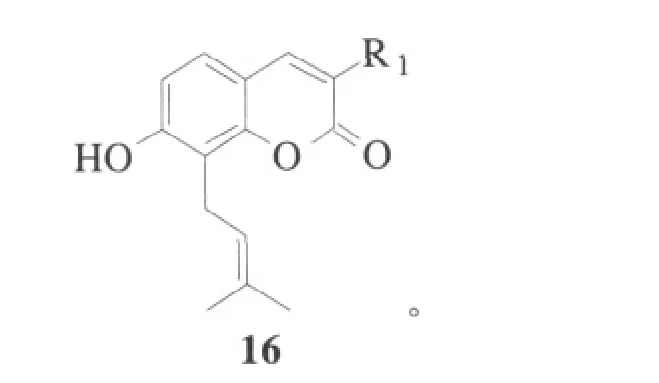
其中,a:R1=Br,R2=H;b:R1=H,R2=I。
由10a进一步转化得到了5:

Mourad D利用了自由基反应代替了取代反应,反应条件温和,收率有所提高。
Mourad D假设的反应机理为,羟基在这个自由基反应中是起决定作用的,并且7位上的氧原子起着基础性作用,形成了a、b、c、d和e共振体。由于共振体b的作用,保持了8-位上碳自由基的吡喃酮环[23]:

4 烯烃置换反应
2009年,Jakob M和Mark JC利用烯烃置换反应得到了10a,收率高达90%[24]。其过程是在Grubbs第2代催化剂(名称为1,3-双(2,4,6-三甲基苯基)-2-(咪唑烷亚基)(二氯苯亚甲基)(三环己基膦)钌)的二氯甲烷溶液中,将8-丙烯基-7-羟基香豆素17与2-甲基-2-丁烯18进行互换得到了10a:

此反应收率高,反应条件温和;但是所需原料不易制得,并且催化剂价格昂贵。
5 结束语
合成蛇床子素化合物主要采用的合成路线为Claisen重排,此路线原料易得、操作简单,且收率较高;其他合成路线即Freidel-Crafts烷基化、自由基反应及烯烃置换反应,所需反应步骤少、反应条件温和。目前关于蛇床子素化合物的合成路线报道较少,研究出一条收率高、选择性高的合成新路线,具有十分重要的意义。
[1]Emde H.Isomerism of Ephedrine and Pseudoephedrine[J].Archiv der Pharmazie,1909,247:54-55.
[2]周莉,上官珠,连其深,等.蛇床子素抗心律失常作用实验研究[J].现代应用药学,1996,13(2):11-13.
[3]Gawron A,Glowniak K.Cytostatic activity of coumarins in vitro[J].Planta Medica,1987,53(6):526.
[4]王桂云,张淑芹.蛇床子素对D-半乳糖致衰小鼠某些衰老指标影响的实验研究[J].中国林副产业,2003(3):8-9.
[5]IdeakiMatauda,Yasuko Ido,AtsushiHirata,etal.Antipruitice Effect of Cnidii Monnieri Fructus(Fruits of Cnidium monnieri Cusson)[J].Biol pharm Bull,2002,25(2):260-263.
[6]UrusotamBasnet,IkuyoYasuda,NorikoKumagai,etal.Inhibition of Itch-Scratch Response by fruits of Cnidium monnieri in Mice[J].Biol pharm Bull,2001,24(9):1012-1015.
[7]沈丽霞.张丹参,张力,等.蛇床子素对学习记忆的影响及其机制分析[J].药学学报,1999,34(6):405-409.
[8]Matsude H,Tomohiro N,Ido Y,et al.Anti-allergic effects of Cnidii Monnieri Fructus (Dried fruits of Cnidium monnieri)and its major component,osthol[J].Biol Pharm Bull,2002,25:809-812.
[9]Wu S N,Lo Y K,Chen C C,et al.Inhibitoryeffect of the plant-extract osthole on L-type calcium current in NG108-15 neuronal cells[J].Biochem Pharmacol,2002,63:199.
[10]Lee Y Y,Lee S,Jin J L,et al.Platelet anti-aggregatory effects of coumarins from the roots of Angelica genuflexa and A.gigas[J].Arch Pharm Res,2003,26:723-726.
[11]Spath Ernst,Pesta Otto.Plant fish poisons.III.Constitution of osthol (from Imperatoria ostruthium)[J].Berichte derDeutschen Chemischen Gesellschaft:Abhandlungen,1933,66B:754-60.
[12]Spath Ernst,Holzen,Herbert.Natural coumarins.X.Synthesis of osthole[J].Berichte der Deutschen Chemischen Gesell-schaft[Abteilung]B:Abhandlungen,1934,67B:264-265.
[13]MurayamaMasao,SetoEisuke,OkuboTakashi,etal.Synthetic studies on Suberosin and Osthol[J],Chemical&Pharmaceutical Bulletin,1972,20(4):741-746.
[14]Murray R D H,Ballantyne M M,Mathai K P.A method to introduce a 3,3-dimethylallyl unit ortho to a phenol[J].Tetrahedron Lett,1970(3):243-244.
[15]Borges del Castillo J,Rodriguez-Ubis J C,Rodriguez Luis F.Synthesis of several natural dihydrofurocoumarins and dihydropyranocoumarins[J].Quimica Organica y Bioquimica,1985,81(2):106-109.
[16]Massanet Guillermo M,Pando Enrique.Synthesis of 3-(1′,1′-dimethylallyl)coumarins:gravelliferone,chalepin and rutamarin[J].Heterocycles,1987,26(6):1541-1548.
[17]Salva Javier,Rodriguez Luis Francisco,Pando Enrique,et al.Synthesis of C-8 prenylated and angular 3-(1,1-dimethylallyl)coumarins[J].Heterocycles,1990,31(2):255-258.
[18]Hang Jiang,Yasumasa Hamada.Highly enantioselective synthesis of angelmarin[J],Org Biomol.Chem,2009 (20):4173-4176.
[19]T Kaiho,T Yokoyama,H Mori,et al.Preparation of pyrimidinedionesaspotassiumchannelopeners:JP,06128238[P].1994-06-28.
[20]Dyke S F,Ollis W D,Sainsbury M,et al.The extractives of Piscida erythrina.II.Synthetic evidence concerning the structureofichthynone[J],Tetrahedron,1964,20(5):1331-1338.
[21]Karl Heinz Gluesenkamp,George Buechi.C-Prenylation of phenols promoted by aluminum oxide surfaces[J].J Org.Chem,1986,51(23):4481-4483.
[22]Imad Raad,Raphael Terreux,Pascal Richomme,et al.Structure-activity relationship of natural and synthetic coumarinsinhibitingthemultidrugtransporterP-glycoprotein[J],Bioorganic&Medicinal Chemistry,2006,14(20):6979-6987.
[23]Daoubi Mourad,Duran-Patron Rosa,Hmamouchi Mohamed,et al.Screening study for potential lead compounds for natural product-based fungicides:I.Synthesis and in vitro evaluation of coumarins against Botrytis cinerea[J].Pest Management Science,2004,60(9):927-932.
[24]Jakob Magolan,Mark J Coster.Total Synthesis of (+ )-Angelmarin[J].J Org Chem,2009,74(14):5083-5086.
The Progress of Osthole Synthesis Research
Li Dan,Pei Wen
(College of Chemical Engineering and Materials,Zhejiang University of Technology,Hangzhou 310014)
Development of Osthole synthesis method is reviewed,which includes Freidel-Crafts reaction,the Claisen rearrangement,the free radical reaction and olefin crossmetathesis.
osthole;synthesis;review
TQ253.1
A DOI10.3969/j.issn.1006-6829.2010.05.0011
*通讯联系人。E-mail:peiwen58@zjut.edu.cn
2010-04-09

