实验兔出血症病毒检测方法的建立与免疫效果调查
周文伟,刘月环
(浙江省医学科学院 浙江省实验动物中心 浙江省实验动物质量监督检测站,杭州 310013)
调查报告
实验兔出血症病毒检测方法的建立与免疫效果调查
周文伟,刘月环
(浙江省医学科学院 浙江省实验动物中心 浙江省实验动物质量监督检测站,杭州 310013)
目的检测全省六个实验兔场的兔子所携带的兔出血症病毒(RHDV)情况,调查实验兔RHDV抗体水平,评价不同疫苗的免疫效果,比较HAI与ELISA两种方法的符合率。方法采用HAI、ELISA方法对1168份实验兔RHDV抗体进行了检测,并与RT-PCR方法的检测结果进行对比分析。结果我省实验兔免疫情况较好,不同饲养场的实验兔免疫合格率虽有不同,但未发生疫情。通过比较发现ELISA法检测的抗体合格率明显高于HAI法。结论LISA、HAI和RT-PCR方法均适合实验兔RHDV的检测。
兔出血症病毒(RHDV);血凝抑制实验(HAI);酶联免疫吸附实验(ELISA);反转录聚合酶链式扩增(RT-PCR)
自1984年兔瘟疫情首次报道以来,该病几乎波及全国所有的养兔地区。就浙江省而言,兔瘟疫情也一直没有中断过。在早期的研究中,人们主要集中于兔瘟的临床诊断、治疗、流行病学调查和组织灭活疫苗研究等方面。查明了该病的病原,初步弄清了RHDV发病特点,揭示了流行病学规律[1]。在疫病防控方面,由于没有找到合适的细胞系,一直没有被研制出细胞灭活苗,减毒疫苗株也无法进行驯化。因此,兔瘟疫苗的制备主要依赖于发病兔组织的灭活。这种疫苗虽然很有效,但是生产安全难以保证,时刻存在散毒的危险,生产成本也高。动物疫情月报显示,近年来,我省每年都有数十起兔瘟疫情的发生,给养兔业构成巨大威胁。兔瘟病毒是一种RNA病毒,迄今该病毒是否发生了遗传基因的变异?若有,则这些进化性变异对病毒的致病性和流行病学有什么影响?当前使用的兔瘟疫苗和防控措施是否仍然有效等,一直是悬而未决的问题。
根据浙江省科技厅关于“十一五”医药行业及实验动物行业的发展与规划,为确保我省医药业实验兔质量,我们开展了兔出血症病毒(RHDV)血清学检测方法的研究,采用HAI、ELISA方法对从六个实验兔生产基地获得的1168份兔血清进行兔出血症病毒检测。同时用RT-PCR方法对上述样品的全血进行RHDV检测,比较HAI与ELISA两种方法检测结果的符合率。
1 材料和方法
1.1 血凝抑制实验(HAI)
依据 GB/T14926.21-2008,GB/T14926.54-2001中的方法。
1.2 酶联免疫吸附法(ELISA)
1.2.1 试剂盒的制备:采用 pET表达系统高效表达的RHDV衣壳蛋白氨基端高抗原指数区作为抗原包被可拆96孔酶标板,以辣根过氧化物酶标记羊抗兔IgG制备100倍浓缩酶结合物工作液,以间接ELISA法直接检测兔血清样品中的 RHDV抗体。样品稀释液为含吐温 -20的0.01 mol/L磷酸盐缓冲液(pH 7.4);10×浓缩洗涤液为含吐温-20的0.1 mol/L磷酸盐缓冲液(pH 7.4);100×浓缩底物贮存液为含四甲基联苯胺(TMB)的二甲基亚砜(DMSO)溶液;底物缓冲液为含过氧化氢的柠檬酸—磷酸盐缓冲液;终止液为 2 mol/L硫酸溶液。阳性对照为经RHDV组织灭活疫苗免疫新西兰兔获得的高免阳性血清;阴性对照为非RHDV免疫兔经筛选获得的血清。在进行精密性、特异性、重复性、稳定性、敏感性等ELISA法常规指数测试后组装。
1.2.2 检测步骤:(1)将10×浓缩洗涤液用蒸馏水稀释10倍即为洗涤液和酶标二抗稀释液;(2)将待检血清用样品稀释液作1∶100稀释,按100 μL/孔加入抗体检测板中,同时设空白(只加100 μL样品稀释液)、阴性对照和阳性对照每孔各 100 μL,37°C孵育45 min,甩干;(3)每孔加洗涤液200 μL,洗涤3次,每次间隔1 min,拍干;(4)用洗涤液将100×浓缩酶标二抗贮存液稀释 100倍至工作浓度,每孔加100 μL,37℃孵育45 min,甩干;(5)每孔加洗涤液200 μL,洗涤3次,每次间隔1 min,拍干; (6)用底物缓冲液将100×浓缩底物贮存液稀释100倍至工作浓度,每孔加 100 μL,37℃避光孵育10 min;(7)加50 μL终止液,用酶标仪在450 nm波长下读取每孔光吸收值(A450 nm值)。
1.2.3 判定标准:在阳性对照孔 A450>0.5,阴性对照孔A450<0.2的前提下,样品孔A450/阴性对照孔A450≥2.1判定为阳性,样品孔本身 A值 >0.2,反之为阴性。如果阳性对照孔A450<0.5,或阴性对照孔A450>0.2,表明试剂盒失效或检测操作有误,需重新检测。
1.3 RT-PCR方法 见参考文献[2]
1.4 样品
1168份兔血样来源于浙江省六个实验兔场(标为Y,P,S,J,N,L)。采样方式主要是兔耳动脉血2 mL,均分为抗凝和不抗凝两种,其中抗凝血用于RT-PCR法活体检测 RHDV病毒,不抗凝血用于HAI法和ELISA法检测样品RHDV疫苗免疫抗体效价。各场的数量分别是L场70份、S场316份、P场415份、Y场221份、J场64份、N场82份。
2 结果与分析
2.1 六个实验兔场实验兔RHDV血清抗体检测
见表1,2,3。
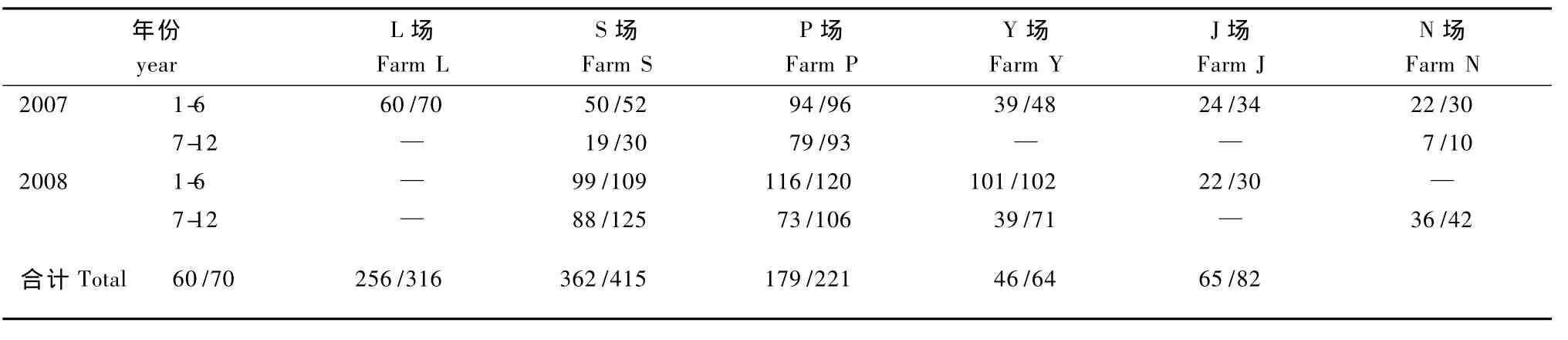
表1 HAI法检测RHDV血清抗体结果Tab.1 RHDV-positive cases detected by HAI

表2 ELISA法检测RHDV血清抗体情况Tab.2 RHDV-postive cases detected by ELISA

表3 HAI法与ELISA法检测RHDV抗体结果Tab.3 The coincidence rate of RHDV detection by HAI and ELISA
2.2 两种检测方法的比较
对HAI与 ELISA两种检测方法进行了 Kappa检测,结果见表4、表5。
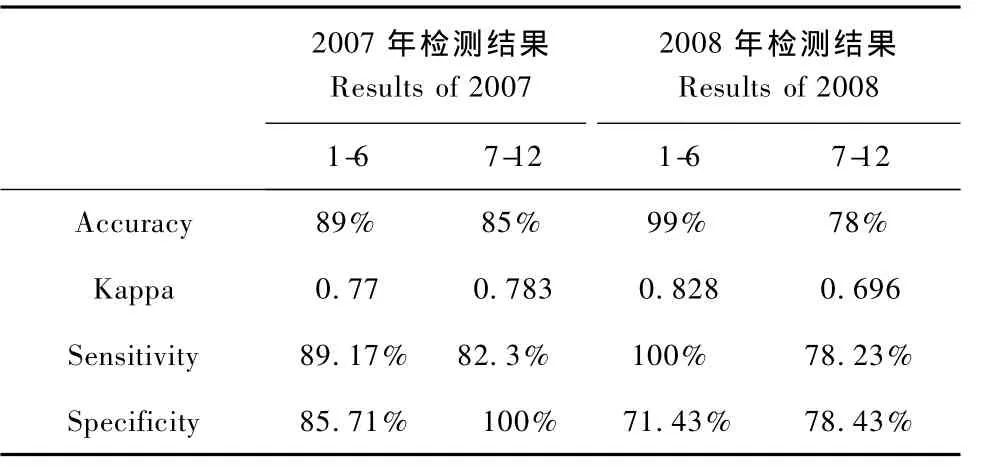
表4 HAI与ELISA两种检测方法年度比较Tab.4 Analysis of the effect of sampling time on RHDV detection using kappa test
从数据可以看出,我省的实验兔免疫情况较好,各场的合格率虽有不同,但结果良好。通过对两种方法的比较中,我们可以看出ELISA法检测结果的合格率明显高于HAI法。Kappa值(P<0.01)在年度的比较中分别为0.77、0.783、0.828、0.696,在场间的比较中分别是J场0.775、L场0.959、N场0.864、P场0.838、S场0.829和Y场0.71。年度间检测结果的一致性较好,场内年度间检测结果的一致性较高,说明该方法较为可靠。HAI虽然价格低廉,但操作复杂,结果的判定与观察者的经验有很大关系,而ELISA与其相比有明显的优势,操作过程简单化,结果可以用仪器精确测定,准确性高,适用于实验室大规模的病毒检测。国外研究表明ELISA比 HAI的假阳性率要低。[3]该法通常以抗RHDV的多克隆血清或针对RHDV衣壳蛋白上不同表位的单克隆抗体包被ELISA板进行检测,并可用于病毒抗原特性的研究。
在检测的1168份实验兔全血中,可疑样品有14份,分别是L场2、S场2、P场5只、Y场4只、N场1只,都在非免兔中,用 HAI进行验证性检测表明,3个是阴性;14个PCR阳性样品中有10个HAI是阳性,3个阴性。检测敏感度达100%,特异性为99.12%,经统计检验,kappa=0.865,表明RT-PCR检出RHDV的结果与HAI高度一致。上述14个可疑样分布在 5个场中,进一步跟踪,未发现兔场疫情。
3 讨论

表5 HAI与ELISA两种检测方法兔场之间比较Tab.5 Analysis of the effect of HAI and RHDV detection among different farms by kappa test
根据GB14922.2-2008,兔出血症病毒(RHDV)是普通级实验兔必检项目,实验兔免疫后的抗体水平需达到保护效价才算合格。同时,规定了抗体水平检测方法为血凝试验(HA)和血凝抑制试验(HAI),病原检测采用RT-PCR法。前二种方法均耗时长,对样品处理的方法和检验人员技术经验要求高,特别是红细胞难以长期保存。RT-PCR作为一种分子生物学技术现在已被广泛地用于检测各种病原微生物和寄生虫,近年来我国实验动物界也有将此项技术用于科研项目中的病原体检测的一种探索,虽然该项技术还不是国标规定的首选检测方法,但由于其直接检测病原体的遗传物质,具有特异性好,敏感性强,便于自动化分析,省时等优点,成为今后检测病原体的一种主流方法。
间接ELISA法作为一种易于标准化的检测方法,主要通过基于该法生产的试剂盒及酶标仪来实现,检测用的试剂盒由包被抗原的96孔板,阴、阳性血清对照,酶标二抗,底物及底物缓冲液,终止液,稀释液及封板膜组成,该方法是目前实验动物质量控制中普遍使用的方法。由于兔出血症病毒一直没有高纯化的抗原,从而ELISA法检测试剂盒的生产曾经是难题。本研究在前期研究中已表达的蛋白研制出ELISA检测试剂盒,为给我省制订全面而有效的实验兔RHD防治措施提供理论依据和检测方法支持,同时本课题实施后的兔 RHDV抗体ELISA法检测试剂盒,已送全国九个省、市、自治区试用,结果大都反应良好。
该病爆发后的早期,我国曾有报道认为因兔出血症疫苗均是组织灭活苗,个别批次确有因灭活不彻底而导致有些兔场在疫苗免疫后3~10 d或半月左右出现动物死亡现象,有些联苗(兔瘟、巴杆二联)因单苗之间质量不好,造成免疫失败。但随着制苗技术的成熟,无论单苗还是联苗,有相同的免疫效果.联苗(兔瘟、巴杆二联)品种间没有干扰作用,并且巴杆为革兰氏阴性小杆菌,其免疫活性质多糖等成分具有优剂效应[4]。疫苗的贮存,一般认为在(2~8)℃时可保存半年,25℃以下可保存半个月。疫苗的效价小于24时,会导致免疫失败。调查中了解到,全省六个实验兔基地(场)中,S场、N场和L场使用的是浙江省农科院自制的兔瘟、巴杆二联疫苗;J场和P场(2007年)使用的是南京天邦生物科技有限公司生产的兔病毒性出血症单联灭活疫苗;Y场和P场(2008年)使用的是齐鲁动物保健品公司生产的兔出血症灭活疫苗。采用 ELISA为比较基准,这几个兔场的免疫合格率都达到70%以上,免疫方式上都是30~60日龄初免,均是颈部皮下注射,所不同是二免情况,各场根据存栏时间长短安排二免,时间大致是初免一个月到半年内,J场对于种兔还在第二年再兔一次。从免疫效果上看,三种疫苗均是组织灭活苗,六个兔场(生产基地)将疫苗购回后均能进行低温保存和按规定使用,根据两年来的检测结果我们认为疫苗质量、免疫情况较好,没有发生疫情。
另外,根据我们的调查,浙江省健康的实验兔中RHDV(14只阳性)仍然存在,其中3个PCR检测结果为阳性的样本与用HAI法检测结果不一致(该法检测结果为阴性),原因可能与RHDV的表达产物是否有活性有关。因此,今后对于该病的防控,兔场最好应定期对兔病毒性出血症 HAI抗体滴度进行监测,滴度在24以下时即进行免疫。同时,免疫前应对疫苗效价进行监测,血凝价低于24时,应停止使用该批疫苗。我们主张每个场继续保持现有的免疫方式和疫苗来源,以巩固目前的防御效果为目标,但因调查时发现健康兔群中RHDV依然存在,因此对该病就应该给予足够的重视,按时免疫和加强饲养管理,防止因为疫苗保存或管理不善造成免疫失败从而招致疫情爆发。
[1] Sánchez-Campos S,Alvarez M,Culebras JM,et al.Pathogenic molecular mechanisms in an animal model of fulminant hepatic failure:Rabbit hemorrhagic viral disease[J].The J Lab Clin Med,2004,144(4):215-222.
[2] 刘月环,楼琦,金晓音,等.兔出血症病毒遗传变异分析及RT-PCR检测方法的建立[J].中国比较医学杂志,2008,18 (11):44-49.
[3] Rodak L et al.Enzyme-linked immunosorbent assay of antibodies to rabbit hemorrhagic disease virus and determination of its major structural proteins.J Gen Virol,1990,71:1075-1080.
[4] 佟承刚.家兔出血症疫苗免疫失败原因及对策[J].中国养兔杂志,1996,6:30-31.
Establishment of Three Methods for Detection of Rabbit Hemorrhagic Disease Virus in Rabbits and Investigation of Their Immunization Effects
ZHOU Wen-wei,LIU Yue-huan
(Zhejiang Provincial Center of Laboratoy Animals,Zhejiang Academy of Medical Sciences,Hangzhou 310013,China)
ObjectiveTo investigate the rabbit hemorrhagic disease virus(RHDV)prevalence in six rabbits farms in Zhejiang province,and evaluate the immunization effects of Zhejiang RHDV rabbit vaccines。Methods1168 serum samples of laboratory rabbits were tested for the RHDV by hemagglutination inhibition(HAI)and ELISA assays. RT-PCR was employed to detect the RHDV prevalence。ResultsImmunization of rabbits in our province was good,although the passing rate was varying,there was no epidemic outbreak.By the two indirect serum detection methods,HAI and ELISA,the passing rate of ELISA method was significantly higher than that of the HAI method。Conclusions Three detection methods have been established,suitable for the detection and control of RHDV in laboratory rabbits in Zhejiang province.It provides an effective means of detection,prevention and control of rabbit hemorrhagic disease outbreak.
Rabbit hemorrhagic disease virus,RHDV;Hemagglutination inhibition,HAI;Enzyme-linked immunosorbent assay,ELISA;Reverse transcription-polymerase chain reaction,RT-PCR
R-33
A
1671-7856(2010)04-0059-04
2009-12-15
浙江省科技厅实验动物科技计划项目(2007F80011)。
周文伟(1969-),女,实验师,研究方向:动物医学,E-mail:hh5498@126.com。
刘月环(1974-),女,副研究员,硕士,研究方向:生物技术与实验动物育种,E-mail:yuehuanliu@163.com。

