流感病毒的分子生物学研究进展
张 伟,王承宇,杨松涛,高玉伟,夏咸柱,
(1.中国医学科学院医学实验动物研究所 北京协和医学院比较医学中心,北京 100021; 2.军事医学科学院军事兽医研究所,长春 130062)
综述与专论
流感病毒的分子生物学研究进展
张 伟1,2,王承宇2,杨松涛2,高玉伟2,夏咸柱1,2,
(1.中国医学科学院医学实验动物研究所 北京协和医学院比较医学中心,北京 100021; 2.军事医学科学院军事兽医研究所,长春 130062)
流感病毒是分节段的负链RNA病毒,由RNA依赖的RNA聚合酶起始病毒的复制。流感病毒的特殊基因组结构和病毒蛋白的功能使其极易发生抗原转换和抗原漂移,这使得病毒能够逃避多种宿主的长效中和性免疫反应。本文从病毒结构、基因组及其编码蛋白质、病毒复制过程和病毒的易感宿主等几方面论述了流感病毒的分子生物学研究进展。
流感病毒;RNA病毒;抗原转换;抗原漂移
流感病毒归属于正粘病毒科(Orthomyxoviridae),是分节段的负链 RNA病毒。根据核壳蛋白(NP)和基质蛋白(M)抗原性的差异,将流感病毒分为A、B和C型,三个型流感病毒的测序结果表明,他们来源于共同的祖先,但是,在遗传学上,他们存在差异。A型流感病毒根据其抗原性差异分为16个血凝素(HA)亚型和9个神经氨酸酶(NA)亚型,其中人类感染似乎限于H1、H2、H3亚型和N1、 N2亚型,但是自 1997年以来,还出现了 H5N1、H7N7和H9N2亚型禽流感病毒直接感染人的报道,尤其是H5N1亚型高致病性禽流感病毒感染人群后会产生高致死率;猪流感病毒一般不感染人类,但是由于猪是流感病毒的中间宿主,所以重组之后的新型猪流感病毒可能会获得感染人并致病的能力,例如,猪源2009甲型H1N1的全世界流行和爆发。这些动物源性的流感病毒在人群中的高致死率和广泛流行,已经引起全世界高度关注。
1 病毒粒子的结构和组成
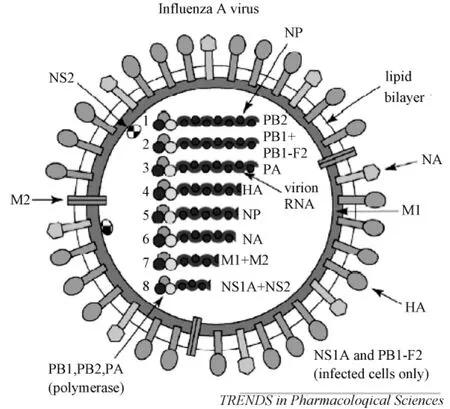
图1 A型流感病毒的形态与结构[1]Fig.1 The structure of influenza A virus[1]
A型流感病毒的形态与结构如图 1[1]。电镜下,病毒呈球状或丝状,球状时直径达100 nm,丝状时可长达300 nm。A型流感病毒粒子表面有两种形态不一,长度均为10~20 nm的糖蛋白突起,即血凝素(HA)和神经氨酸酶(NA),均具有抗原性,HA与NA比例为4∶1至5∶1。病毒粒子的表面还存在一种数量更少的跨膜蛋白——M2离子通道蛋白,M2与HA比例为1:10~100[2]。位于病毒粒子双层脂质包膜下的是基质蛋白M1,它是病毒颗粒中含量最多的蛋白,构成病毒包膜的框架。在 M1内部与其连接的是核输出蛋白(NEP;也被称作非结构蛋白2,NS2)和病毒的核糖核蛋白(RNP)复合体。RNP在病毒内部,由4种蛋白和病毒的RNA组成:核蛋白(NP)是病毒核衣壳中主要的亚单位,它包绕着病毒的RNA基因组,还包括由三种多聚酶蛋白组成的RNA依赖的RNA多聚酶复合体,这三种蛋白分别为PB1、PB2和PA。B型流感病毒粒子的结构与A型相似,具有4种膜蛋白:HA、NA和NB、BM2 (代替M2);C型流感病毒粒子的结构不同于A型和B型流感病毒,它感染细胞后,在细胞表面能形成一个长达500 μm的索带状结构,但是 C型流感病毒在组份上与其他两型是相似的,含有突出于外膜的糖蛋白、位于病毒粒子双层脂质包膜下的基质蛋白和RNP复合体。C型流感病毒粒子只有一个主要的膜糖蛋白——血凝素酯酶融合蛋白(HEF),它的作用相当于A型和B型流感病毒中的HA和NA;另外,在 C型流感病毒表面还有一个膜蛋白——CM2。
2 流感病毒基因组结构

表1 A/Tiger/HarBin/01/2002(H5N1)禽流感病毒的基因组与编码蛋白Tab.1 The genomic segments and proteins of influnza A/Tiger/Harbin/01/2002(H5N1)virus
A型和B型流感病毒的基因组都由八个负链单股RNA片段组成,而C型流感病毒只有七个片段,A型流感病毒的基因组和编码蛋白见表 1。A型和B型流感病毒基因组中的片段1、片段3、片段4和片段5每个只编码一种蛋白:PB2、PA、HA和NP蛋白;所有的流感病毒的片段2都编码聚合酶亚基PB1蛋白,在某些A型流感病毒中,片段2还编码一个87个氨基酸组成的辅助蛋白——PB1-F2。PB1-F2是偶然发现的一种蛋白,人们原想寻找一些流感病毒基因编码的、因改变阅读框翻译产生的、没有功能的蛋白碎片,看能否被小鼠 CD8+T细胞识别,结果发现了由PB1+1阅读框编码的PB1-F2蛋白[3]。应用免疫荧光技术进一步发现,PB1-F2不象一般的“絮肽”只是少量分散在细胞中,而是在细胞线粒体中大量存在。PB1-F2能诱导细胞凋亡,推测是由于PB1-F2损害细胞内部的能量工厂——线粒体,杀死免疫细胞(单核细胞),从而使机体无法对流感感染作出反应并抵抗病毒攻击。
目前为止,在已确定的B型或C型流感病毒还没有发现类似PB1-F2的蛋白。另外,A型流感病毒的片段6也只编码一种蛋白——NA,而B型病毒的片段6编码NA和NB基质蛋白(-1编码阅读框),NB基质蛋白是一个膜整合蛋白,相当于 A型流感病毒的M2蛋白[4]。A型和B型流感病毒的片段7都编码M1基质蛋白,在A型流感病毒中,M2离子通道蛋白是由片段7通过RNA剪切机制表达的[5],而在B型流感病毒中,BM2是由片段7通过+2编码阅读框机制表达的[6]。最后,A型和 B型流感病毒的片段 8编码非结构蛋白 1(NS1)[7],并通过mRNA剪切机制产生NS2[8],它是协助病毒RNP复合体出细胞核;一般来说,C型流感病毒的基因组结构与A型和B型相似,然而,C型流感病毒的HEF蛋白代替了HA和NA蛋白的功能,这样,C型流感病毒的基因组就比 A型和 B型少了一条 RNA片段。
每一病毒RNA(vRNA)的末端都形成一个螺旋型发卡结构,并与RNA聚合酶复合体相连接;每个vRNA的剩余部分被富含精氨酸的NP蛋白所覆盖,这样的正电荷性网络结构结合每个vRNA上的带有负电荷的磷酸骨架。每个vRNA的3’和5’末端都含有长短不一的非编码区,然而,每个片段的最末端在所有流感病毒基因组中都是高度保守的,这些部分的互补末端,通过碱基配对,作为vRNA复制的启动子,同时也在转录过程中发挥作用。这些非编码区还含有 mRNA多聚腺苷酸信号和病毒组装的部分包装信号。
Mandler等[9]通过对AIV温度敏感突变株的研究证实,NP蛋白结合8个流感基因组RNA后形成核糖核蛋白体(RNP)的能力是AIV复制和感染必须的。通过对NP蛋白晶体 X光衍射分析发现,所有流感病毒的核糖核蛋白圆柱体末端均有由3个NP蛋白亚单位形成的环性结构,该结构包含病毒聚合酶的结合位点,是使病毒形成核糖核蛋白复合体(RNP),保障病毒感染与复制的一个关键结构。研究者指出,核蛋白是传播病毒的“元凶”之一,只要阻止NP蛋白圆柱体的形成,可能阻断病毒的复制与感染[10]。
流感病毒的RNA聚合酶复合体包含三种蛋白,分别为PB1、PB2和 PA。它是多功能酶,同时也具有转录酶活性及核酸内切酶活性,其中聚合酶的PA蛋白能够被胰蛋白酶切割为两个部分,55 kD的PAC段部分(257-716)和25 kD的PAN端部分(1-256)。PAC主要和PB1N端部分结合(1-25),晶体衍射实验可以看到PAC的结构类似于龙头状,其分为两个区域,区域一为脑袋部分,区域二为龙嘴部分;PAC龙嘴部分与PB1N端部分作用,序列分析表明这部分氨基酸在各型流感病毒上是保守的[11]。在vRNA的合成中,PA通过 PAN末端优先连接cRNA启动子而不是 vRNA启动子,这可能是 PAC的沟和通道辅助募集 cRNA[12],但是另一个研究显示 PB1连接 cRNA启动子[13],这需要进一步的研究。
禽流感病毒聚合酶的核酸内切酶活性对于从宿主mRNA上切割“帽”引物起始病毒mRNA的转录是非常关键的,以前的研究认为禽流感的内切酶活性在 PB1上,E508,E519和 D522起关键作用[14]。但是最近的研究表明,通过突变分析,PAN具有核酸内切酶活性,而非 PB1[15,16];另外,PAN还具有稳定蛋白、结合帽子结构和结合启动子等多种功能[17-19]。PA蛋白晶体结构的最新研究,尤其是PAC-PB1N相互作用的结构,丰富了我们对流感病毒复制和转录的分子生物学基础的理解,也有助于我们了解 PB2如何发挥核输入作用和帽结合作用[20,21]。
流感病毒基因组是由分节段的RNA组成,这种结构特点导致了基因组的易变性和抗原的多变性,例如抗原转换。A型流感病毒可以通过抗原转换从其他不同亚型的流感毒株中获得 HA,也可能获得NA,这样的片段重组可以发生在感染了不同的人和动物流感病毒的细胞中。这样的病毒完全可以编码新型的抗原蛋白。如果人群对于通过抗原转换机制产生的新病毒易感并缺乏免疫的时候,流感的大流行就可能爆发。1918—1919年的“西班牙”H1N1流感病毒就可能是通过抗原转换机制产生的,对于现代社会来说,由其引起的大流感所导致的死亡率是空前的。通过对重新改造的1918流感病毒的特征分析,研究者指出HA、NA和PB1基因都和高致病性有关[22,23]。据此,病毒获得新的表面抗原有可能导致流感的大流行,并对易感人群和缺乏免疫能力的人群造成严重后果。
3 流感病毒的复制
3.1 病毒的吸附
流感病毒可以识别宿主细胞表面的 N-乙酰神经氨酸酶(唾液酸),它是一种酸性九碳单糖,广泛存在于N-糖链和O-糖链末端。唾液酸末端2-C上的羟基能结合3-C或6-C上的半乳糖,形成 α-2,3或α-2,6糖苷键,这些不同的糖苷键使得唾液酸末端产生独特的空间结构。病毒表面的HA蛋白可以识别并结合这些唾液酸结构,最常见的是 SAα-2,3Gal和SAα-2,6Gal(N-乙酰基Neu5Ac和N-乙酰基Neu5Gc常简称SA)。人类的支气管上皮细胞主要是SAα-2,6Gal连接,而禽类主要是 SAα-2,3Gal连接;人类的呼吸道上皮细胞也存在少量的 SAα-2,3Gal连接形式的唾液酸,正因为如此,人类和其他灵长类动物也可以被禽流感病毒感染。
在哺乳动物呼吸道上,差异表达的唾液酸受体有助于我们理解禽流感病毒在哺乳动物上的低感染率和高致病性。人类呼吸道上皮细胞含有少量SAα-2,3Gal连接形式的唾液酸,它主要存在于下呼吸道(细支气管和肺泡),相比上呼吸道而言,病毒粒子更难达到下呼吸道,因此,人类相对不容易感染禽流感;但是,一旦病毒到达下呼吸道的上皮细胞,人类机体就会产生严重的、急性进展性肺炎,病死率高达60%[24]。
HA分子的晶体结构是一个三聚体,具有两个明显的结构区域:一个是茎部结构,含有一个三联的α-螺旋;另一个是球形的头部,含有反向平行的 β-折叠。头部含有唾液酸结合位点,在其周围是可变的抗原决定簇。在病毒复制过程中,HA蛋白被丝氨酸蛋白酶裂解为两个以二硫键相连的亚单位——HA1和HA2,这种翻译后的蛋白质修饰是病毒感染的必要条件。HA2蛋白的N末端介导病毒外膜与细胞膜融合,而HA1蛋白包含受体结合位点和抗原位点。针对HA的抗体可以中和病毒,因此病毒株在抗原位点频繁改变氨基酸序列;然而,HA分子的“茎-头结构”在各亚型和毒株中是保守的。这种在氨基酸序列上的少量变化称为抗原漂移,实际上,多个抗原位点的突变往往会使病毒逃逸宿主的抗体中和反应,而对于突变的毒株,宿主也变得易感。
3.2 病毒的侵入
随着流感病毒的HA蛋白(或者是C型流感病毒的HEF蛋白)结合唾液酸,病毒被宿主细胞内吞。吞噬泡中的酸度对于病毒脱衣壳是至关重要的,病毒膜上M2蛋白的离子通道可以使吞噬泡的 pH逐步下降。当pH降至5.0~6.0时,HA2蛋白的结构发生改变;位于HA2蛋白氨基末端的融合肽移位,进而激活融合过程,致使病毒的双层类脂膜与细胞膜融合,释放出病毒颗粒内部的 RNPs到宿主细胞浆[25]。M2蛋白是一个跨膜的离子通道,仅在 A型流感病毒中被发现,它有一部分延伸到病毒外膜表面。
3.3 病毒基因组RNA的合成
RNPs从病毒粒子释放到宿主细胞浆中后,通过核定位信号(NLSs)进入细胞核,这个过程中,NLSs指导宿主细胞蛋白携带RNPs和病毒其他蛋白进入细胞核。病毒基因组 RNA的合成在细胞核中进行——加帽和 mRNA的多聚腺苷酸化。病毒的RNA聚合酶利用负链的vRNA作为模板合成两种正链RNA——mRNA和cRNA,其中cRNA作为模板,在RNA聚合酶作用下,合成更多的病毒基因组vRNA(图2),但mRNA不是全长vRNA的复制品。mRNA转录在病毒繁殖周期的早期阶段进行,cRNA及vRNA的合成则在中、晚期阶段。
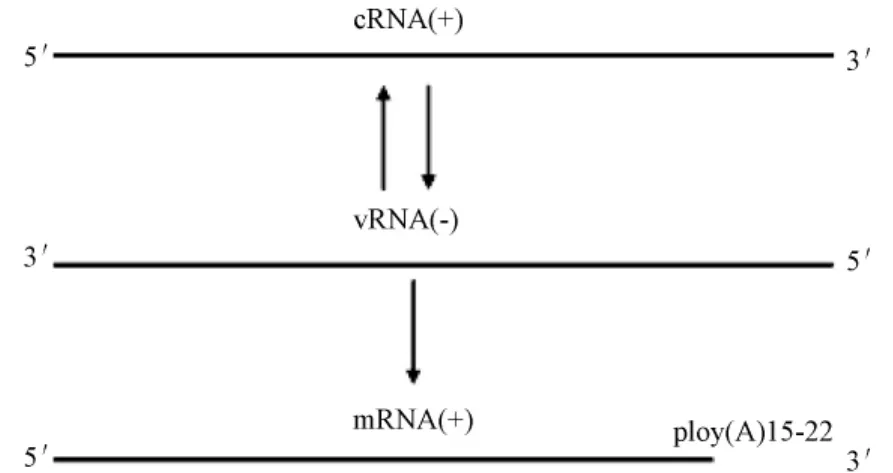
图2 A型流感病毒基因组的复制和转录Fig.2 Replication and transcription of influenza A virus
宿主细胞mRNA的多聚腺苷酸化是通过特异的腺苷酸化酶完成的,与之不同的是,病毒 mRNA的腺苷酸尾是由负链的vRNA上连续的5-7个尿嘧啶转录形成的。病毒各个信使RNA(mRNA)的加帽是以相似的方式完成的:PA(先前认为是PB1)和PB2蛋白“攫取”宿主pre-mRNA转录体的5’加帽引物,并进而启动病毒mRNA合成,这个过程被称作“cap snatching”。
一旦完成了多聚腺苷酸化和加帽,病毒的mRNA出核,进入细胞质,并像宿主细胞中的mRNA一样进行翻译。病毒vRNA片段的核输出是由病毒的M1蛋白和 NS2蛋白介导的。M1蛋白可以与vRNA和 NP蛋白相作用,同时,也与核输出蛋白NS2作用;由此,核输出蛋白NS2介导M1-RNP以核蛋白形式出核进入宿主细胞质。
3.4 RNA的包装和病毒粒子的组装
流感病毒并不是都具有感染性,除非它的病毒粒子包含全部八条RNA基因组片段,对于C型流感病毒是七条RNA片段。之前,vRNA的包装被认为是一个完全随机的过程,在这种模式下,vRNA片段随机整合到出芽的病毒粒子中,直到具有完整的基因组片段并具备感染性;然而,最新的研究表明vRNA的包装是一个选择的过程,在这种模式下,所有vRNA片段上不连续的包装信号使得全部的基因组被整合到大部分病毒粒子中,研究者以NA vRNA为例子,发现病毒的vRNA编码区的3’末端和5’末端对于选择性整合是至关重要的,尤其是编码区的3’末端[26]。
3.5 病毒的出芽和释放
流感病毒的出芽发生在宿主细胞膜上,并可能由位于脂质双层胞质面的M1基质蛋白所启动。当出芽完成时,HA突起(HA spikes)不断使病毒粒子结合到宿主细胞表面的唾液酸,直到NA蛋白发挥分解唾液酸作用后,病毒粒子才被释放。NA蛋白是一个蘑菇状的四聚体,通过一个跨膜结构域镶嵌在宿主细胞表面,它具有破坏受体功能,切断细胞表面糖蛋白和神经节苷脂的唾液酸末端残基,从而释放子代病毒。在病毒包膜上,NA蛋白也移除自身的唾液酸残基,这样可以防止病毒粒子聚集,提高感染能力。NA蛋白也可以破坏呼吸道分泌的粘液,允许病毒侵入呼吸道上皮细胞,从而增强病毒的感染能力[27]。
4 易感宿主
A型流感病毒除了可以感染人以外,还感染禽、猪、虎、猫等大约20种以上的物种。其中,H1N1、H2N2和H3N2亚型主要感染人和其它哺乳动物,H5N1、H7N7和H9N2亚型主要感染禽类,其它亚型A型流感病毒感染禽类也有不同程度的报道。B型和C型流感病毒没有进一步的亚型划分,B型流感病毒基因结构型与A型相似,但只感染人和海豹且致病性较低,C型流感病毒只是散发存在,可引起人和猪轻微的感染。A型禽流感病毒(Avian influenza virus,AIV)可以感染许多种类的家禽、野禽、特禽、观赏鸟以及哺乳动物[28,29],家禽中鸡、火鸡、鸭、鹅是自然条件下最易感的禽种。鸟类也是 AIV的重要宿主,国外报道已发现带毒的鸟类达88种之多,我国在17种野鸟中发现禽流感病毒,据调查认为我国青海发生的禽流感是由候鸟斑头雁引起的[30]。哺乳动物中的猪、马、海豹以及鲸也是禽流感病毒重要的储存宿主。人类对禽流感病毒易感性尚不明晰,一般人对禽流感病毒普遍缺乏抗体、无抵抗力。感染猪的 A型流感病毒主要包括 H1N1、H1N2和H3N2亚型,另外猪被认为是流感病毒的混合器,所以可能还有其他亚型A型流感病毒存在猪体内,例如,2009甲型 H1N1病毒就是猪体内同时存在了人、禽和猪三种流感病毒后基因重组而成。
5 结语
流感病毒亚型众多,毒力差异大,从 A型病毒的分子生物学研究来看,由于基因分节段性和RNA聚合酶的无校正性,使得A型流感病毒容易发生抗原转换和抗原漂移。不同宿主的流感病毒频繁变异和重组,极易产生新的流行株,一旦获得人传人能力及高致病性片段和突变,将会引起全球范围的大流行。
传统观点认为,AIV不直接感染人,主要通过在中间宿主(猪)体内与禽、人流感病毒进行基因片段重组获得识别人流感病毒受体能力而对人致病。从最新的一些实验结果可以看出,人类呼吸道内也存在AIV的受体,而且,AIV可以通过遗传变异不断提高受体结合能力,所以AIV也能够直接感染人呼吸道,然后在其体内进化而提高其复制能力并获得对人的致病性。2009年 3月在墨西哥爆发的甲型H1N1流感就是由一种通过抗原转换机制获得猪、禽和人流感病毒片段的猪流感病毒引起的,由于其获得人传人能力和高致病性,迅速在全球蔓延并导致上百人死亡。截止2009年11月,全球已感染20万,死亡6000多人,其中美洲确诊病例190,765例,死亡4512人[31]。我国截止2009年12月13日,31个省份报告甲型H1N1流感确诊病例7949例,住院治疗2502例,死亡116人[32]。
虽然在流感病毒的分子生物学的研究取得很多成果,阐明了其复制和致病能力的分子机理,但是流感病毒复制和毒力变化的深层机制还不十分清楚,尤其是流感病毒与宿主之间的作用机理。对流感病毒,尤其是A型流感病毒的分子生物学的研究还需要各国科学家通力合作,阐明其变异和致病的原理,这也必将为流感疫苗的研制和新型药物的开发提供理论基础和技术支持。
[1] Krug RM,Aramini JM.Emerging antiviral targets for influenza A virus[J].Trends Pharmacol Sci,2009,30(6):269-277.
[2] Zebedee SL,Lamb RA.Infiuenza A virus M2 protein:monoclonal antibody restriction of virus growth and detection of M2 in virions[J].J Virol,1988,62(8):2762-2772.
[3] Chen W,Calvo PA,Malide D,et al.A novel infiuenza A virus mitochondrial protein that induces cell death[J].Nat Med,2001,7(12):1306-1312.
[4] Hatta M,Kawaoka Y.The NB protein of infiuenza B virus is not necessary for virus replication in vitro[J].J Virol,2003,77 (10):6050-6054.
[5] Lamb RA,Lai CJ,Choppin PW.Sequences of mRNAs derived from genome RNA segment 7 of infiuenza virus:colinear and interrupted mRNAs code for over-lapping proteins[J].Proc Natl Acad Sci,U S A,1981,78(7):4170-4174.
[6] Horvath CM,WilliamsMA,LambRA.Eukaryoticcoupled translation of tandem cistrons:identification of the infiuenza B virus BM2 polypeptide[J].EMBO J,1990,9(8):2639-2647.
[7] Dauber B,Heins G,Wolff T.The infiuenza B virus nonstructural NS1 protein is essential for efficient viral growth and antagonizes beta interferon induction[J].J Virol,2004,78(4):1865-1872.
[8] Briedis DJ,Lamb RA.Infiuenza B virus genome:sequences and structural organization of RNA segment 8 and the mRNAs coding for the NS1 and NS2 proteins[J].J Virol,1982,42(1):186-193.
[9] Mandler J,Muller K,Scholtissek C.Mutants and revertants of an avian influenza A virus with temperature-sensitive defects in the nucleoprotein and PB2[J].Virology,1991,181(2):512-519.
[10] Ye QZ,Krug RM,Tao YJ.The mechanism by which influenza A virus nucleoprotein forms oligomers and binds RNA[J].Nature,2006,444:1078-1082.
[11] He XJ,Zhou J,Bartlam M,et al. Crystal structure of the polymerase PAC-PB1Ncomplex from an avian influenza H5N1 virus[J].Nature,2008,454(28):1123-1126.
[12] Maier HJ,Kashiwagi T,Hara K,et al.Differential role of the influenza A virus polymerase PA subunit for vRNA and cRNA promoter binding[J].Virology,2008,370:194-204.
[13] Gonzalez S,Ortin,J.Distinct regions of influenza virus PB1 polymerase subunit recognize vRNA and cRNA templates[J]. EMBO J,1999,18:3767-3775.
[14] Li ML,Rao P,Krug RM.The active sites of the influenza capdependent endonuclease are on different polymerase subunits[J].EMBO J,2001,20:2078-2086.
[15] Yuan P,Bartlam M,Lou ZY,et al.Crystal structure of an avian influenza polymerase PANreveals an endonuclease active site[J].Nature,2009,458:909-913.
[16] Dias A,Bouvier D,Crépin T,etal. The cap-snatching endonuclease of influenza virus polymerase reside in the PA subunit[J].Nature,2009,458:914-918.
[17] Hara K,Schmidt FL,Crow M,et al.Amino acid residues in the N-terminal region of the PA subunit of influenza A virus RNA polymerase play a critical role in protein stability,endonuclease activity,cap binding,and virion RNA promoter binding[J].J Virol,2006,80:7789-7798.
[18] Regan JF,Liang Y,Parslow TG.Defective assembly of influenza A virus due to a mutation in the polymerase subunit PA[J].J Virol,2006,80:252-261.
[19] Kawaguchi A,Naito T,Nagata K.Involvement of influenza virus PA subunit in assembly of functional RNA polymerase complexes[J].J Virol,2005,79:732-744.
[20] Tarendeau F,et al.Structure and nuclear import function of the C-terminal domain of influenza virus polymerase PB2 subunit[J].Nature Struct Biol,2007,14:229-233.
[21] Guilligay D,Tarendeau F,Resa-Infante P,et al.The structural basis for cap binding by influenza virus polymerase subunit PB2[J].Nature Struct Biol,2008,15:500-506.
[22] Pappas C,Aguilar PV,Basler CF,et al.Single gene reassortants identify a critical role for PB1,HA,and NA in the high virulence of the 1918 pandemic infiuenza virus[J].Proc Natl Acad Sci U S A,2008,105(8):3064-3069.
[23] Tumpey TM,Basler CF,Aguilar PV,et al.Characterization of the reconstructed 1918 Spanish infiuenza pandemic virus[J]. Science,2005,310(5745):77-80.
[24] Gambotto A,Barratt-Boyes SM,de Jong MD,et al.Human infection with highly pathogenic H5N1 infiuenza virus[J]. Lancet,2008,371(9622):1464-1475.
[25] Sieczkarski SB,WhittakerGR. Viralentry[J]. CurrTop Microbiol Immunol,2005,285:1-23.
[26] Fujii Y,Goto H,Watanabe T,et al.Selective incorporation of infiuenza virus RNA segments into virions[J].Proc Natl Acad Sci,U S A,2003,100(4):2002-2007.
[27] Matrosovich MN,Matrosovich TY,Gray T,et al.Neuraminidase is important for the initiation of infiuenza virus infection in human airway epithelium[J].J Virol,2004,78(22):12665-12667.
[28] Alexander DJ.A review of avian influenza in different bird species[J].Vet Microbiol,2000,74(1-2):3-13.
[29] Vahlenkamp TW,HarderTC. Influenza virus infections in mammals[J].Berl Munch Tierarztl Wochenschr,2006,119(3-4):123-131.
[30] Liu J,Xiao H,Lei F,et al.Highly pathogenic H5N1 influenza virus infection in migratory birds[J]. Science,2005,309 (5738):1206.
[31] Pan American Health organization and WHO.Regional update. Pandemic(H1N1)2009.http://new.paho.org/hq/index. php?option=com_content&task=view&id=2005&Itemid= 1167.
[32] 中国疾病预防控制中心.卫生部甲型H1N1流感疫情信息通报[J/OL].http://www.chinacdc.net.cn/n272442/n272530/ n273736/n273781/n4624704/n4624712/34595.html.
Advances in Research on Molecular Biology of Influenza Virus
ZHANG Wei1,2,WANG Cheng-yu2,YANG Song-tao2,GAO Yu-wei2,XIA Xian-zhu1,2*
(1.Comparative Medicine Centre,Peking Union Medical College(PUMC);Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences(CAMS),Beijing 100021,China; 2.Veterinary Institute,Academy of Military Medical Sciences,Changchun 130062,China)
Influenza virus,a member of the Orthomyxoviridae family,is an enveloped RNA virus with a genome in the form of eight segments requiring an RNA dependent RNA polymerase of viral origin for replication.Influenza viruses can escape the long-term neutralizing antibody response in many hosts via ever-changing antigenic shift and antigenic drift resulting from the particular structure of the virus genome and function of its viral proteins.In this paper,the structure of virus,the genome and encoding proteins of virus,the replication process and susceptible hosts will be summarized.
Influenza virus;RNA virus;Antigenic shift;Antigenic drift
R-33
A
1671-7856(2010)04-0074-06
2009-10-30
国家科技支撑计划项目(No.2010BAD04B01)。
张伟(1978-),男,博士,主要从事禽流感防治方面的研究。E-mail:wisherzhw2007@163.com。
夏咸柱,教授,E-mail:xia_xzh@yahoo.com.cn。

