Flt3基因突变与急性髓系白血病发生和预后的关系
王杰
(沈阳医学院基础医学院生物化学教研室,辽宁 沈阳 110034)
Fms样酪氨酸激酶 3(Fms-like tyrosine kinase 3,Flt3)是Ⅲ型受体型酪氨酸激酶 (receptor tyrosine kinase,RTK)家族成员之一,在正常造血及免疫系统发育中起着重要作用。Flt3基因突变与急性髓系白血病 (acutemyelogenous leukemia,AML)的发生、预后密切相关。以 Flt3作为靶分子已成为 AML治疗的一种新策略。
1 Flt3基因结构与功能
1.1 结构 人类 Flt3基因又称作胎儿肝脏激酶-2(Fetal liver kinase-2,FLK-2)[1]和人类干细胞激酶-1(human stem cell kinase-1,STK1)[2],位于染色体 13q12,全长约 100 kb,含有 24个外显子,编码 993个氨基酸的蛋白质。Flt3蛋白有分子量为143KD的糖基化高甘露醇形和分子量为 158KD的复合糖形两种形式,前者存在于胞内,经过糖基化过程后形成后者,并定位于膜上。后者是 Flt3在细胞表面的主要存在形式。
Flt3与其它Ⅲ型 RTK如 kit、fms、PDGF受体有相似的结构,包含由胞外区、跨膜区和胞内区 3部分组成。胞外区是胞外配体结合区,由 5个免疫球蛋白样结构域组成;跨膜区有不连续的激酶作用的位点;胞内区为酪氨酸激酶催化区,由 1个胞内近膜结构域 (juxtamembrane domain,JM)、2个被插入结构域分开的激酶结构域 (tyrosine kinase domain,TKD)和 1个 C末端 -结构域构成[3]。近年来的研究表明 JM结构域对维持激酶催化中心空间结构稳定性起主要作用,对激酶活性有负调控作用[4]。
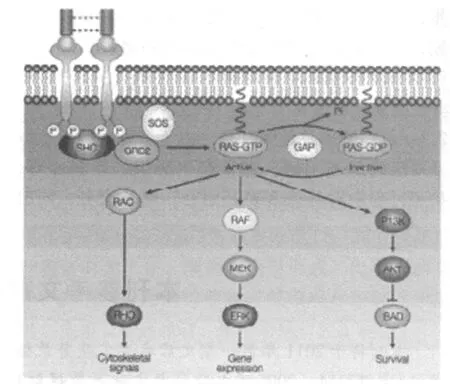
图 1 Flt3信号转导途径
1.2 功能 Flt3在胸腺、肝、脾、淋巴结、胎盘、大、小脑、生殖腺等多种组织中表达。在正常人骨髓中 Flt3的表达仅限于 CD34+干/祖细胞,在红细胞系及成熟 T、B淋巴细胞、NK细胞中无表达[5]。Flt3配体为 FL(Flt3 ligand)。无 FL存在时,近膜结构域对 Flt3二聚体形成和活化起着抑制作用。当 FL与 Flt3受体结合,后者发生二聚体化,激酶结构域的活化环 (activation loop,A-loop)构象发生改变,酪氨酸残基自身磷酸化。激活的 Flt3通过 SHC与 GRB2结合而激活 RAS,从而进一步激活下游的效应因子如 RAF、MAPK/ERK激酶。这些下游效应因子激活核因子 CREB、ELK、STATs,使造血干细胞发生增殖和活化。此外,激活的 Flt3也可以激活 PI3K(phosphatidylinositol 3-kinase)和 RAS途径,导致增殖加快,细胞凋亡抑制[6],见图 1。这两种信号途径通过 RAS的联系提示了 Flt3与白血病发生有关。
2 Flt3基因突变
Flt3基因突变是造成 Flt3基因异常活化的主要原因。其突变形式主要表现为两种:近膜结构域内部串联重复 (internal tandem duplications,ITDs)突变和 TKD或/和 JM的点突变 (pointmutation,PMs)。两种突变均可造成 Flt3酪氨酸激酶的结构性活化,见图 2。
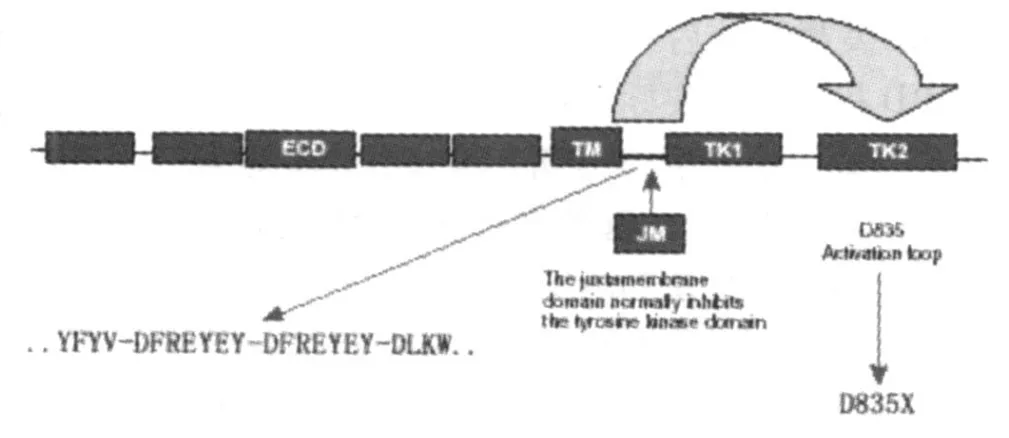
图 2 Flt3基因突变常见类型
Flt3/ITDs是 Flt3基因 AML中最常见的突变类型,常出现在外显子 11,也可累及内含子 11和外显子 12[7]。也有报道 Flt3/ITD位于外显子 14和15,而非外显子 11和 12[8-10]。Flt3/ITDs的插入长度具有多态性,其长度在 3~400bp之间不等,但串联复制的碱基数多是 3的倍数,极少产生框移突变,因而不影响开放阅读框架 (open reading frame,ORF)的正常翻译过程[11,12]。Flt3/ITDs使得 Flt3基因持续活化的原因可能的是:(1)Flt3/ITDs造成了近膜结构域的结构改变,从而破坏了近膜结构域的自我抑制功能[13]。(2)Flt3/ITD突变可以使细胞外的 C末端的构象发生变化,有利于 Flt3二聚体的形成,导致配体非依赖性磷酸化。Flt3因磷酸化而酪氨酶激酶活性增强,导致酪氨酸残基自发激活发生磷酸化作用,激活下游信号通路,如 RAS信号转导途径和转录激活因子 5信号转导途径,促进细胞增殖并与 AML的进展存在密切相关[14],见图 3。
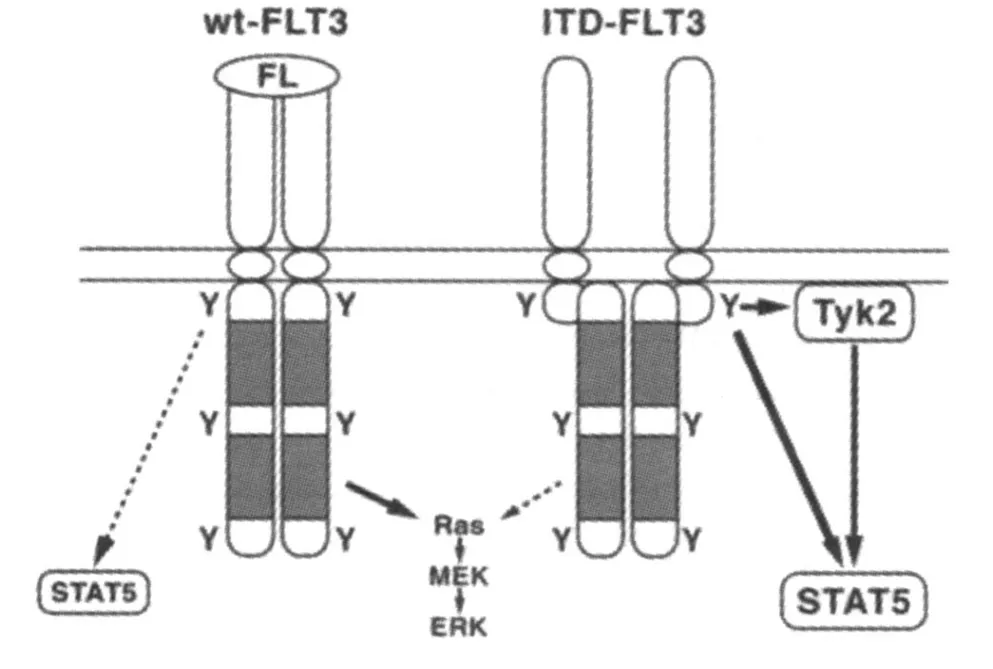
图 3 Flt3基因突变信号转导示意图
在一些无 Flt3/ITDs的 AML患者中也存在配体非依赖性的 Flt3基因组成性激活,说明除 Flt3/ITDs之外,可能还存在有其他类型突变导致 Flt3基因激活。近年来国内外的研究表明约 6.4%~7.7%的患者出现 TKD或/和 JM结构域的点突变,同样可以导致 Flt3基因配体非依赖性激活[15,16]。
TKD点突变,常发生于激酶结构域Ⅱ活化环内,通常为氨基酸残基的突变,插入和缺失,最常见的是 D835是第一个核苷酸 G被 T替代,即D835Y[17]。此外还有 D835V[18]、D835H[19]、D835E[20]、D835N[21]等。最近,在 AML中又发现了两种新的活化环点突变,一种是第 836位 I的缺失,另一种是第 836位 I被 M替换同时被 R插入[22]。这两种新的点突变与 D835一样,突变也位于第 2个酪氨酸激酶的活化环内,都能导致无配体情况下受体自身磷酸化,通过激活 STAT5信号转导途径而抑制白血病细胞的凋亡[23]。
JM点突变发生频率不高,目前尚无大量的临床研究统计学数据。已见报道的突变类型有V579A、V592A、 F594L和 F590GY 591D等[24,25]。研究表明 JM点突变可以降低 JM区对激酶活性负调节作用,从而使 Flt3持续活化并激活下游信号途径,如 STAT5[26]。研究也发现 JM点突变与Flt3/ITDs相比,对细胞的增殖作用较小,且受体自身的活化程度也较弱,推测可能是 JM点突变对近膜结构域的破坏较小,未造成自我抑制功能的完全丧失[27,28]。
3 Flt3基因突变与 AM L
急性白血病是儿童最常见的恶性肿瘤,发病率为 3/10万,其中 AML约占 20%~30%。近几年来,随着环境致癌因素的增加,AML的发病率及死亡率均呈上升趋势。目前 AML的发生机制仍未完全阐明,但随着研究的不断深入,Flt3基因突变在 AML发生、预后中的作用日益受到重视。
3.1 Flt3基因突变与 AML发生 Flt3与其配体FL结合后能通过信号传导途径对造血发育起重要的调控作用,能调节多能造血干细胞、早期前体细胞及不成熟淋巴细胞的生长。1996年,Nakao等首先报道 AML患者 Flt3基因编码的近膜区(JM)存在 Flt3/ITDs[29]。此后的国内外报道显示Flt3基因在 70%~90%的 AML患者细胞中出现异常表达,其中 20%~25%的 AML患者 Flt3基因发生了 Flt3/ITDs,并见于 AML各亚型,其中以 M3和 M 5多见,且突变率各异[30]。我们的研究发现在儿童白血病患者中 Flt3阳性率 80.33%,其中Flt3/ITDs突变率为 17.21%;各亚型突变率分别为 M0 42.86%、M1 22.22%、M2 12.90%、M4 44.44%和 M5 15.38%。说明儿童 AML在外显子11处发生 Flt3/ITDs的频率极高,是儿童 AML发生的主要原因[31]。
目前,Flt3异常表达和基因突变导致 AML发生的分子机制尚不完全清楚。目前大量的临床研究证实 Flt3/ITDs常集于 JM区中从密码子 589~599富含酪氨酸残基的一段区域,从首尾相按顺序插入若干个复制的核苷酸。研究显示在 AML细胞株研究中,Flt3/ITDs可抑制 c/EBPa(repression of CCAAT/estradiol-binding proteinα)和 Pu.1的表达,阻滞髓源细胞分化;应用 Flt3/ITDs抑制剂处理 AML细胞株后 c/EBPαPu.1表达增强[32]。进一步的研究证实 Flt3/ITDs可干扰激酶磷酸化信号通路,使 STAT5(singal transducer and activator of transcrip tion 5)活化增强以及 c/EBPα和 Pu11表达抑制[33]。说明Flt3/ITDs有利于 Flt3二聚体的形成,引起配体非依赖性磷酸化,在 AML的发病机制中起重要作用。
3.2 Flt3基因突变与 AML预后 近年来大量临床研究表明,Flt3/ITDs与 AML预后密切相关。Gale等[30]的结果显示 Flt3/ITDs突变阳性 AML患者与阴性组比较外周血 WBC计数显著增高,CR率显著降低,化疗相关死亡率高,复发危险增高,无病生存率、无事件生存率及总生存率均显著降低。我们采用 PCR方法联合序列检测伴有或不伴有染色体易位的 AML患者 Flt3基因突变情况,结果显示:46例伴有染色体易位患者 Flt3基因表达阳性率 67.39%,其中 Flt3/ITDs阳性率分别为26.09%;伴有染色体易位 Flt3/ITDs阳性患者外周血白细胞、血红蛋白、血小板、骨髓粒细胞比例虽与不伴有染色体易位 Flt3/ITDs突变阳性患者基本相似,但平均生存时间明显降低,仅为 (8.9±1.5)个月[34]。如 Flt3/ITDs阳性行自异体基因造血干细胞移植的 AML患者无病生存率明显提高[35]。提示 Flt3/ITDs既可作为预测 AML预后的一个重要指标,也可以指导临床治疗。
3.3 Flt3基因突变与 AML微小残留病灶检测 随着急性白血病化疗方案的改善和造血干细胞移植的进展,急性白血病的完全缓解 (CR)率明显提高。然而仍有许多 CR患者在数年内复发,其主要原因是血液学 CR后体内仍残留 106-109白血病细胞,称为微小残留病 (minimal residual disease,MRD)。现在普遍认为 MRD是血液学 CR乃至持续完全缓解 (CCR)期间白血病复发的根源。近年来分子生物学技术的发展,为常规骨髓形态学检查难以检测的 MRD提供了新方法,然而目前尚缺乏合适的 MRD的检测指标。Flt3/ITDs是与AML发生及预后相关的一种重要因子,可望成为MRD检测的重要标志物。
Schnittger等[36]分析1 003例 AML患者,对 34例 Flt3/ITDs阳性患者进行多次检测 Flt3/ITDs后认为大部分患者 Flt3/ITDs为唯一可检测的标志,且与临床阶段、FISH、PCR结果有较好的相关性,4例复发患者检测 Flt3/ITDs比其他方法提前 2~3个月检测到复发,认为 Flt3可作为 MRD检测标志。我们用 Flt3基因作为 AML的分子标志,通过PCR技术跟踪了 AML完全缓解后的 MRD,结果表明:PCR技术检测 Flt3基因的最低检出值为 100 pg;Flt3基因阳性 AML患者,经标准治疗后,半数左右的患者达到 CR,其中绝大部分患者 Flt3基因表达减弱或转为阴性;AML患者达 CR后 Flt3基因表达持续阳性或转阴后再次出现阳性,提示将发生复发[37]。说明在完全缓解期追踪检测 Flt3并分析其变化极为重要,Flt3转为阴性或长期持续阴性者预示能获得长期无病生存。
4 结语
Flt3基因突变是 AML中最常见的基因异常,与 AML发生有着密切关系。Flt3/ITDs有望成为一种新的生物标志物,用于 AML预后不良和 MRD判定,并可能成为 AML治疗的新靶点。
[1]Rosnet O,Marchetto S,deLapeyriere O,et al.Murine Flt3,a gene encoding a novel tyrosine kinase receptor of the PDGFR/CSF1R fam ily[J].Oncogene,1991,6:1641-1650.
[2]Matthews W,Jordan CT,Wiegand GW,et al.A receptor tyrosine kinase specific to hematopoietic stem and progenitor cell-enriched populations[J].Cell,1991,65:1143-1152.
[3]Abu-Duhier FM,Goodeve AC,Wilson GA,et al.Genom ic structure of human Flt3:implications formutationalanalysis[J].Br J Haematol,2001,113:1076-1077.
[4]Griffith J,Back J,Faerman C,et al.The structural basis for auto inhibition of Flt3 by the juxtamembrane domain[J].Mol Cell,2004,30:169-178.
[5]Sargin B,Choudhary C,Crosetto N,et al.Flt3-dependent transformation by inactivating c-Cbl mutations in AML[J].Blood,2007,110(3):1004-1012.
[6]Wang Jie,Wang Tong,Li Shu,et al.Flt3/ITD mutation in pediatric leukemia and its clinical significance[J].Chinese Journal of Cancer,2007,26(1):58-63.
[7]ChenW,Huang Q.Detection of Flt3/ITD,JAK 2(V617F)and NPM 1 gene mutations in chronic myelomonocytic leukemia[J].Leuk Res,2009,33(11):207-209.
[8]Huang Q,ChenW,Gaal KK,et al.A rapid,one step assay for simultaneous detection of Flt3/ITD and NPM 1 mutations in AML with normal cytogenetics[J].Br J Haematol,2008,142(3):489-492.
[9]Meshinchi S,Stirewalt DL,Alonzo TA,et al.Structural and numerical variation of Flt3/ITD in pediatric AML[J].Blood,2008,111(10):4930-4933.
[10]Meshinchi S,Appelbaum FR.Structuraland functional alterations of Flt3 in acutemyeloid leukem ia[J].Clin Cancer Res,2009,15(13):4263-4269.
[11]Hasan SK,Sazawal S,Dutta P,et al.Impactof Flt3 internal tandem duplications on Indian acute promyelocytic leukemia patients:prognostic implications[J].Hematology,2007,12(2):99-101.
[12]Gale RE,Green C,Allen C,et al.The impact of Flt3 internal tandem duplication mutant level,number,size,and interaction with NPM 1mutations in a large cohort of young adult patientswith acutemyeloid leukemia[J].Blood,2008,111(5):2776-2784.
[13]Kim KT,Baird K,Davis S,et al.Constitutive Fms-like tyrosine kinase 3 activation results in specific changes in gene expression in myeloid leukaemic cells[J].Br J Haematol,2007,138(5):603-615.
[14]Sallmyr A,Fan J,Datta K,et al.Internal tandem duplication of Flt3(Flt3/ITD)induces increased ROS production,DNA damage,and misrepair:implications for poor prognosis in AML[J].Blood,2008,111(6):3173-3182.
[15]Kang HJ,Hong SH,Kim IH,et al.Prognostic significance of Flt3mutations in pediatric non-promyelocytic acutemyeloid leukemia[J].Leuk Res,2005,29(6):617-623.
[16]Grundler R,Miething C,Thiede C,et al.Flt3-ITD and tyrosine kinase domain mutants induce-distinct phenotypes in a murine bone marrow transplantation model[J].Blood,2005,105(12):4792-4799.
[17]Yamamoto Y,Kiyoi H,Nakano Y,et al.Activating mutation of D 835 within the activation loop of Flt3 in human hematologicmalignancies[J].Blood,2001,97(8):2434-2439.
[18]Lu Y,K itaura J,Oki T,et al.Identification of TSC-22 as a potential tumorsuppressor thatis upregulated by Flt3-D 835V but not Flt3-ITD[J].Leukem ia,2007,21(11):2246-2257.
[19]Scholl S,Krause C,Loncarevic IF.Specific detection of Flt3 pointmutationsby highly sensitive real-time polymerase chain reaction in acute myeloid leukem ia[J].J Lab Clin Med,2005,145(6):295-304.
[20]Reindl C,Spiekermann K.From kinases to cancer:leakiness,loss of autoinhibition and leukemia[J].Cell Cycle,2006,5(6):599-602.
[21]Neben K,Schnittger S,Brors B,et al.Distinct gene expression patterns associated with Flt3-and NRAS-activatingmutations in acute myeloid leukem ia with normal karyotype[J].Oncogene,2005,24(9):1580-1588.
[22]Taketani T,TakiT,Sugita K,et al.Flt3mutations in theactivation loop of tyrosine kinase domain are frequently found in infant ALL with MLL rearrangements and pediatric ALL with hyperdip-loidy[J].Blood,2004,103(3):1085-1088.
[23]Smith CA,Fan G.The saga of JAK 2mutations and translocations in hematologic disorders:pathogenesis,diagnostic and therapeutic prospects,and revised World Health Organization diagnostic criteria formyeloproliferative neoplasms[J].Hum Pathol,2008,39(6):795-810.
[24]Meshinchi S,Alonzo TA,Stirewalt DL,et al.Clinical implications of Flt3mutations in pediatric AML[J].Blood,2006,108(12):3654-3661.
[25]Stirewalt DL,Meshinchi S,Kussick SJ,et al.Novel Flt3 point mutations within exon 14 found in patients with acutemyeloid leukaemia[J].Br JHaematol,2004,124(4):481-484.
[26]Vempati S,Reindl C,Wolf U,et al.Transformation by oncogenic mutants and ligand-dependent activation of Flt3 wild-type requires the tyrosine residues 589 and 591[J].Clin Cancer Res,2008,14(14):4437-4445.
[27]Reindl C,Bagrintseva K,Vempati S,etal.Pointmutation in the juxtamembrane domain of Flt3define anew classof activatingmutations in AML[J].Blood,2006,107(9):3700-3707.
[28]Mattison RJ,Ostler KR,Locke FL,et al.Implications of Flt3 mutations in the therapy of acute myeloid leukemia[J].Rev Recent Clin Trials,2007,2(2):135-141.
[29]Naoe T,K iyoi H.Normal and oncogenic Flt3[J].CMLS,2004,61(23):2932-2938.
[30]Gale RE,Hills R,Kottaridis PD,et al.No evidence that Flt3 status should be considered asan indicator for transplantation in acutemyeloid leukemia(AML):ananalysis of 1135 patients,excluding acute promyelocytic leukemia,from the UK MRC AML10 and 12 trials[J].Blood,2005,106(10):3658-3665.
[31]王杰,王彤,李树,等.儿童白血病患者Flt3/ITD突变分析及其临床意义 [J].癌症,2007,26(1):58-63.
[32]Zheng R,Friedman AD,LevisM,et al.Internal tandem duplication mutation of Flt3blocksmyeloid differentiation through supp ression of C/EBPαexpression[J].Blood,2004,103:1883-1990.
[33]Choudhary C,Schwable J,BrandtsC,etal.AML-associated Flt3 kinase domainmutations show signal transduction differences compared with Flt3 ITD m tltaticons[J].Blood,2005,106,265-273.
[34]王杰,李树,王彤.伴有染色体异常白血病患者Flt3基因检测的临床意义 [J].中国实验血液学杂志,2007,15(4):700-704.
[35]王彤,王杰.白血病患者 Flt3基因突变及其与白血病发生、预后的关系检测 [J].中国组织工程研究与临床康复杂志,2007,11(37):7509-7512.
[36]Schnittger S,Schoch C,DugasM,et al.Analysis of Flt3 length mutations in 1003 patients with acutemyeloid leukem ia:correlation to cytogenetics,FAB subtype,and prognosis in the AML CG study and usefulness asa marker for the detection ofm inimal residual disease[J].Blood,2002,100(1):59-66.
[37]李树,王彤,王杰,等.Flt3基因动态监测在急性髓系白血病治疗中的应用 [J].中国实验血液学杂志,2007,15(4):705-708.

