人Argonaute2蛋白多克隆抗体制备及初步应用①
李海芳 浦 永 汤石明 强 冉 汤 华
(天津医科大学基础医学院天津市生命科学中心实验室,天津300070)
·免疫学技术与方法·
人Argonaute2蛋白多克隆抗体制备及初步应用①
李海芳 浦 永 汤石明 强 冉 汤 华
(天津医科大学基础医学院天津市生命科学中心实验室,天津300070)
目的:制备人Argonaute2(Ago2)的多克隆抗体,鉴定其特异性,并应用该抗体检测Ago2在人各细胞系中的表达差异及细胞定位。方法:用DNAstar软件寻找抗原性高的Ago2序列区域(命名为k-Ago2),构建k-Ago2的表达质粒,转化大肠杆菌并诱导表达。融合蛋白经切胶回收纯化后免疫大白兔制备抗体。以ELISA检测抗体效价,Western blot鉴定抗体特异性及检测Ago2在细胞系中的表达差异,免疫荧光染色观察Ago2的细胞定位。结果:成功构建表达质粒,继而k-Ago2得以表达与纯化,免疫大白兔后得到Ago2多克隆抗体。ELISA检测抗体效价为1∶19 000,Western blot确定抗体具有高度特异性,并成功地用该抗体检测到Ago2在人各细胞系中的表达差异及细胞定位。结论:Ago2多克隆抗体的成功制备,对RNAi机制的深入研究及其进一步的临床应用均具有重要价值。
Argonaute2蛋白;多克隆抗体;RNA干扰;RNA诱导沉默复合体
[Abstract]NA干扰(RNA interference,RNAi)是由小RNAs介导,在几乎所有真核生物中存在的保守的基因调节机制[1-3],可以使同源靶mRNA降解或者翻译抑制进而使基因表达抑制或沉默[4],在生物体抗病毒感染、肿瘤发生、生物发生发育时序的控制、脂肪代谢、血细胞分化、细胞生长和凋亡等过程中发挥着重要的作用[5]。在RNAi过程中,小RNAs与Argonaute (AG O)蛋白形成RNA诱导沉默复合体(RNA-induced silencing complex,RISC),并引导RISC识别互补的靶序列引发不同的沉默效应,而其中AG O蛋白是RISC的核心部分[6,7]。并且实验报道显示只有Ago2蛋白是人类AG O蛋白家族(Ago1-4)中已知的唯一在RNAi起作用的成员,它与小RNAs即可构成最简单的效应器对完全互补的靶mRNA进行剪切[8-10]。因此,在哺乳动物的RNAi中,Ago2是特异的并具有非常重要的作用[11]。本研究寻找抗原性强的Ago2蛋白片段进行原核表达、纯化、成功制备Ago2抗体并以该抗体进行了初步应用,为进一步深入了解RNAi参与人类诸多疾病的基本生物学机制及RNAi在临床上的应用起到了基础性作用。
1 材料与方法
1.1 材料 Argonaute2蛋白全长表达质粒pCDNA3 myc/Ago2,原核表达载体pRSET A2(由本实验室在pRSETA基础上改建而成,将EcoRⅠ和XhoⅠ位点调换),大肠杆菌X L1-Blue、BL21(DE3),所用细胞系均由本实验室保存。引物由北京奥科生物技术有限责任公司合成;测序由北京华大基因提供;Taq DNA聚合酶、T4 DNA连接酶、标准蛋白marker购自Ferments公司;各种限制性内切酶购自TaKaRa公司;弗氏完全佐剂(FCA)及弗氏不完全佐剂(FICA)购自Sigma公司;DNA marker、日本大耳白兔、抗His抗体、抗myc抗体、抗 G APDH抗体、辣根过氧化物酶(HRP)标记的羊抗兔IgG购自赛尔生物科技有限公司;异硫氰酸(FITC)标记的驴抗兔IgG购自Jackson Immunoresearch Laboratories。其他所用化学试剂均为分析纯以上产品。
1.2 方法

1.2.2 原核表达质粒的构建 PCR回收产物和pRSETA2空载体以EcoRⅠ和XhoⅠ双酶切,37℃水浴过夜后,进行琼脂糖(10 g/L)凝胶电泳并回收,然后在T4 DNA连接酶作用下室温连接4小时,转化E.coliX L1-Blue,通过氨苄青霉素(Amp+)抗性筛选得到重组子。挑取阳性克隆小提质粒DNA并酶切鉴定。
1.2.3 融合蛋白的诱导表达 鉴定正确的质粒转化 E.coliBL21(DE3),涂布于Amp+抗性的LB平板37℃过夜培养。然后挑取单克隆于2 ml LB中,37℃振荡培养过夜。次日接种培养物到10 ml LB中, 37℃振荡培养约2小时,至A600=0.5~0.7。取1 ml作为诱导前对照,其余的加入IPTG至终浓度为0.8 mmol/L,30℃继续振荡培养4小时。离心收集菌体,其中诱导后菌体加入磷酸盐缓冲液(PBS)重悬后超声裂解,离心取上清,在其沉淀即重组蛋白形成的包涵体中加入Buffer B(100 mmol/L NaH2PO4, 10 mmol/L Tris·Cl,8 mol/L urea,pH8.0)裂解,再次离心取上清。诱导前对照组菌体则直接加入Buffer B裂解后离心取上清。将各管上清取部分加入上样缓冲液水浴煮沸5分钟,冰置5分钟进行SDS-PAGE电泳,考马斯亮蓝染色分析。
1.2.4 融合蛋白的切胶回收纯化 将表达融合蛋白的菌液转接到150 ml LB中扩大培养,并按上述条件诱导表达和裂解菌体。将包涵体裂解所得上清加入上样缓冲液处理后进行SDS-PAGE电泳,根据溴酚蓝位置推测目的蛋白位置。结束电泳后,将胶放入0.25 mol/L KCl溶液中在摇床上摇动约15分钟,目的蛋白可呈现一条白色的条带,将条带切下后装入密封的透析袋(内装满PBS),以1×Tris-甘氨酸(不含SDS)缓冲液为电泳液进行水平电泳。120 mA恒流电泳2小时后对换阴阳极后再电泳3分钟,然后留取透析袋内的PBS缓冲液并取部分上样进行SDS-PAGE分析。
1.2.5 兔多克隆抗体的制备 取200μg蛋白与弗氏完全佐剂按1∶1比例混合后皮下注射初次免疫兔子,以后每间隔2周,取200μg蛋白与弗氏不完全佐剂按1∶1比例混合加强免疫2次,1周后兔耳缘静脉取血检测抗体效价并加强免疫1次,如达到所需效价7天后取全血,分离血清后,无菌分装保存于-20℃。
1.2.6 间接ELISA法检测抗体效价 以终浓度为1 mg/L的目的蛋白包被ELISA反应孔,一抗是作为空白对照的PBS、阴性对照的免疫前兔血清以及倍比稀释的抗目的蛋白抗体,二抗为HRP-羊抗兔IgG (1∶20 000),最后加入底物显色后,用酶标仪测定A450的值。结果以实验组值-空白对照/阴性对照-空白对照≥2.5为阳性,以出现阳性反应的最高稀释度作为抗体的效价。
1.2.7 质粒转染 按照Lipofectamine 2000转染说明书推荐的转染方法转染HEK 293细胞,置37℃, 5%CO2孵箱培养48小时后进行细胞裂解。
1.2.8 Western blot SDS-PAGE电泳后将蛋白电转(4℃,恒流300 mA,2小时)到硝酸纤维素膜(NC)上,然后将NC膜在含50 g/L脱脂奶粉的TBST中室温封闭2小时后,加抗目的蛋白的抗体(1∶600)室温作用2小时,TBST洗去未结合一抗,再加HRP-羊抗兔IgG二抗(1∶2 000)室温作用1小时,TBST洗去未结合二抗,加底物反应3分钟后暗室曝光并观察结果。
1.2.9 免疫荧光染色 将细胞接种于14孔板中,细胞密度为2 000~3 000/孔,37℃孵育过夜。24小时后加40 g/L多聚甲醛4℃作用30分钟固定细胞,再加入5 ml/L TritonX-100,4℃通透化处理20分钟。然后加100 ml/L驴血清封闭1小时后,加抗目的蛋白的抗体(1∶50)4℃作用过夜。次日加FITC-驴抗兔IgG二抗(1∶200)4℃作用1小时,再加DAPI 4℃染色5分钟,最后加封片剂,荧光显微镜下观察并拍照。
2 结果
2.1 构建原核表达质粒
2.1.1 PCR扩增目的片段 经特异性引物进行PCR扩增后,琼脂糖凝胶电泳可得到609 bp的目的条带(图1A)。
2.1.2 验证原核表达质粒 重组质粒pRSET A2-k-Ago2经EcoRⅠ和XhoⅠ双酶切后出现609 bp的目的条带,与预期结果一致(图1B)。将酶切鉴定为阳性的克隆进行测序,测序结果用NCBI的BLAST程序分析,结果表明,获得的k-Ago2编码序列与预期的Ago2序列区域一致,且在原核表达载体中的连接方向和阅读框架正确,说明重组质粒构建成功。
2.2 k-Ago2蛋白的表达和纯化

图1 原核表达质粒pRSET A2-k-Ago2的构建Fig.1 Construction of prokaryotic expressed plasmid pRSET A2-k-Ago2
2.2.1 鉴定诱导表达的k-Ago2蛋白 将重组质粒转化大肠杆菌BL21(DE3),以IPTG诱导蛋白表达,表达产物经SDS-PAGE电泳后考马斯亮蓝染色在分子量约34 kD处可见一明显蛋白诱导条带,说明k-Ago2蛋白在BL21(DE3)菌株中得以表达,且主要以包涵体的形式存在(图2)。
2.2.2 融合蛋白的切胶回收纯化 鉴于融合蛋白大量表达形成包涵体,故对包涵体裂解液进行切胶回收纯化,KCl染色时可见两条白色条带,均回收进行SDS-PAGE电泳,考马斯亮蓝染色分析(图3A),并以抗His抗体进行Western blot检测区分(图3B)。结果显示目的蛋白得到了高度纯化,纯度达100%,经标准蛋白BSA标化后浓度约为0.8 g/L,可以用作免疫原。
2.3 抗体效价的检测 通过间接ELISA法进行检测后,抗体效价可达到1∶19 000,而作为阴性对照的免疫前兔血清显色呈阴性。

图2 k-Ago2融合蛋白表达的确定Fig.2 Determination of k-Ago2 fusion protein expression

图3 检测切胶回收纯化后的k-Ago2融合蛋白Fig.3 Detection of k-Ago2 fusion protein after purification by gel regaining
2.4 抗体特异性的分析 (1)用纯化的k-Ago2蛋白免疫日本大耳白兔后得到兔抗人k-Ago2抗体,以诱导后大肠杆菌检测k-Ago2抗体,Western blot分析显示此抗体可特异性与大肠杆菌经IPTG诱导所产生的k-Ago2蛋白结合,与菌体其他成分无交叉反应(图4A)。(2)以所制备k-Ago2抗体在HEK293细胞裂解液中进行Western blot检测,结果可见分子量约97 kD处有一明显条带,与文献报道的Ago2蛋白大小相符,为特异的内源性Ago2蛋白条带,无明显非特异条带,表明该抗体对Ago2蛋白有极高的特异性(图4B)。(3)以pCDNA3 myc/Ago2表达载体及pCDNA3 myc空载体转染 HEK 293获取细胞蛋白裂解液,以抗myc抗体及k-Ago2抗体做Western blot,结果抗myc组显示外源质粒pCDNA3 myc/Ago2得以表达,k-Ago2抗体组均可见97 kD的目的条带,且转染pCDNA3 myc/Ago2组蛋白量明显高于未转染质粒组及转染空载体对照组,表明该蛋白片段所得抗体可特异性识别外源性及内源性Ago2蛋白(图4C)。
2.5 抗体的初步应用
2.5.1 检测Ago2蛋白在细胞系中的表达差异 收集人类细胞系胚肾细胞HEK293、喉癌Hep2、乳腺癌MCF-7、宫颈癌HeLa、红白血病细胞K562、正常肝细胞LO2、原发性肝癌QGY-7703、胃癌MGC-803细胞裂解物,采用Western blot均可检测到大小正确的目的条带,可以观察到不同细胞系中Ago2蛋白的表达差异(图5A)。
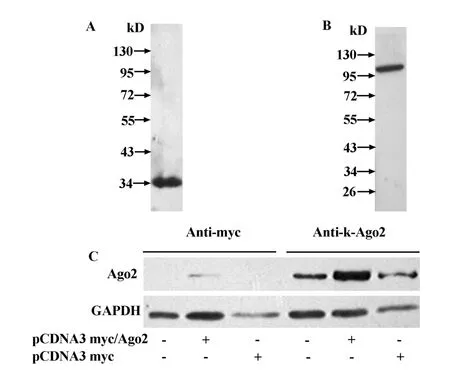
图4 Western blot分析抗体的特异性Fig.4 Analysis of the specificity of the antibody by Western blot

图5 多克隆抗体对Ago2蛋白的识别Fig.5 Identification of Ago2 protein by polyclonal antibodies
2.5.2 检测Ago2蛋白的细胞定位 在 HeLa及QGY-7703细胞中,免疫荧光染色显示Ago2蛋白存在于细胞质中(图5B)。
3 讨论
自1990年基因转录后沉默(posttranscriptional gene silencing,PTGS)现象的发现拉开了RNAi的帷幕后,对RNAi技术的研究便成为科研的焦点。至今日,RNAi技术因具有高效沉默特定靶基因的特点而成为一门新兴的基因阻断技术,在病毒感染、肿瘤、移植免疫等疾病的治疗上展现出了诱人的广阔前景。但RNAi作用的确切机制却仍未得以完全的认识。目前已知,在人类RNAi的过程中,RISC的形成及其发挥作用的过程是RNAi的效应步骤而Ago2蛋白是RISC中具有剪切活性的剪切体(Slicer)[11],在RNAi过程中起到了至关重要的作用。
人类Ago2蛋白全长约97 kD,在原核系统进行全长表达较困难,故本实验采用DNAstar软件对人类Ago2基因编码区进行分析,寻找疏水性弱、抗原性强且位于蛋白质表面可能性高的区域,对该区域进行原核表达,纯化及制备抗体。此法以融合蛋白作为抗原可使蛋白质的纯化变得容易,且制备抗体时有较高的免疫原性,所制备抗体特异性高,可以有效地避免人类AG O蛋白家族之间的抗原交叉性。
一般地,His融合蛋白可经由Ni2+-NTA树脂进行纯化。但实际操作显示,融合蛋白在经Ni2+-NTA树脂纯化洗脱后仍有少数非特异条带存在。基于该蛋白大量表达存在于包涵体中,在此选择了切胶回收纯化的方式。该方法经济、快速、操作简便、纯化后蛋白纯度极高,完全符合制备抗血清的要求,其缺陷在于蛋白染色时出现的为白色条带,无法明确所有目的蛋白所在位置。但以纯化抗原免疫家兔后,得到的抗血清效价很高,且Western blot结果说明该抗体可以与原核表达的k-Ago2及真核表达系统中内源性和外源性Ago2蛋白发生特异反应,说明Ago2抗体制备成功。
总之,在本实验中,对人类Ago2片段进行原核表达,纯化,成功制备了特异性极高的人类Ago2抗体,这不仅验证了蛋白切胶回收纯化制备蛋白抗原的可行性,更重要的是,该抗体成功检测各细胞系中Ago2的表达差异及在细胞中的Ago2定位,这为RNAi机制的进一步深入研究提供了重要工具,为RNAi技术在多种疾病中展开基因治疗起到了奠基作用。
1 Hannon GJ.RNA interference[J].Nature,2002;418:244-251.
2 Mello C C,Conte D Jr.Revealing the world of RNA interference[J].Nature,2004;431:338-342.
3 Zaratiegui M,Irvine D V,Martienssen R A.Noncoding RNAs and gene silencing[J].Cell,2007;128(4):763-776.
4 Hammond S M.Dicing and slicing:the core machinery of the RNA interference pathway[J].FEBSLett,2005;579(26):5822-5829.
5 K loosterman W P,Plasterk R H.The diverse functions of microRNAs in animal development and disease[J].Dev Cell,2006;11(4):441-450.
6 Hutvagner G,Simard MJ.Argonaute proteins:key players in RNA silencing[J].Nat Rev Mol Cell Bio,2008;9(1):22-32.
7 Hammond S M,Bernstein E,Beach Det al.An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells[J].Nature,2000;404,293-296.
8 Liu J,Carmell M A,Rivas F Vet al.Argonaute2 is the catalytic engine of mammalian RNAi[J].Science,2004;305:1437-1441.
9 Meister G,Landthaler M,Patkaniowska Aet al.Human Argonaute2 mediates RNA cleavage targeted by miRNAs and siRNAs[J].Mol Cell,2004; 15(2):185-197.
10 Rand T A,G inalski K,Grishin N Vet al.Biochemical identification of Argonaute 2 as the sole protein requiredfor RNA-induced silencing complex activity[J].Proc Natl Acad Sci USA,2004;101(40):14385-14389.
11 SongJ J,Smith S K,Hannon GJet al.Crystal structure of Argonaute and its implications for RISC slicer activity[J].Science,2004;305:1434-1437.
[收稿2009-10-12 修回2009-11-24]
(编辑 许四平)
Generation and preliminary application of polyclonal antibodies against human Argonaute2
LI Hai-Fang,PU Yong,TANGShi-Ming,QIANG Ran,TANG Hua.Tianjin Life Science Research Center and Basic Medical School,Tianjin Medical University,Tianjin300070,China
Objective:T o generate rabbit polyclonal antibody against human Argonaute2(Ago2)protein and to identify its functional characterization for determinationof differential expression and cellular localizationof Ago2 protein in various cell lines.Methods:DNAstar software was appliedfor searching the high antigenicity regionof Ago2 gene sequence termed k-Ago2.Prokaryotic expressingplasmid was constructed and transformed toE.coliBL21(DE3)to induce expression by IPTG.The fusion protein was injected into rabbits subcutaneously to produce polyclonal antibodies after purification by gel regaining.ELISA was operated to detect antibody titer.Western blot was used to identify the specificity and sensitivity of the antibodies and detect the differential expression of Ago2 protein in various cell lines.Meanwhile,immunofluorescence experiments were arranged to show cellular localization of Ago2 protein.Results:The prokaryotic expressing plasmid was constructed correctly.K-Ago2 protein was expressed and purified,and then rabbit polyclonal antibodies against Ago2 were generated after immunization with k-Ago2 protein.The titer detected by ELISA was 1∶19 000.Western blot results demonstrated the high specificity of the antibodies.Finally,we successfully observed the differential expression and cellular localization of Ago2 protein in various cell lines.Conclusion:The polyclonal antibody against Ago2 protein has been achieved successfully.It will be propitiousfor the intensive studyof the RNAi mechanism and even profound clinical application.
Argonaute2 protein;Polyclonal antibodies;RNA interference;RNA-induced silencing complex
Q78 文献标识码 A 文章编号 1000-484X(2010)03-0241-05
①本文为国家自然科学基金项目(No.30873017)、天津市自然科学基金重点项目(No.08JCZDJC23300,No.09JCZDJC17500)
李海芳(1983年-),女,在读硕士,主要从事病毒学与分子生物学及小RNA与疾病的研究,E-mail:felice-sea@163. com;
及指导教师:汤 华(1963年-),男,博士生导师,主要从事病毒学与分子生物学及小RNA与疾病的研究,E-mail:htang2002@yahoo.com。