慢性乙型肝炎患者外周血CD4+CD25+Treg与CD4+和CD8+T淋巴细胞亚群的相关研究
巫翠萍 覃 西 王华民 巫翠云 李文广 林 丹 朱 洪 李 一
(海南医学院附属医院,海口 570102)
慢性乙型肝炎患者外周血CD4+CD25+Treg与CD4+和CD8+T淋巴细胞亚群的相关研究
巫翠萍 覃 西 王华民①②巫翠云③李文广 林 丹 朱 洪 李 一①
(海南医学院附属医院,海口 570102)
目的:探讨慢性乙型肝炎患者外周血中CD4+CD25+调节性T细胞的含量和CD4+CD8+T淋巴细胞亚群分布,两者之间相关性及与HBV的相关性。方法:采用流式细胞术检测50例慢性乙型肝炎患者和20例健康对照者外周血中CD4+CD25high、CD4+CD25+Foxp3+Treg细胞表达及CD3/CD4/CD8T淋巴细胞亚群,荧光定量PCR法检测HBV DNA含量。结果:慢性乙型肝炎患者外周血中CD4+CD25highTreg明显高于健康对照组(P<0.01),且随HBV DNA载量增加,患者外周血中CD4+CD25highTreg细胞的水平逐渐升高。慢性乙型肝炎患者外周血中CD4+CD25+Foxp3+Treg细胞也相应增高,且与CD4+CD25highTreg细胞的变化成正相关(r=0.890,P<0.001)。与健康对照组比较,患者组CD4+T细胞百分率及CD4+/CD8+比值均降低,而CD3+T细胞和CD8+T细胞百分率差异无显著性(P>0.05)。CD4+CD25highTreg细胞与HBV DNA取对数后成正相关(r=0.782,P<0.001),与谷丙转氨酶(ALT)成正相关(r=0.432,P<0.005);与 CD3+、CD4+、CD8+T细胞水平及CD4+/CD8+比值均无相关性(P>0.05)。CD3+、CD4+、CD8+T淋巴细胞及CD4+/CD8+比值与HBV DNA载量之间亦无相关性(P>0.05)。结论:慢性乙型肝炎患者外周血中CD4+CD25+Treg细胞增高,且与HBV的复制水平及ALT增高具有一致性,而T细胞亚群是否可作为监测CHB患者免疫状态的指标需进一步探讨。
CD4+CD25+调节性T细胞;慢性乙型肝炎;T淋巴细胞亚群
乙型肝炎的肝细胞损伤主要是通过机体一系列的免疫介导所造成,其中以T细胞免疫为主。CD4+CD25+调节性T细胞(regulatory T cell,Treg)是近十年发现的T细胞亚群,具有抑制效应T细胞功能的作用。有研究资料表明,其与慢性乙型肝炎(chronic hepatitis B,CHB)的发生机制可能相关,但目前对慢性乙型肝炎患者外周血中Treg的频率报道并不一致[1,2],且国内外对慢性乙型肝炎中的观察仅限于其外周血中CD4+CD25+Treg的变化,很少结合与其T细胞亚群关系和HBV感染状况的观察。本研究对乙型肝炎患者外周血中CD4+CD25+Treg、CD4+CD8+T淋巴细胞亚群以及HBV DNA的表达水平和肝功能指标及其相关性进行了观察分析,现报道如下。
1 对象与方法
1.1 对象 2007年12月至2008年7月在海南医学院附属医院收治并临床诊断的慢性乙型肝炎患者50例,其中男性34例,女性16例,年龄 20~75岁,平均年龄(39.10±16.71)岁。诊断标准符合2000年中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的《病毒性肝炎防治方案》[3]。所有病例均排除其他肝炎病毒感染和自身免疫性疾病,药物、酒精性肝炎等。健康对照组20例,男性13例,女性7例,年龄22~ 61岁,平均年龄(37.50±9.74)岁,为我院健康体检者,无肝炎病史,血清乙型肝炎标志物均阴性,肝功能指标均正常。所有病例及对照组均签署知情同意书。
1.2 主要仪器和试剂 美国Bectond-Dickinson公司生产的FACS Calibur型流式细胞仪;抗CD3-PerCP、抗CD25-PE、抗 CD4-FITC、抗 Foxp3-APC及同型对照、CD3-FITC/CD8-PE/CD45-PerCP/CD4APCT细胞亚群试剂盒均购自美国Bectond-Dickinson公司;HBV DNA定量PCR试剂盒由中山医科大学达安基因股份有限公司提供,仪器为美国PE公司5700型DNA扩增仪;肝功能检测试剂盒由广州标佳试剂有限公司提供,仪器为美国 Beckman Coulter公司生产的LX20型全自动生化分析仪。
1.3 方法
1.3.1 流式细胞仪检测CD4+CD25highTreg细胞及胞内Foxp3和T淋巴细胞亚群 取两份新鲜采集的EDTA抗凝血各50μl分别置于不同的管中,分别加入抗CD3-PerCP、抗CD4-FITC、抗CD25-PE及抗CD3-PerCP、抗CD4-FITC、抗IgG1-PE各15μl,室温避光孵育20分钟,加入2 ml溶血素室温避光10分钟,1 000 r/min×5分钟离心后弃上清液,加入PBS 2ml洗涤1次,1 000 r/min×5分钟离心后弃上清液,加入PBS 250μl,上机使用CELLQuest软件进行检测,参照文献[4]选择荧光强度>102的CD4+CD25high作为Treg细胞。记录阳性细胞百分率,减去非特异性对照值。Foxp3胞内染色时先进行细胞表面抗CD3-PerCP、抗CD4-FITC、抗CD25-PE染色20分钟,加入2 ml溶血素室温避光10分钟,1 000 r/min×5分钟离心后弃上清液,再加入破膜剂1m l避光10分钟,破膜洗涤液洗涤2次,1 000 r/min×5分钟离心后弃上清液,分别加入抗Foxp3-APC及同型对照抗IgG1-APC各15μl,避光孵育30分钟,加入PBS 2m l洗涤1次,1 000 r/min×5分钟离心后弃上清液,加入PBS 250μl,上机使用CELLQuest软件检测分析,以FSC、SSC、CD3-PerCP、CD4-FITC定义CD4+T 细胞,计算这细胞群内 CD25+Foxp3+细胞的比率。检测CD3FITC/CD8PE/CD45Per-CP/CD4PE淋巴细胞亚群时另取新鲜采集的EDTA抗凝血50μl加入20μl试剂中,室温避光孵育15分钟,加入450μl溶血素,室温避光10分钟,上机使用MultiSET软件获取细胞并进行分析。
1.3.2 慢性乙型肝炎患者血清HBV DNA的定量检测 采用荧光定量PCR法,操作严格按照试剂说明书进行,检测阈值为103copies/ml,HBV DNA<1×103copies/m l为阴性结果。
1.3.3 肝功能检测 使用全自动生化分析仪,操作严格按照试剂说明书进行。项目包括谷丙转氨酶(ALT)、谷草转氨酶、碱性磷酸酶、乳酸脱氢酶、γ谷氨酰转肽酶、总胆红素、直接胆红素、总胆汁酸、总蛋白、白蛋白、球蛋白、前白蛋白共12项。
2 结果
2.1 慢性乙型肝炎患者外周血CD4+CD25highTreg表达水平 慢性乙型肝炎组CD4+CD25highTreg细胞占CD4+T细胞比例为(5.0±0.5)%,明显高于健康对照组(3.9±0.8)%,差异有统计学意义(P<0.01,表1、图1)。进一步分析,根据HBV DNA载量的不同,将慢性乙型肝炎患者分为高载量组(HBV-DNA≥105copies/m l),低载量组(HBV-DNA<105copies/ml),阴性组(HBV-DNA<103copies/ml)。结果显示随HBV DNA载量增加,患者外周血中CD4+CD25highTreg细胞的水平升高,高载量组、低载量组和阴性组CD4+CD25highTreg细胞的表达水平分别为(5.7±0.6)%、(4.9±0.6)%和(4.3±0.5)%,高载量组均明显高于低载量组和阴性组(P<0.01);低载量组高于阴性组(P<0.01),HBV DNA阴性组的CD4+CD25highTreg细胞高于对照组,但差异无统计学意义(P>0.05),见表2。
2.2 慢性乙型肝炎患者外周血Foxp3+Treg表达水平 Foxp3是CD4+CD25highTreg细胞的一个特征性标志。为证实在慢性乙型肝炎患者外周血中增高的CD4+CD25highTreg属于T调节细胞,我们同时检测了慢性乙型肝炎患者外周血中Foxp3的表达水平。慢性乙肝组和健康对照组CD4+CD25+Foxp3+表达率分别为(3.9±0.6)%和(2.9±0.5)%,慢性乙型肝炎组明显高于正常对照组(P<0.01,表1)。进一步分析,随 HBV DNA载量增加,患者外周血中Foxp3+Treg细胞的水平升高,高载量组、低载量组和阴性组Foxp3+Treg细胞的表达水平分别为(4.5±0.4%)、(3.9±0.5)%和(3.2±0.5)%,高载量组均明显高于低载量组和阴性组(P<0.01),低载量组高于阴性组(P<0.01),阴性组与健康对照组比较无明显差异(P>0.05),见表2。
2.3 慢性乙型肝炎患者CD3+CD4+CD8+T淋巴细胞亚群的变化 与健康对照组比较,患者组CD4+T细胞百分率及CD4+/CD8+比值均降低,分别为(28.5%±6.1%vs 33.6%±4.2%)及(1.12%±0.4%vs 1.4%±0.4%),差异有统计学意义(P<0.05);而CD3+T细胞和CD8+T细胞的百分率分别为(62.4%±9.2%vs 62.8%±7.4%)和(26.9%±6.4%vs 25.8%±6.2%),与对照组比较差异无显著性(P>0.05)。高载量组、低载量组和阴性组CD4+T细胞百分率均低于健康对照组(P<0.05),但各载量组之间无明显差异(P>0.05),高载量组和低载量组 CD4+/CD8+比值均低于正常对照组(P<0.05),而阴性组与对照组比较无明显差异(P>0.05);CD3+T细胞和CD8+T细胞百分率在各载量组无显著性差异(P>0.05),见表2。

表1 慢性乙型肝炎患者外周血Treg及CD3+CD4+CD8+T淋巴细胞亚群检测结果(%)Tab.1 Testing results of Treg and CD3+CD4+CD8+T lymphocyte subgroup in peripheralblood of CHB patients(%)
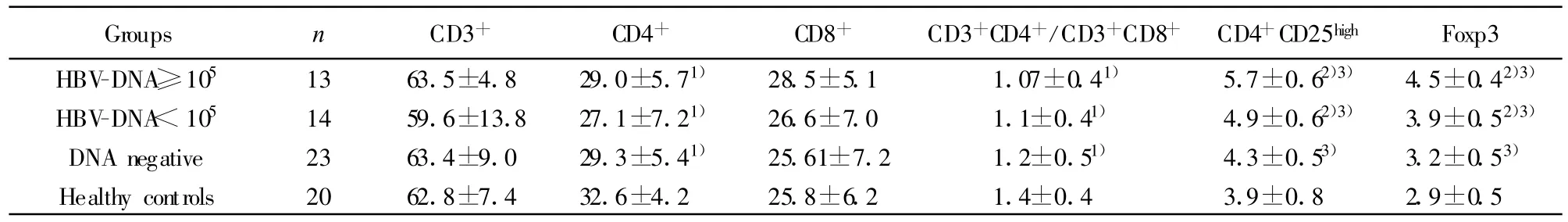
表2 HBV-DNA不同载量的慢性乙型肝炎患者外周血Treg及CD3+CD4+CD8+T淋巴细胞亚群检测结果(%)Tab.2 Testing results of Treg and CD3+CD4+CD8+T lymphocyte subgroup in peripheral blood of CHB patients with various copies of HBV DNA(%)
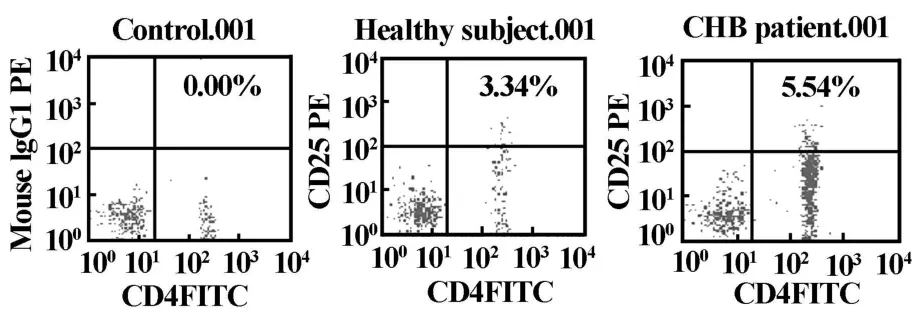
图1 慢性乙型肝炎患者外周血CD4+CD25high Treg细胞水平与健康对照组比较Fig.1 Comparision of the level of CD4+CD25high Tregs in peripheralblood between CHB patients and healthy controls
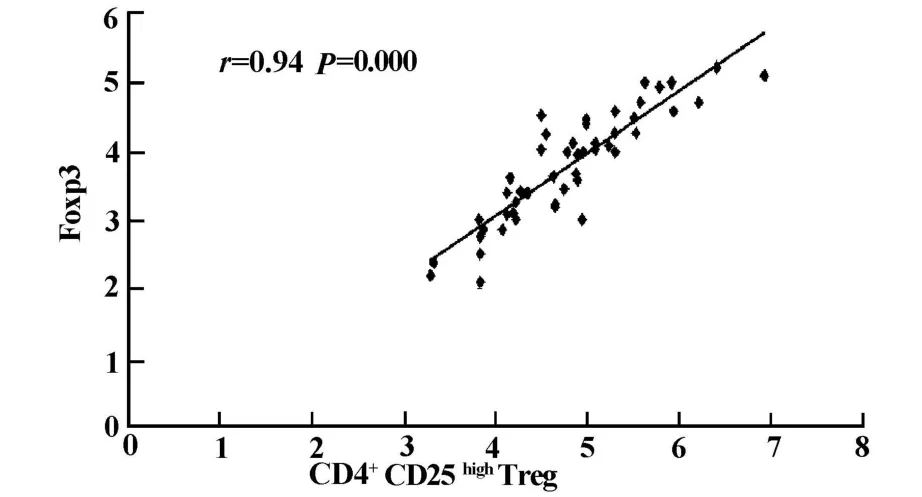
图2 CHB患者外周血CD4+CD25+Treg细胞水平与Foxp3+Treg细胞成正相关Fig.2 Positive correlation between CD4+CD25+Tregs and Foxp3+Tregs in peripheral b lood of CHB patients
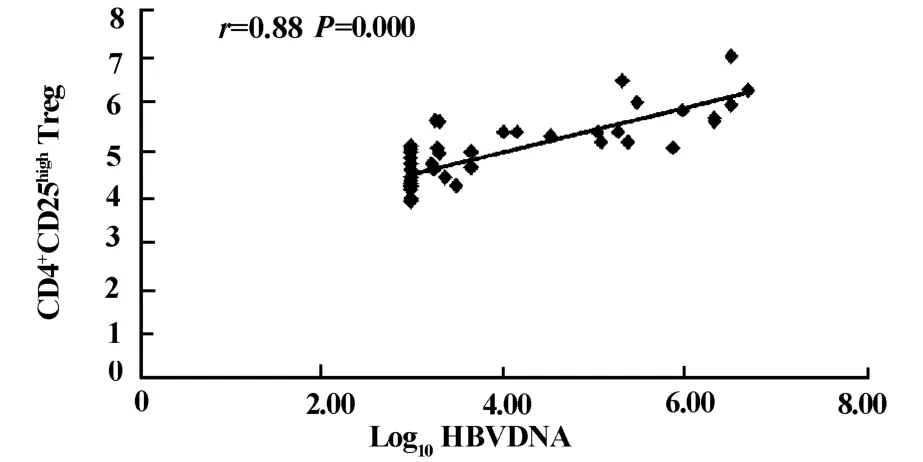
图3 CHB患者外周血CD4+CD25+Treg细胞水平与HBV DNA取对数后呈正相关Fig.3 The number of CD4+CD25+Tregs correlated positively with logarithm of HBV DNA copies in peripheral blood of CHB patients
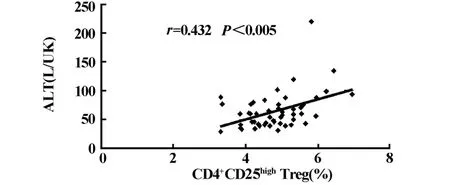
图4 CHB患者外周血CD4+CD25+Treg细胞水平与ALT成正相关Fig.4 The level of CD4+CD25+Tregs correlated positively with that of ALT in peripheral blood of CHB patients
2.4 慢性乙型肝炎患者外周血CD4+CD25highTreg水平与 CD4+CD25+Foxp3+Treg、CD3+CD4+CD8+T淋巴细胞亚群、HBV DNA载量的关系 对50例慢性肝炎患者外周血CD4+CD25highTreg细胞与CD4+CD25+Foxp3+Treg细胞、T淋巴细胞亚群、HBV DNA载量之间采用Pearson直线相关分析,CD4+CD25highTreg细胞的变化与CD4+CD25+Foxp3+Treg水平变化成正相关(r=0.94,P<0.001);与HBV DNA取对数后成正相关(r=0.88,P<0.001);与 CD3+、CD4+、CD8+T细胞的表达水平及CD4+/CD8+比值均无相关性(P>0.05),而CD3+、CD4+、CD8+T淋巴细胞及CD4+/CD8+比值与HBV DNA载量之间亦无相关性(P>0.05)。见图2、图3。
2.5 慢性乙型肝炎患者外周血CD4+CD25highTreg水平与肝功能指标的相关性 将CD4+CD25highTreg水平与肝功能检测指标做相关性分析,发现CD4+CD25highTreg水平与谷丙转氨酶(ALT)成正相关(r=0.432,P<0.005),见图4。
3 讨论
不同个体在HBV感染后的免疫学和临床转归不同,这与宿主的人类白细胞抗原(Human leukocyte antigens,HLA)等遗传学背景、HBV自身特性和细胞免疫应答均相关。在慢性乙型肝炎患者,HLA-1限制性的针对HBV各类抗原表位的特异性细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)应答常常不足或十分微弱,是肝细胞内HBV不易清除,病情迁延不愈的重要机制之一[5]。而近年来的研究证实CD4+CD25+Treg细胞对CTL免疫应答有调控作用,与乙型肝炎发病密切相关[1,2]。Treg细胞具有免疫无能性和免疫抑制性,在低浓度IL-2刺激下不反应,但在高浓度IL-2条件下经TCR激活后可活化或增殖,抑制CD4+和CD8+T淋巴细胞IL-2的转录和表达,从而干扰其活化与增殖,而且对CD8+细胞的杀伤功能有明显抑制[6,7]。Stoop等[2]发现慢性乙型肝炎患者外周血中CD4+CD25+Treg细胞数量较正常人增多,去除CD4+CD25+Treg细胞后,HBV特异性增殖反应增强。Xu等[8]研究发现慢性乙型肝炎患者外周血中Treg细胞的水平明显升高,且Treg细胞水平与其病毒载量呈正相关,分离得到的Treg细胞具有诱导形成HBV抗原特异性Treg的能力,HBV抗原特异性Treg则促进了HBV感染的慢性化。我们的研究结果也表明,CHB患者外周血中CD4+CD25+Treg细胞明显高于健康对照组,且随HBV DNA载量增加,患者外周血中CD4+CD25highTreg细胞的水平亦升高。提示CD4+CD25+Treg细胞引起细胞免疫反应下降,从而导致机体不能彻底有效清除病毒。
CD4+CD25highTreg作为天然调节性T细胞,是Treg的主要组成成分。叉头状/翅膀状螺旋转录因子(forkhead/winged helix transcription factor,Foxp3)是调节性T细胞比较特异的标志,特异性表达于小鼠Treg[9],而且在人胸腺和外周血及脐带血中均分离出CD4+CD25+Foxp3+细胞[10]。Foxp3与调节性T细胞的功能密切相关,是目前定义CD4+CD25+调节性T细胞的最佳标志物[11]。因此我们同时检测CHB患者外周血中CD4+CD25highTreg细胞及其胞内Foxp 3的表达,证实患者外周血中CD4+CD25+Foxp3+的水平变化与CD4+CD25highTreg细胞的数量改变相平行,且两者之间成正相关。
研究CD4+CD25highTreg细胞水平与HBV DNA载量及ALT的水平关系发现,CD4+CD25highTreg细胞水平与HBV DNA载量及ALT的水平之间均存在明显的相关性。说明Treg细胞的免疫抑制效应促进了HBV病毒的复制,从而加重肝功能的损害。动物实验已经证实[12],如果预先清除小鼠体内的CD25+T细胞,通过基因治疗后的小鼠体内针对HBV特异性的效应CD8+T细胞数量显著升高。体外实验表明,Treg可以抑制细胞增殖和IFN-γ分泌[4]。因此如果能将特异性阻断CD4+CD25highTreg的方法和增强机体特异性抗HBV的免疫功能手段有机结合,也许能抑制HBV的复制,提高CHB的治疗效果。
T细胞亚群是目前临床上最常用的反映免疫功能状态的指标,我们同时检测了CHB患者的T淋巴细胞亚群,发现与对照组相比,CHB患者CD4+T细胞数量及CD4+/CD8+比值均降低,差异有统计学意义,CD8+T淋巴细胞虽有增高的趋势,但与对照组比较无明显差异。该结果提示 CHB患者外周血CD4+T细胞数量及CD4+/CD8+比值降低,显示机体T淋巴细胞数量异常,免疫功能低下,可促进病毒的复制。其原因可能与其体内Treg细胞含量较高有关系,Treg细胞抑制了CD4+T细胞的活化增殖和细胞因子的分泌,从而影响机体抗感染免疫应答的发生,导致感染的持续。先前有报道CHB患者机体特异性的CD8+T细胞反应减弱是HBV慢性感染状态持续存在的主要原因[13]。但我们的结果显示CHB组CD3+T细胞和CD8+T细胞的百分率与对照组比较差异无显著性。CD4+、CD8+、CD3+T细胞数量及CD4/CD8比值在HBV DNA各载量组之间均无明显差异,且与HBV的复制水平均无明显相关性。可能是因为病例数较少,亦可能是CD4+T细胞和CD8+T细胞各自包含了很多功能各异的细胞群体,因此 T细胞亚群不能全面反映机体的免疫功能状态。
本研究还发现CD4+CD25highTreg细胞与CD3+、CD4+、CD8+T细胞的表达水平之间均无明显的相关性,其确切原因不清楚,我们认为慢性乙型肝炎患者体内的T细胞调节是一个多因素参与的过程,CD4+及CD8+T细胞的抑制可能受多种途径多种因素调控,CD4+CD25+Treg细胞只是其中一种。
综上所述,CD4+CD25+Treg可能参与了慢性乙型肝炎发生、发展,CD4+CD25+Treg细胞与HBV的复制水平及ALT增高具有较好的一致性,可能是一个较好的反映细胞免疫功能状态的参考指标,有望在临床上用于免疫功能的监测,而T细胞亚群是否可作为监测CHB患者免疫状态的指标需进一步探讨。
1 Franzese O Kennedy P T,Gehring A Jetal.Modulation of the CD8+-T-cell response by CD4+CD25+regulatory T cells in patientswith hepatitis B virus infection[J].JVirol,2005;79(6):3322-3328.
2 Stoop JN,van der Molen RG,Baan C Cetal.Regulatory T cells contribute to the impaired immune response in patientswith chronic hepatitis B virus infection[J].Hepatology,2005;41(4):771-778.
3 中华医学会传染病与寄生虫学会、肝病学分会.病毒性肝炎防治方案[J].中华内科杂志,2001;40(1):62-68.
4 福军亮,徐东平,赵 平etal.急慢性乙型肝炎患者外周血调节性T细胞鉴定与临床意义分析[J].中华医学杂志,2006;86(22):1522-1525.
5 Bertoni R,Sidney J,Fow ler Petal.Human histocompatibility leukocyte antigen-binding supermotifspredict broafly cross-reactivevytotoxic T lymphocyte responses inpatientswith acutehepatitis[J].JChin Invest,1997;100:503-513.
6 Camara NO,Sebille F,Lechler R I.Human CD4+CD25+regulatory cells havemarked and sustained effectson CD8+cellactivation[J].Eur J Immunol,2003;33(12):3473-3483.
7 ChenM L,PittetM J,Gorelik L.Regulatory T cells suppress tumor-specific CD8+T cell cytotoxicity through TGF-βsignals in vivo[J].Proc Natl Acad Sci USA,2005;102(2):419-424.
8 Xu Dongping,Fu Junliang,Jin Leietal.Circulation and liver resident CD4+CD25+regulatory T cells actively influence the antiviral immune response and disease progression in patientswith hepatitis B[J].J Immunol,2006;177:739-747.
9 Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003;299:1057-1061.
10 MorganM E,van Bilsen JH,Bakker AMetal.Expression of FOXP3 mRNA isnot confined to CD4+CD25+T regulatory cells in humans[J].Hum Immunol,2005;66:13-20.
11 Fontenot JD,Rudensky AY.Awell adapted regulatory contrivance:regulatory T cell development and the forkhead fam ily transcription factor Foxp3[J].Nat Immunol,2005;6:331-337.
12 Furuichi Y,Tokuyama H,Ueha Setal.Depletion ofCD25+CD4+T cell(Tregs)enhances the HBV-specific CD8+T cell response primed by DNA immunization[J].World JGastroenterol,2005;11:3772-3777.
13 徐慧宁,姜艳芳,牛俊奇.CD4+CD25+调节性T细胞在慢性乙型肝炎中的研究进展[J].中国老年学杂志,2008;28(3):306-308.
[收稿2009-04-25 修回2009-12-21]
(编辑 倪 鹏)
Study on CD4+CD25+regulatory T cells and CD4+,CD8+T lymphocyte subgroup in peripheralblood of patientsw ith chronic hepatitis B
WUCui-Ping,QINXi,WANGHua-Min,WUCui-Yun,LiWen-Guang,LINDan,ZHUHong,LIYi.DepartmentofLaboratoryMedicine,HainanMedicalCollege,Haikou570102,China
Objective:To investigate thequantificationof CD4+CD25+regu latory T cellsand distributionof CD4+CD8+T lymphocyte subgroup in peripheral blood of patients in chronic hepatitis B(CHB),and to reveal relationship between CD4+CD25+regulatory T cells,CD4+CD8+T lymphocyte subgroup and HBV infetion aswell.Methods:CD4+CD25high,CD4+CD25+Foxp3+Treg and CD3+CD4+CD8+T lymphocyte subgroup in peripheralblood from 50 patientswith CHB and 20 healthy controlswas analyzed using flow cytometry.HBV DNA was detected by fluorescence quantitative PCR.Results:The numberof CD4+CD25highTregs in patientswith CHBwas obviously higher than that in healthy controls(P<0.01)and increased with copies of HBV DNA.The same with the change ofCD4+CD25+Foxp3+Tregs in patientswith CHB and therewasa positive correlation between CD4+CD25highTregs and CD4+CD25+Foxp3+Tregs(r=0.890,P<0.001).Comparedwith healthy controls,the frequency of CD4+T cells and the ratio of CD4+/CD8+in patientswith CHBwas declined,but therewas no significant difference in the frequency of CD3+T cells and CD8+T cells between them(P>0.05).The variation in the number of CD4+CD25highTregs was correlated positivelywith the copies of HBV DNA(r=0.782,P<0.001)and glutam ic-pyruvic transaminase(ALT)(r=0.432,P<0.005)separately,butnegatively with the frequency ofCD3+,CD4+,CD8+T cells and the ratio of CD4+/CD8+(P>0.05).The variation in the frequency of CD3+,CD4+,CD8+T cells and the ratio of CD4+/CD8+was also correlated negatively with the copies of HBV DNA(P>0.05).Conclusion:The number of CD4+CD25highTregs increases in patientswith CHB and is in accordance with the copies of HBV DNA and increased level of ALT.Further studies should be done to investigate weather CD4+CD8+T lymphocyte subgroup could be used to monitor the stateof community.
CD4+CD25+Treg;Chronic hepatitis B;T lymphocyte subgroup
R392.9
A
1000-484X(2010)03-0273-05
①吉林大学白求恩医学院,长春130012
②同时就职于海南医学院检验系,海口571101
③海口市人民医院,海口570208
巫翠萍(1962年-),女,副主任检验师,主要从事流式细胞术的应用及研究,E-mail:wucuiping2007@163.com;通讯作者及指导教师:覃 西(1959年-),女,教授,主要从事临床血液学和免疫学检验研究,E-mail:qinxi99@21cn.com。