在兔胸骨舌骨肌内构建组织工程管状软骨的实验研究
罗旭松 杨健 刘伟 张文杰 崔磊 周广东 曹谊林
在兔胸骨舌骨肌内构建组织工程管状软骨的实验研究
罗旭松 杨健 刘伟 张文杰 崔磊 周广东 曹谊林
目的了解兔颈部胸骨舌骨肌的血供解剖特点,并尝试在该肌肉内构建组织工程管状软骨。方法用红色乳胶灌注新西兰兔的动脉系统,显示营养胸骨舌骨肌的动脉血管分布情况。将兔自体软骨细胞-PGA/PLA复合物在体外培养2周后,植入兔胸骨舌骨肌内继续培养4周,取材进行相应的组织学检测,并与正常兔气管组织进行比较。结果兔胸骨舌骨肌由颈总动脉的2个直接分支供血。其中第一分支的发出点接近胸骨舌骨肌中点,供应整块肌肉;第二分支发出点偏舌骨端,主要供应肌肉上半部分。体内培养4周后,在兔胸骨舌骨肌内可见规则的管状软骨组织,表面形成致密的血管网络。HE染色见软骨细胞排列规则,包埋在软骨陷窝内,表层细胞较大、深部细胞较小;Safranin O染色呈强阳性,表示有丰富的蛋白聚糖基质;Ⅱ型胶原免疫组化显示,新生软骨陷窝周围呈强阳性反应,表明有大量Ⅱ型胶原分泌。新生软骨的特性与正常气管软骨类似。结论在兔胸骨舌骨肌内可以构建出满意的组织工程管状软骨。本研究为应用胸骨舌骨肌预构肌肉-软骨复合组织瓣修复气管缺损进行了探索。
组织工程软骨胸骨舌骨肌
各种原因(先天畸形、外伤、肿瘤等)造成的气管缺损在临床上较为常见,如果缺损范围较大,需要手术修复,手术的关键在于重建能起到支撑作用的软骨组织。以往曾采用自体组织、异体组织和人工材料等进行修复,但是都存在各种缺点[1-2]。近年来,人们尝试使用组织工程化管状软骨进行气管重建,有望成为一种理想的修复手段[3-4]。目前,大多数研究是将体外或体内构建的组织工程化软骨,通过游离移植修复缺损,需要在受区建立血运。而气管部位血运并不丰富,难以快速重建血运。
为此,我们设想在气管邻近的肌肉内构建管状软骨,然后以该肌肉携带组织工程化管状软骨,带蒂修复气管缺损,从而达到自带血供的目的。我们在前期实验的基础上[5-6],选择兔胸骨舌骨肌进行可行性验证。本实验中,我们研究兔胸骨舌骨肌的血供情况,并尝试利用其携带组织工程化管状软骨修复气管缺损。
1 材料与方法
1.1 实验动物
12只成年新西兰白兔(上海川沙动物饲养场),雄雌各半,6只用于解剖研究,6只用于管状软骨构建。
1.2 方法
1.2.1 兔胸骨舌骨肌的解剖研究
兔麻醉处死后,剖开腹腔,分离出腹主动脉和下腔静脉,从下腔静脉放血,结扎腹主动脉,从结扎处近端穿刺置管,向腹主动脉内先推注含肝素的生理盐水清洗血管系统,然后推注红色乳胶灌注动脉系统,动物置于室温(10℃)下48 h等待乳胶凝固。
仰卧颈伸位固定动物,从正中线切开颈部皮肤和皮下组织,在此层次向两侧分离,充分暴露出颈前区肌肉,可见胸骨舌骨肌的舌骨端。两侧胸锁乳突肌位于胸骨舌骨肌下1/3部分的浅层,离断胸锁乳突肌的胸骨端后可充分显露胸骨舌骨肌的胸骨端(图1A),从正中线分离两侧胸骨舌骨肌,可见紧贴下方的兔喉部和颈部气管(图1B),在气管旁沟里有乳胶灌注显色的颈总动脉,牵起后可见其分支(图1C),修去结缔组织,充分显露颈总动脉及分支。
1.2.2 带蒂组织工程软骨的构建和检测
1.2.2.1 软骨细胞分离与培养
无菌条件下切取兔耳廓1 cm×1 cm大小的软骨块,消化分离出软骨细胞[6-7],37℃、5%CO2、饱和湿度条件下培养,3 d后首次换液,以后隔日换液。原代软骨细胞12~24 h贴壁,由圆形逐渐伸展呈椭圆形、三角形和多角形,形成独立的同源细胞群,随后细胞群落逐渐扩展融合。传代后软骨细胞增长加速,分裂细胞多见,大多是多角形,一般5~7 d即可达到90%以上的融合状态。免疫荧光染色显示,细胞核PI衬染为红色,表达Ⅱ型胶原的细胞浆染为绿色(图2A)。传至第2~3代,细胞量达到6~8×107个时,即可用于管状软骨的构建。
1.2.2.2 软骨细胞-PLA/PGA复合物的体外构建
聚乳酸/聚乙醇酸复合纤维(PLA∶PGA=1∶99)80mg,用75%乙醇浸泡60min消毒、PBS冲洗2次后,均匀缠绕在长为1.5 cm、直径为6 mm的硅胶模具上,成为圆筒形支架材料(图2B)。将6×107cells/mL的软骨细胞悬液1 mL,均匀接种于支架材料,37℃、5%CO2、饱和湿度下培养4 h,移入50 mL聚丙烯离心管(BD Biosciences公司),加入30 mL软骨细胞培养液,隔日换液,继续培养2周。
1.2.2.3 兔胸骨舌骨肌内植入细胞-材料复合物
用氯氨酮(5mg/kg)和速眠新(0.05~1m L/kg)肌注,麻醉实验用兔,颈部剃毛,常规新洁尔灭酊消毒、铺巾,颈部正中切口暴露出胸骨舌骨肌,将兔自体软骨细胞-材料复合物置于肌肉表面(图2C),以6-0可吸收线缝合肌肉两侧,将复合物包裹入内(图2D),关闭切口。术后单笼常规饲养,连续3 d肌注青霉素,每次10万单位,每日2次。
1.2.2.4 组织学检测
术后4周取材,标本用4%多聚甲醛固定,石蜡包埋切片,行HE染色、Safranin O特殊染色和Ⅱ型胶原ABC法免疫组化染色。
2 结果
2.1 兔胸骨舌骨肌的血供解剖特点
4只实验用兔的胸骨舌骨肌,由颈总动脉主干的两个直接分支供血(图1C):第一分支发出位置接近肌肉中部、偏舌骨端,进入肌肉后分叉为升支和降支,分别供应肌肉的上半和下半部分(图1D);第二分支位于肌肉中上1/3处,供应同侧肌肉的上半部分(图1E)。两分支的直径大致相等,约0.3~0.4mm,发出位置较固定,均有伴行静脉。另外2只兔的第二分支比第一分支粗,从颈总动脉发出后很快再分成4支,1支供应同侧胸骨舌骨肌,其余3支供应下颌下腺、喉部和颈部其他肌肉(图1F)。
2.2 兔胸骨舌骨肌内构建的组织工程软骨检测
2.2.1 大体观察
在肌肉内构建4周后,细胞-材料复合物形成了与肌肉紧密相连的管状软骨,表面有丰富的血管网(图2E,F)。软骨弹性良好(图3A),撤出硅胶模具后可耐受横切面上的反复压缩(模拟呼吸时的正负压波动)和纵向的反复弯曲(模拟颈部的活动)。
2.2.2 组织学检测结果
HE染色显示,组织工程化管状软骨的细胞排列规则,包埋于软骨陷窝内,软骨表层细胞较大、圆形,深部为较小的同源软骨细胞群。Saffarin O染色呈强阳性,提示有蛋白聚糖基质生成。Ⅱ型胶原免疫组化显示,新生软骨陷窝周围呈强阳性反应(棕黄色),表明有大量软骨特异性蛋白Ⅱ型胶原分泌(图3B-D),与正常兔气管软骨相似(图3F-H)。
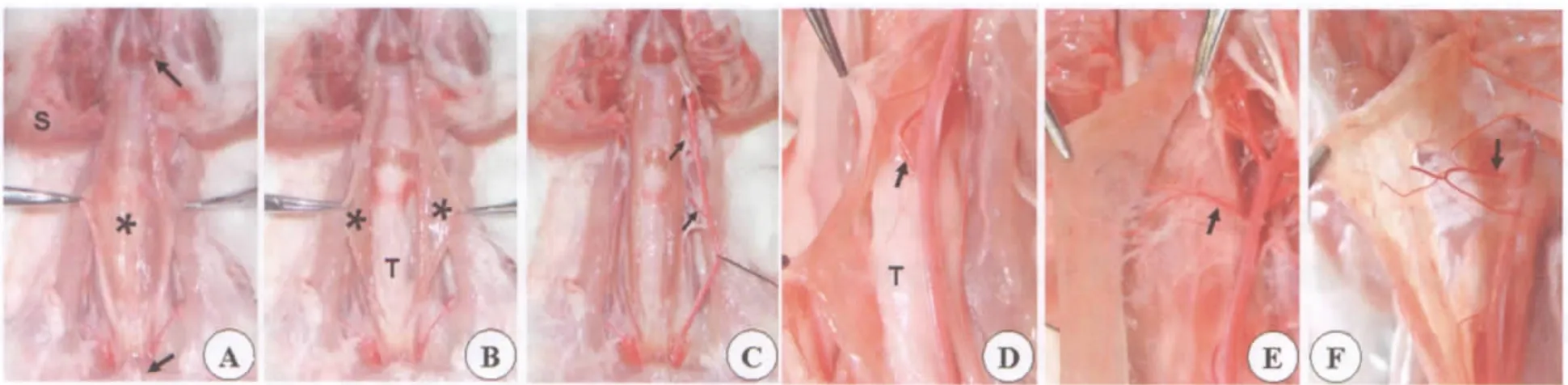
图1 兔胸骨舌骨肌的血供解剖
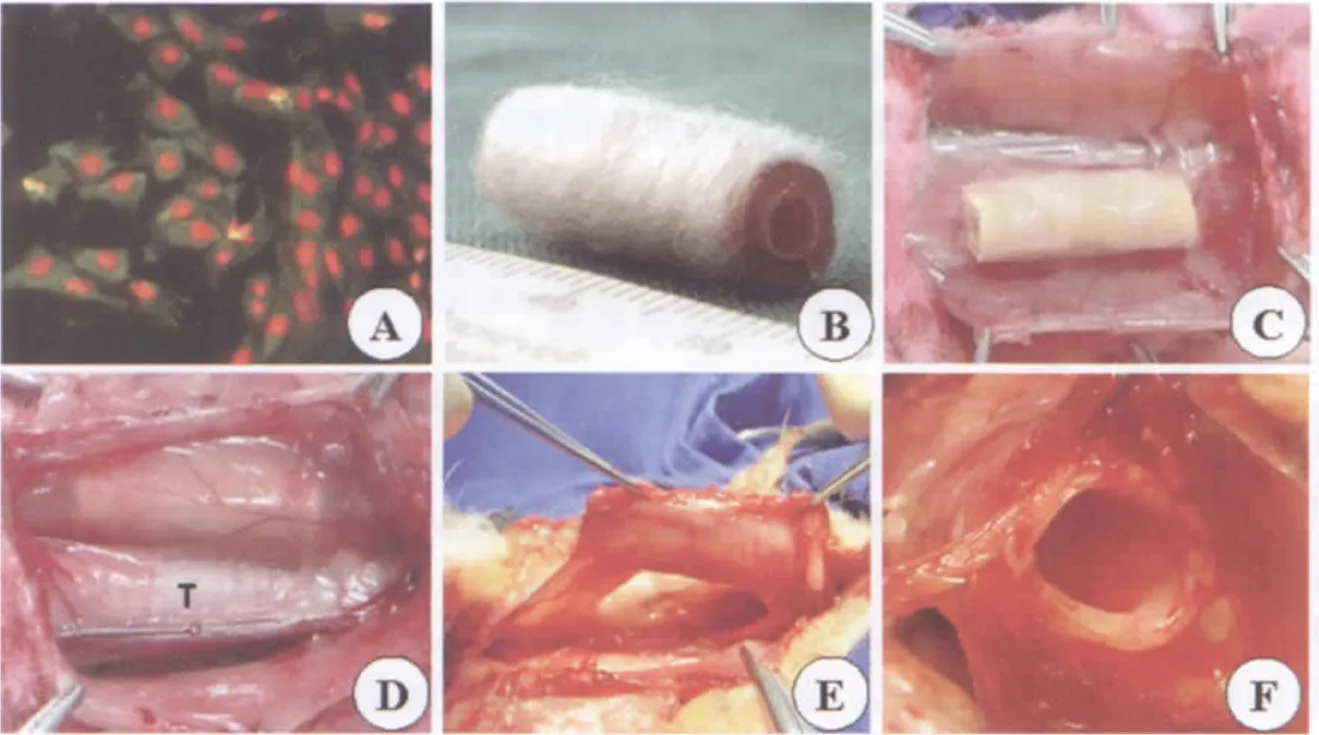
图2 胸骨舌骨肌内构建管状软骨
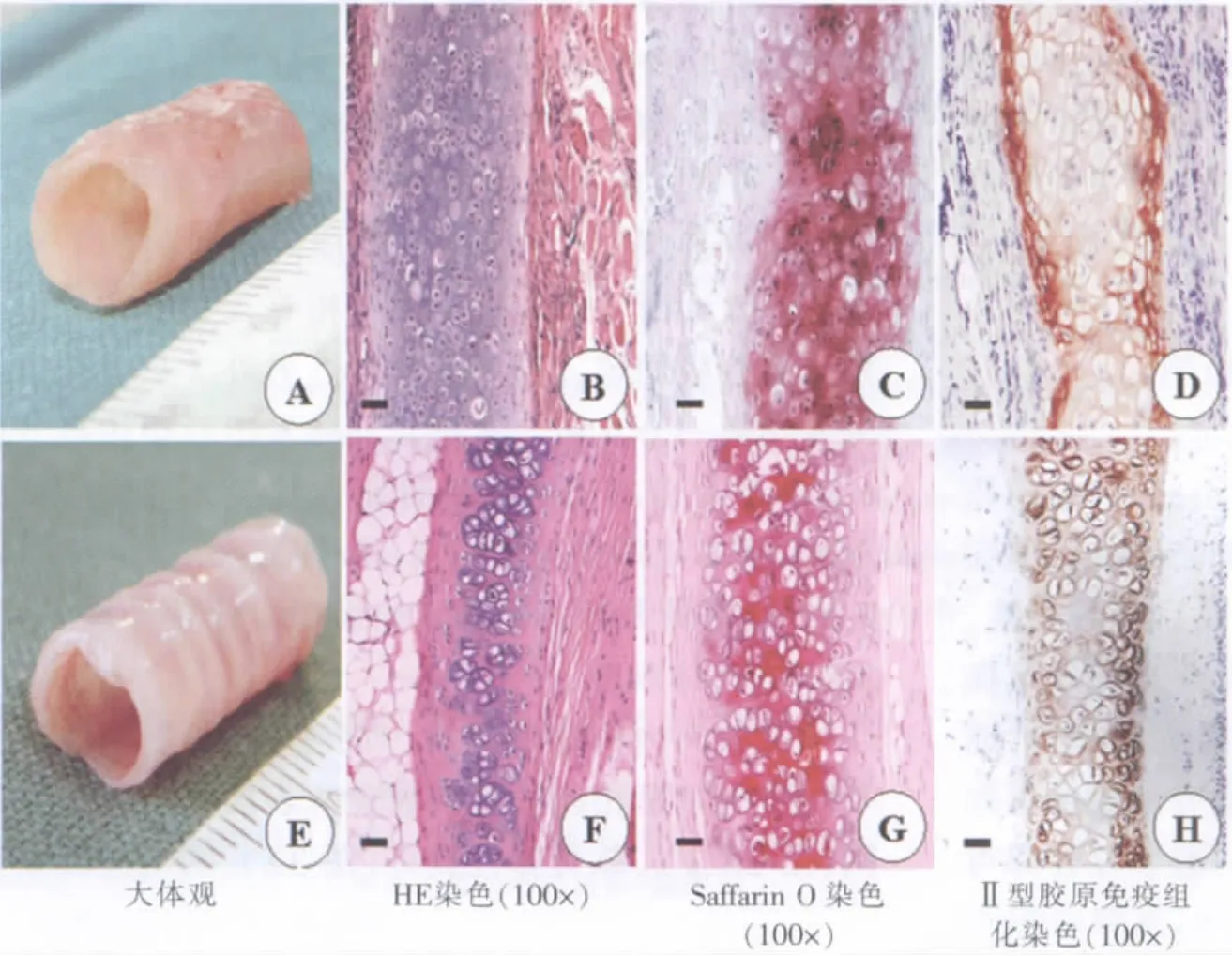
图3 管状软骨大体观和组织学(上)与正常兔气管(下)相似
3 讨论
利用组织工程技术构建的组织,如能在修复部位快速建立血供,将有利于组织的成活。当构建组织的体积较大,或是缺损范围大、局部血供差、瘢痕严重、存在感染时,血供尤其关键[8]。研究发现,在材料支架上结合VEGF、PDGF和肝素等因子,可以促进血管生成[9-10]。另有报道利用微电子机械或微液流技术,在材料内部构造出模拟微血管分支的网络结构,可使接种在材料内部的细胞80%以上保持活力[11-12]。此外,还有研究利用自体血管化的能力,在循环丰富的组织内植入构建组织[13-14],生成组织的质量优于单纯体外构建的组织。后者特别适合用于构建本身不含血管的软骨组织。
胸骨舌骨肌紧邻喉、气管,常将其设计成双蒂或单蒂的肌(皮)瓣直接转位修复喉、气管缺损,操作简单、效果可靠[15-16]。只要术中不影响肌肉的起止点和神经支配,就不会影响修复后的肌肉功能。胸骨舌骨肌的止点位于喉与气管平面的前方,当肌肉收缩时会产生向前的牵引力,从而可保持重建气管的通畅。兔胸骨舌骨肌主要由颈总动脉发出两个直接分支供应。按照Mathes等[17]对肌肉的血供分类方法,兔胸骨舌骨肌应属Ⅱ型,即第一分支为主要血管、第二分支为次要血管。在注意保护好这两个分支,尤其是第一分支的前提下,可将兔胸骨舌骨肌-软骨复合瓣设计成双蒂或单蒂,以满足气管缺损修复的需要。
本实验尝试在兔胸骨舌骨肌内构建管状软骨,利用其丰富的血管和营养,生成了与正常气管软骨类似组织。在后续研究中,我们将考虑利用肌肉-管状软骨复合瓣修复兔气管节段性缺损,以期为临床应用组织工程技术修复或重建气管提供参考。
[1]Grillo HC.Tracheal replacement:a critical review[J].Ann Thorac Surg,2002,73(6):1995-2004.
[2]HabalMB.Tracheal reconstruction:attempts inmore than 50 years [J].JCraniofac Surg,2009,20(3):872.
[3]Vacanti CA,Paige KT,Kim WS,et al.Experimental tracheal replacement using tissue-engineered cartilage[J].JPediatr Surg, 1994,29:201-205.
[4]Macchiarini P,Jungebluth P,Go T,et al.Clinical transplantation of a tissue-engineered airway[J].Lancet,2008,372(9655):2023-2030.
[5]Xiao K,Zhou G,Liu W,et al.Experimental study of repairing rabbit tracheal defects by tissue engineered tubular cartilage[J]. Chin JThorac Cardiovasc Surg,2006,22(1):45-48.
[6]Luo X,Zhou G,Liu W,et al.In vitro precultivation alleviates post-implantation inflammation and enhancesdevelopmentof tissue engineered tubular cartilage[J].Biomed Mater,2009,4(2):25-26.
[7]Zhou G,LiuW,Cui L,et al.In vivo chondrogenesis of BMSCs at non-chondrogenesis site by co-transplantation of BMSCs and chondrocytes with pluronic as biomaterial[J].Key Engineering Materials,2005,288-289:3-6.
[8]Lovett M,Lee K,Edwards A,et al.Vascularization strategies for tissue engineering[J].Tissue Eng Part BRev,2009,15(3):353-370.
[9]Zisch AH,Lutolf MP,Hubbell JA.Biopolymeric deliverymatrices for angiogenic growth factors[J].Cardiovasc Pathol,2003(12):295-310.
[10]Zhang G,Suggs LJ.Matrices and scaffolds for drug delivery in vascular tissue engineering[J].Adv Drug Deliv Rev,2007,59(4-5): 360-373.
[11]Nazhat SN,Neel EA,Kidane A,et al.Controlled microchannelling in dense collagen scaffolds by soluble phosphate glass fibers[J]. Biomacromolecules,2007,8(2):543-551.
[12]Song YS,Lin RL,MontesanoG,etal.Engineered 3D tissuemodels for cell-ladenmicrofluidic channels[J].Anal Bioanal Chem,2009, 395(1):185-193.
[13]NeumeisterMW,Wu T,ChambersC.Vascularized tissue-engineered ears[J].Plast Reconstr Surg,2006,117(1):116-122.
[14]Beier JP,Horch RE,Hess A,etal.Axial vascularization ofa large volume calcium phosphate ceramic bone substitute in thesheep AV loop model[J].JTissue Eng Regen Med,2009,4(3):216-223.
[15]Papay FA,Eliachar I,Stein JM,et al.Structural stability of the rotary doormyocutaneous flap[J].Laryngoscope,1998,108(3):385-392.
[16]ChenWX,Ruan YY,CuiPC,etal.Long-term resultsofthesternohyoid myocutaneous rotary door flap for laryngotracheal reconstruction [J].Ann Otol Rhinol Laryngol,2002,111(1):93-95.
[17]MathesSJ,NahaiF.Classification of thevascularanatomyofmuscles: experimentaland clinical correlation[J].PlastReconstr Surg,1981, 67(2):177-187.
Experimental Research on Tubular Cartilage Engineering in Rabbit Sternohyoid Muscle
LUO Xusong1,YANG Jian2, LIUWei1,ZHANGWenjie1,CUILei1,ZHOU Guangdong1,CAO Yilin1.
1 Department of Plastic and Reconstructive Surgery, Shanghai Nin th People’s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.2 Shanghai Pulmonary Hospital,TongjiUniversity,Shanghai200433,China.Corresponding authors:ZHOU Guangdong,CAO Yilin.
ObjectiveTo explore the vascular anatomy of rabbit sternohyoid muscle and construct tubular cartilage inside themuscle.MethodsRed latex perfusion was used to analyze the vascular pattern of rabbit sternohyoid muscle. Autologous chondrocyte-PLA/PGA constructs were pre-cultured for 2 weeks in vitro,wrapped by sternohyoid muscle for another 4 weeks,and then harvested for gross observation and histological analysis.Normal rabbit tracheal cartilage served as control.ResultsRabbit sternohyoid muscle was directly supplied by two branches from common carotid artery.One branch entered themuscle in themiddle and supplied the wholemuscle,while the other entered beside the hyoid end and supplied the upper half.After 4 weeks of culture in muscle pocket,the cell-scaffold construct developed into a cartilage tube with dense anastomosis on its surface.HE staining showed that the chondrocytes were arranged regularly in lacuna,with large cells on the surface and small cells in the deep.Safranin O staining showed strong positive results,indicating abundant proteoglycan in thematrix.Immunochemistry showed strong positive results around the lacune,suggestingmassive typeⅡcollagen secretion.All indicated that the neo-cartilage had similar properties to normal rabbit tracheal cartilage.ConclusionThe pocket of sternohyoid muscle is an ideal site for cartilage engineering in vivo.The resultsmay act as an experimental basis for further prefabrication ofmuscle-cartilage composite in the repair of tracheal defect.
Tissue engineering;Cartilage;Sternohyoidmuscle
book=78,ebook=20
Q813.1+2
A
1673-0364(2010)02-0078-04
10.3969/j.issn.1673-0364.2010.02.005
2010年1月19日;
2010年2月15日)
200011上海市上海交通大学医学院附属第九人民医院整复外科(罗旭松,刘伟,张文杰,崔磊,周广东,曹谊林);200433上海市同济大学附属上海市肺科医院(杨健)。
周广东,曹谊林。

