人胚胎干细胞定向分化为血管内皮细胞的初步研究
王彦 钱德俭 尉真 陆峻泓 张文杰 崔磊 曹谊林
血管再生在骨创伤后组织修复中占有举足轻重的地位。人的血管发生是一个非常复杂的细胞生物学过程,包括:血管形成(Vasculogenesis),由未分化的胚胎干细胞分化为成血管细胞(Angioblast),再形成内皮细胞,彼此连接组成血管;血管新生或芽殖(Angiogenesis),由已形成的微血管内皮细胞冲破管壁的基质,迁移、增殖和连接组成新的血管[1]。这两种方式在胚胎发育过程中均有出现,且时间上往往交错进行。而成体创伤后,组织修复中血管的发生主要是芽殖方式。近年来,组织工程技术的迅猛发展给骨创伤后组织修复的基础研究和临床治疗提供了新的思路。
人胚胎干细胞(Embryonic stem cells,ES)具有向三个胚层分化的潜能,是研究人胚胎发育和细胞分化的理想模型。随着人ES细胞系的建立,应用人ES细胞研究内皮细胞发生和血管形成成为可能[2-7]。我们将来源于人囊胚内细胞团的ES细胞,以含维甲酸(Retinoic acid,RA)的培养液经悬浮培养,形成拟胚体(Embryonic body,EB),再将 EB 贴壁,换含TGF-β1的培养液继续培养,形成内皮细胞。该方法为研究骨创伤修复中内皮细胞和血管发生及其机制建立了一个良好的模型,且有望为临床治疗提供新的种子细胞。
1 材料和方法
1.1 材料
人ES细胞株 (上海交通大学医学院附属第九人民医院组织工程实验室),knock-out DMEM(Gibco公司,美国),KO Serum Replacer(Hyclone 公司,美国),Non-essential Amino Acids(Gibco 公司,美国),L-glutamine(Sigma 公司,美国),β-mercaptoethanol(Sigma 公司,美国),b-FGF(Sigma 公司,美国),维甲酸 (Sigma公司, 美国),TGF-β1 (R&D 公司,美国),丝裂霉素 C(Sigma 公司,美国),Oct-4 抗体(兔抗小鼠多抗,中科院上海生化细胞所),SSEA-4抗体(兔抗小鼠多抗,中科院上海生化细胞所),兔抗人Ⅷ因子抗体 (Santcruz公司,美国),鼠抗CD34单抗(Santcruz公司,美国),昆明小鼠(山东大学动物实验室)。
1.2 方法
1.2.1 人 ES 细胞培养
培养液为knock-out DMEM,含20%knock-out serum replacer、1%non-essential amino acids、1 mM L-glutamine、0.1 mM β-mercaptoethanol、4 ng/mL bFGF。37 ℃、5%CO2培养箱培养;5~7 d后,以 1 mg/mL Ⅳ型胶原酶消化,常规传代。
1.2.2 拟胚体培养及诱导
取生长良好的人ES细胞,机械法分割成小块,接种到预先铺陈1%琼脂的培养皿,培养液为knock-out DMEM,含 20%knock-out serum replacer、1%non-essential amino acids、1 mM L-glutamine、0.1 mM β-mercaptoethanol,加维甲酸,至终浓度为1×10-9mol/L ,37 ℃、5%CO2培养 3~5 d,收集生长较好的拟胚体,均等地移植到预先用0.1%明胶铺陈的培养皿中,每孔约3~4个拟胚体,加含3 ng/mL TGF-β1的无血清DMEM,每隔2天换液,继续培养。对照组加不含TGF-β1的无血清DMEM。每天观察照相,并做相关检测。
1.2.3 免疫荧光检测
抗体:兔抗人Ⅷ因子抗体,工作浓度1∶100;羊抗兔IgG-罗丹明,工作浓度1∶50。免疫荧光染色:待拟胚体周围分化出上皮样和圆形细胞及血管样结构时,用PBS漂洗3遍,4%多聚甲醛固定10 min,再次PBS漂洗,0.25%Triton处理10 min,滴加Ⅷ因子抗体,37℃温育1 h,PBS洗 3次,加 IgG-罗丹明,37 ℃反应 45 min,PBS 漂洗,甘油/PBS(1∶2)封固,荧光显微镜观察,照相。
1.2.4 Dil-Ac-LDL 标记检测
以无血清DMEM稀释Dil-Ac-LDL为10 μg/mL,加至已分化出血管样结构的拟胚体培养皿中,37℃孵育4 h,将其去除,无血清DMEM洗3遍,荧光显微镜观察,照相。
1.2.5 扫描电镜观察
取诱导后分化出的上皮样和圆形细胞及血管样结构,以2%戊二醛固定,PBS漂洗,1%锇酸固定,PBS漂洗,梯度乙醇脱水,醋酸正戊酯置换,CO2临界点干燥,离子喷射仪喷金,扫描电镜观察。
1.2.6 透射电镜观察
取诱导后分化出的上皮样和圆形细胞及血管样结构,2%戊二醛固定24 h,收集标本,1%锇酸后固定1 h,梯度乙醇脱水,1∶1丙酮包埋液渗透,EPON包埋,常规超薄切片,透射电镜(JEM-1200EX)观察细胞与血管的超微结构。
2 结果
2.1 人ES细胞细胞培养
体外培养的人ES细胞在饲养层细胞上以巢状方式生长(图1),细胞间界限清楚,细胞质结构简单,细胞核质比例高。
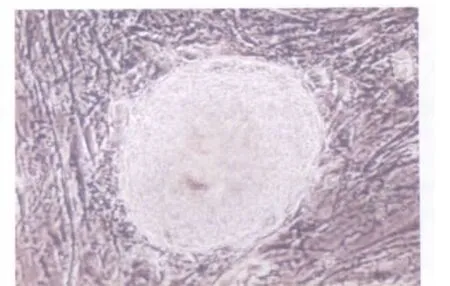
图1 人ES细胞克隆(P17)(相差显微镜,100×)
2.2 拟胚体培养及诱导
培养的第5天,培养皿中形成球形的拟胚体,透亮、边缘光洁 (图2)。将EB贴壁,用含3 ng/mL TGF-β1的无血清DMEM诱导,第2天,EB周围出现上皮样和圆形细胞(图3);第3天,开始出现由圆形细胞构成的管状结构,且圆形细胞逐渐变为扁平状细胞。管状结构自EB向周围呈辐射状生长,并渐连接成网状,管道排列清楚(图4)。诱导组约有95%可分化为这类结构,而对照组绝大多数EB周围未发现血管样结构产生。
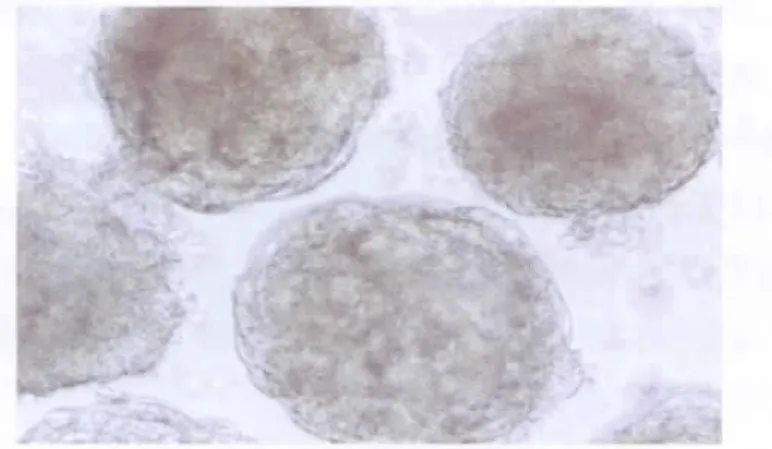
图2 人ES细胞悬浮培养形成拟胚体(相差显微镜,100×)
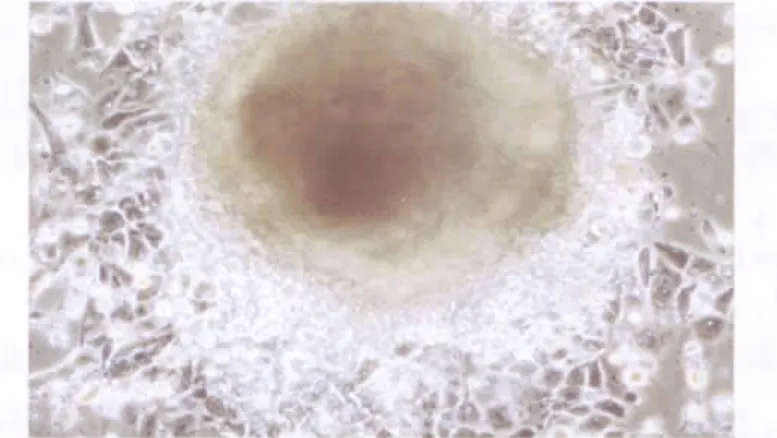
图3 拟胚体贴壁第2天,圆形细胞出现(相差显微镜,100×)
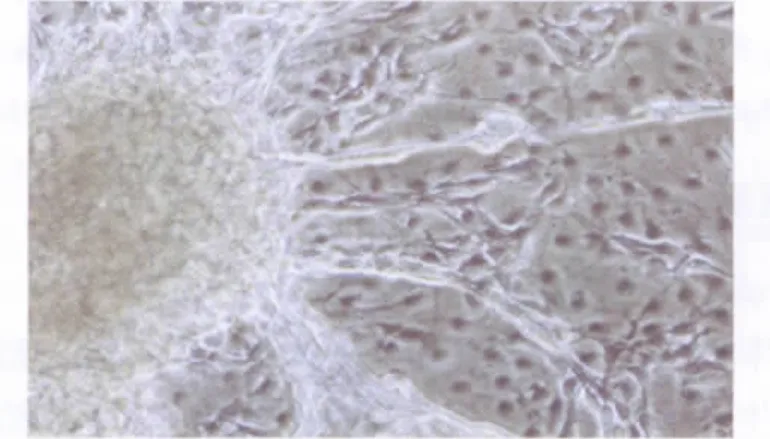
图4 拟胚体贴壁第3天,上皮样细胞及血管样结构出现(相差显微镜,100×)
2.3 免疫荧光检测
人ES细胞诱导分化的细胞,经Ⅷ因子免疫荧光检测呈阳性(图5),证明这类细胞具有内皮细胞性质。
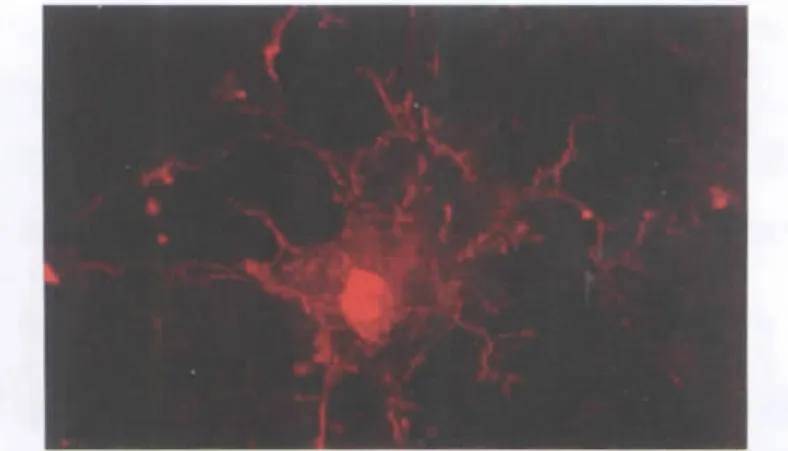
图5 人ES细胞诱导分化的管状结构Ⅷ因子表达阳性(40×)
2.4 Dil-Ac-LDL 标记检测
Dil-Ac-LDL摄取实验结果呈阳性,表现为红色荧光(图6),证明hES细胞定向诱导分化的细胞具有内皮细胞的功能。
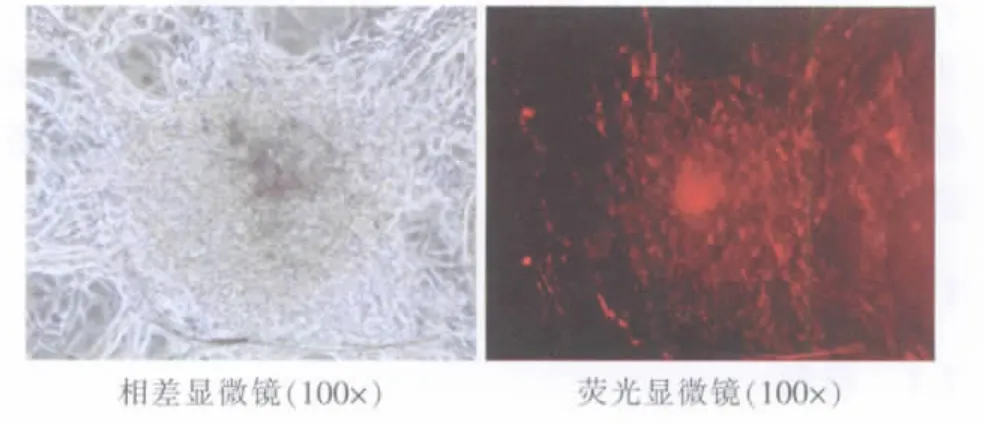
图6 Dil-Ac-LDL摄取实验阳性
2.5 扫描电镜观察
管状结构的管壁最初由许多圆形细胞和扁平状细胞组成,随着管状结构的延伸,细胞逐渐减少,管壁变得光滑(图7)。
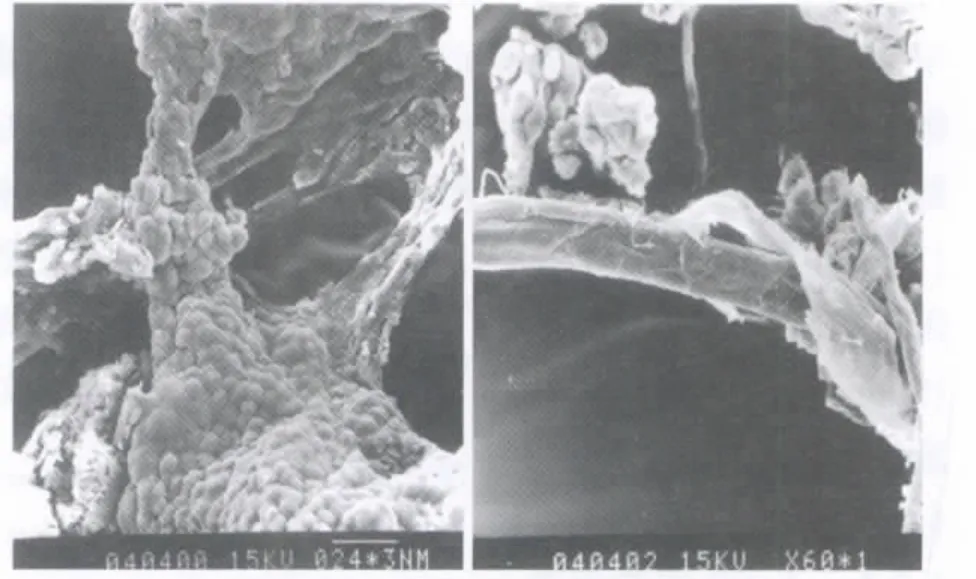
图7 扫描电镜观察
2.6 透射电镜观察
诱导出的血管样结构由几个内皮样细胞围成,细胞扁平,表面较光滑,相邻的细胞间连接紧密,与正常毛细血管结构非常相似(图8)。
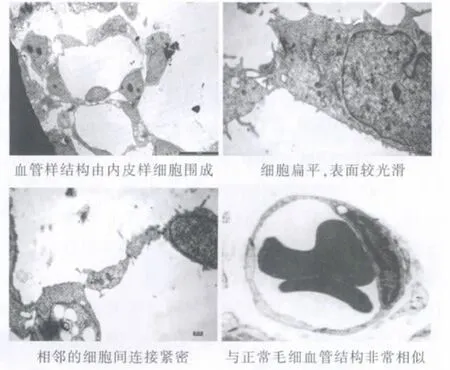
图8 透射电镜观察
3 讨论
血管形成是非常复杂的过程,主要涉及内皮细胞的激活和增殖、微环境中的细胞基质成分和结构,以及它们之间的相互作用[8]。同时,这些过程又和各种细胞因子的产生及协同作用是分不开的[9-10]。已有证据表明,TGF-β1是血管形成的刺激因子,在创伤愈合过程中,可能是通过调节细胞基质合成,从而影响内皮细胞的生长行为,使其形成管状结构[11-12]。另有研究认为,内皮细胞的增殖刺激或抑制效应依赖于 TGF-β1的浓度,0.02~0.1 ng/mL 的 TGF-β1 对胎牛心脏内皮细胞显示生长刺激作用,而高浓度(0.5~10 ng/mL)的 TGF-β1 则显示生长抑制作用[13],表明TGF-β1对内皮细胞生长和血管结构形成有着密切关系。
ES细胞不同的生长方式和所受RA浓度对其分化细胞类型有重大影响[14]。低浓度RA(1×10-9mol/L)和TGF-β1协同作用,易使ES细胞诱导形成中胚层性质的分化细胞[15]。本实验用悬浮培养法结合低浓度RA处理5 d,使人ES细胞形成EB,然后移至明胶包被的培养皿中,以含TGF-β1的培养液使其贴壁生长,数天后EB周围出现大量圆形细胞,同时形成许多自EB向周围辐射的血管样结构,该现象重复性高,表明低浓度RA和TGF-β1协同作用,对人ES分化并形成管样结构有重要作用。
vWF是一种存在于血浆中的大分子糖蛋白,是凝血因子Ⅷ的载体,主要由内皮细胞合成,可使血小板黏附并聚集在受损的血管壁。vWF被认为是内皮细胞的特异性标记[16]。DiI是一种亲脂性碳花青染料,容易嵌进生物质膜内,并在膜内做定向扩散运动,从而标记整个细胞。荧光染料DiI标记的低密度脂蛋白 (Low density lipoprotein,LDL), 即 Dil-LDL被广泛应用于内皮细胞的鉴定[2,17-18]。本实验中,vWF免疫荧光染色和Dil-LDL直接荧光检测结果均为阳性,表明构成管样结构的细胞具有内皮细胞性质。证明低浓度RA和TGF-β1可诱导人ES细胞分化为内皮细胞及血管样结构。
相差显微镜和扫描电镜观察证实,人ES细胞所分化的管状结构的管壁,最初由许多圆形细胞或扁平状细胞组成,随着管状结构的延伸,管壁变得光滑。该结果提示,本诱导体系作用于人ES细胞,可在体外模拟血管形成的演变过程。
透射电镜结果显示,诱导的血管样结构由扁平细胞围成,细胞表面较光滑,相邻细胞间有紧密连接,与正常的人毛细血管非常相似。
本实验提供了一个研究内皮细胞发生和血管形成的模型。但是,RA与TGF-β1的作用机制,以及ES细胞向血管演变中参与的因素等问题尚需进一步研究。另外,作为内皮细胞的来源之一,ES细胞分化为内皮细胞的研究还面临很多问题,如分化细胞的纯化,传代与大量扩增以及保存等,这些问题的解决,将能使ES细胞成为较好的种子细胞来源。
[1]Noden DM,Li X.The development of craniofacial blood vessels.//Reinber RN,Sherar GK,Auerbach R.Development of the vascular system[M].Basel:Karger,1991,1-24.
[2]Levenberg S,Golub JS,Amit M,et al.Endothelial cells derived from human embryonic stem cells[J].PNAS,2002,99(7):4391-4396.
[3]Levenberg S,Huang NF,Lavik E,et al.Differentiation of human embryonic stem cells on three-dimensional polymer scaffolds[J].PNAS,2003,100(22):12741-12746.
[4]Ferreira LS,Gerecht S,Fuller J,et al.Bioactive hydrogel scaffolds for controllable vascular differentiation of human embryonic stem cells[J].Biomaterials,2007,28(17):2706-2717.
[5]Krtolica A,Genbacev O,Escobedo C,et al.Disruption of apicalbasal polarity of human embryonic stem cells enhances hematoendothelial differentiation[J].Stem Cells,2007,25(9):2215-2223.
[6]Sepúlveda P,Martinez-León J,García-Verdugo JM,et al.Neoangiogenesis with endothelial precursors for the treatment of ischemia[J].Transplant Proc,2007,39(7):2089-2094.
[7]Adams B,Xiao Q,Xu Q.Stem cell therapy for vascular disease[J].Trends Cardiovasc Med,2007,17(7):246-251.
[8]Gajdusek CM,Luo Z,Mayberg MR.Basic fibrobl growth factor and transforming growth factor beta-1:synergistic mediators of angiogenesis in vitro[J].Cell Physiol,1993,157:133-149.
[9]Lagarkova MA,Volchkov PY,Philonenko ES.Efficient differentiation of hESCs into endothelial cells in vitro is secured by epigenetic changes[J].Cell Cycle,2008,7(18):2929-2935.
[10]Goumans MJ,van Zonneveld AJ,ten Dijke P.Transforming growth factor beta-induced endothelial-to-mesenchymal transition:a switch to cardiac fibrosis[J].Trends Cardiovasc Med,2008,18(8):293-298.
[11]Madri JA,Pratt BM,Tucker AM.Phenotypic modulation of endothelial cells by transforming growth factor-β depends upon the composition and organization of extracellular matrix[J].Cell Biol,1988,106:1375-1384.
[12]Roberts AB,Sporn MB,Assoian RK,et al.Transforming growth factor type β:Rapid induction of fibrosis and angiogenesis in vivo and stimulation of collagen formation in vitro[J].PNAS,1986,83:4167-4171.
[13]Myoken Y,Kan M,Sato GH,et al.Biofunctional effects of TGF-β on endothelial cell growth correlates with phenotypes of TGF-β binding sites[J].Exp Cell Res,1990,191:299-304.
[14]徐洁,丛笑倩,姚鑫.维生素A酸和双丁酰基环腺苷单磷酸对小鼠胚胎干细胞的诱导分化[J].实验生物学报,1991,24:355-367.
[15]Mummery CL,Slager HG,Inzen WV,et al.Regulation of growth and differentiation in early development:of mice and models[J].Reproductive Toxicity,1993,7:145-154.
[16]Hoyer LW.The factorⅧcomplex:Structure and function[J].Blood,1981,58:1-13.
[17]Takayuki Asahara,Toyoaki Murohara,Alison Sullivan,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Sci,1997,275(14):964-967.
[18]Wang R,Clark R,Bautch VL.Embryonic stem cell-derived cystic embryoid bodies form vascular channels:an in vitro model of blood vessel development[J].Development,1992,114:303-316.

