怎样做好正向间接血凝试验
邱立新,邱美珍,杜丽飞
(1.湖南省动物疫病预防控制中心,湖南长沙 410007;2.湖南省畜牧兽医研究所,湖南长沙 410131)
间接血凝试验(IHA)是上世纪60年代在我国发展起来的血清学诊断技术,是用已知血凝抗原致敏与免疫无关的惰性微粒表面(载体)检测未知血清抗体的试验,迄今仍在许多疫病诊断中广泛应用。林琳等研究表明应用猪瘟正向间接血凝法(IHA)与斑点酶联免疫吸附试验(dot-ELISA)以及猪瘟抗体免凝金标试纸条比较,对规模化养猪场138份不同阶段猪血清进行检测,三种方法检测抗体的阳性率结果接近。数十年来正向间接血凝试验技术不断完善,它具有简单、经济、快速、实用的特点在我国有很大的用户群,近年来,兰州兽医研究所生产的液体猪瘟和口蹄疫正向间接血凝试验的试剂用量在逐年加大,然而,实验结果受操作技术影响较大。为做好正向间接血凝试验,使各地的检验结果一致,减少误差,现就正向间接血凝试验谈一点看法,以抛砖引玉、共同探讨和提高。
1 实验器材的优化
本实验所使用的实验器材包括微量血凝板,微量振荡器,移液器和吸头,为保证实验的顺利进行,要选择质量有保障,稳定性好的器材。
1.1 微量血凝板
实验室经常使用的是有机玻璃材质110°底角的96孔V型微量血凝板,此板可以叠放,不占实验室台面,处理样品量较大时合适,但每次用完需要清洗。清洗方法:一般先用清水浸泡,然后马上用高压清水冲洗,洗净后用手甩干板子倒置于37℃温箱中烘干。用前要先检查血凝板孔底是否干净,如发现有透光性差一点的孔,可用酒精棉签擦净。除了有机玻璃板以外,还有一次性血凝板,不需清洗,也不用担心板子不干净影响结果,但不能叠放,测定少量样品适合。
1.2 微量振荡器
使用振荡器振荡时间不宜超过10秒钟,振荡强度不能太大,先从小到大,中等强度即可。多块板叠加后振荡时要用手压住最上一板,以防上下的振动造成孔中液体溅出而影响实验结果的准确性。如果实验室没有它,也可用手轻拍血凝板的边缘即可,现在一般用微量移液器(加样枪),加样后有一定的冲力,可以起到混匀的作用。
1.3 单、多道微量移液器
建议使用高质量的移液器,用定量移液器需要准备50微升和25微升两种。50微升的用来加稀释液和稀释血清,25微升的用来加血凝抗原。可调的移液器要选择与检测过程中加样量相近量程的移液器,吸取液体时动作要轻缓,防止溶液吸入过快,冲入移液器污染柱塞或造成堵塞漏气。一定要养成移液器用完后放在移液器架上的习惯,移液器如果掉到地下很容易损坏。用完后移液器用75%的酒精棉擦拭,并把刻度调到最大值。
1.4 吸嘴
高质量的吸嘴经过处理后可以重复使用。处理方法:吸嘴用完后浸泡在清水里,先用清水漂洗,用超声波清洗器处理10分钟,换水后用二层纱布包好,用洗衣机甩干,再用超声波清洗器处理10分钟,再用洗衣机甩干,高压消毒灭菌器中121℃,20分钟即可,去盖后任水分蒸发,或放37℃温箱中烘干。吸嘴用完后没有用清水浸泡的很难洗干净,不必重复使用。接触过高感染性材料的吸嘴要高温消毒后废弃。经过处理后的吸嘴如果尖头变弯,则质量不好,不要重复使用。
2 试剂的优化
2.1 抗原
液体正向血凝抗原摇匀后呈咖啡色,无块状物沉淀,静置后血球逐渐沉入瓶底。摇匀后能很快形成均匀混悬液的是好抗原,摇匀后仍有小块黑色沉淀物(血球团)的抗原建议不要使用。如果只做筛检看是否达到合格线,一瓶抗原可以检测30到50份血清。值得一提的是液体正向血凝抗原4~8℃保存,保存期3个月,不能冷冻保存。
2.2 对照血清
阴性对照血清呈淡黄色清亮液体,阳性对照血清微红或淡黄色略微混浊的液体。阴阳性对照血清可在-15℃到-20℃保存,有效期2年。
2.3 稀释液
稀释液无色透明,一般情况4~8℃保存。用前建议将稀释液放37℃温箱中半小时后摇匀再用较好。试剂不能放置太久,最好新进现用。
3 样品血清的优化
新分离血清尽快检测完,未检血清-20℃保存。冷冻血清待检时需融化,同时避免血清反复冻融影响检测结果。严重溶血、严重污染、腐败或有悬浮杂质的血清样品不宜检测,以免发生非特异性反应。
4 实验过程优化
正向血凝实验过程包括:加稀释液,稀释待检血清,稀释阳性阴性血清,加血凝抗原,震荡静置,结果判定。在试验中要注意以下的问题:
4.1 加稀释液
在血凝板上1~6排的1~9孔;第7排的1~4孔,第6孔;第8排的1~12孔各加稀释液50微升。
4.2 稀释待检血清
取1号待检血清50微升加入第1排第1孔,并将枪头插入孔底,混匀后,从该孔吸取50微升移入第2孔,混匀后从该孔吸取50微升移入第3孔,直至第9孔。此时第1排1~9孔待检血清的稀释度(稀释倍数) 依次为 1∶2、1∶4、1∶8……1∶256、1∶512。每个待检血清样品均按上述方法稀释。在稀释血清操作时注意不要产生很多气泡,每稀释一份血清要换吸嘴,每次试验要做阴阳性对照,最好也做二孔空白对照,即孔中加50微升稀释液后加25微升抗原。每次检测时阴性、阳性和稀释液对照只需各做一份。
4.3 稀释阴性对照血清
在血凝板上的第7排第1孔加阴性血清50微升,对倍稀释至第4孔。此时阴性血清的稀释倍数依次为 1∶2、1∶4、1∶8、1∶16。第 6 孔为稀释液对照孔。
4.4 稀释阳性对照血清
在血凝板上的第8排第1孔加阳性血清50微升,对倍稀释至第12孔。此时阳性血清的稀释倍数依次为 1∶2、1∶4、1∶8……1∶2048、1∶4096。
4.5 加血凝抗原
被检血清各孔、阴性对照各孔、阳性对照各孔、稀释液对照孔均各加血凝抗原25微升。血凝抗原用前要充分摇匀,瓶底应无血球沉淀。一次实验过程应选择同一批号的抗原,并先从稀释度高的孔加起,避免滴头和孔内的液体直接接触。
4.6 振荡混匀
将血凝板置于微量振荡器上振荡10秒钟,如无振荡器,用手轻轻摇匀即可。然后将血凝板放在白纸上观察各孔红血球是否混匀,以没有血球沉淀为合格。盖上玻板,室温下或37℃下静置2小时,判定结果,也可将板置冰箱中冷藏延至次日判定。
5 判定标准
将血凝板放在白纸上,先观察阴性对照血清1∶16孔和稀释液对照孔,均应无凝集(血球全部沉于孔底形成边缘整齐的小圆点),或仅出现“+”凝集(血球大部分沉于孔底,边缘稍有少量血球凝集)。
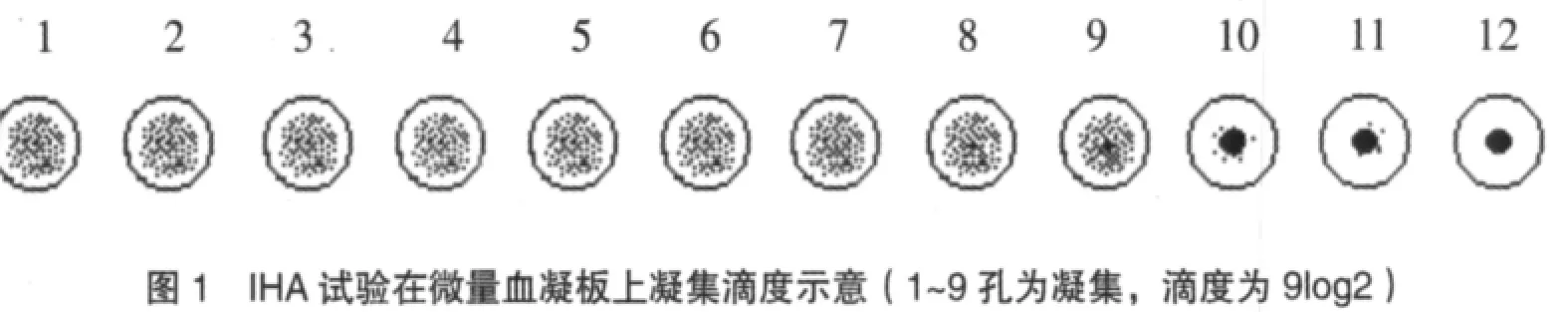
阳性对照血清1∶2到1∶256各孔(1~8孔)应出现“++”到“++++”凝集为合格(少量血球沉于孔底,大部分血球凝集)。如图1所示,该阳性血清滴度为1∶512倍或记为9log2。
在对照孔合格的前提下,观察待检血清各孔,以呈现“++”凝集的最大稀释倍数为该份血清的抗体效价。例如1号待检血清1~5 孔呈现“++”到“++++”凝集,6~7 孔呈现“++”凝集,第8孔呈现“+”凝集,第9孔不凝集,那么就可判定该份血清的抗体效价为1∶128,或者说7log2。接种口蹄疫和猪瘟疫苗的畜群免疫抗体效价达到1∶32(即 5log2;第 5孔)呈现“++”凝集为免疫合格。我们不少地方作抗体筛检时样品血清只稀释8个孔,加血凝抗原时只加第 3、4、5、6、7 孔,只要第5孔以上出现凝集的就判该血清为阳性,否则为阴性。这种方法可以大量减少试剂的用量。
6 值得探讨的问题
6.1 牛病毒性腹泻抗体干扰问题
鉴于有些场猪瘟间接血凝试验1∶32至1∶256倍凝集的样品与ELISA方法相比符合率不满意,不少学者提出了间接血凝方法虽然简单,但不能区分猪瘟抗体与牛病毒性腹泻抗体。在实验中如果遇到这种情况,建议采用猪瘟抗体单抗阻断ELISA方法进行检测,其结果更可靠些。
6.2 不同血凝板的孵育时间和判定
试剂盒要求使用110°底角的血凝板,但不少实验室仍在使用90°底角的血凝板。如果使用的是90°底角的血凝板,结果判断时会存在一定的差异,一般来讲结果会偏低一些。在判读结果的时间上,90°底角的血凝板判读结果在1.5~2小时,低于1小时会判断不准,多出现高判结果的现象。而110°底角的血凝板,判读结果时间应在2小时后为妥,冬天还可适当长一点,低于1.5小时会判断不准。使用90°底角的血凝板要注意掌握好判读结果的时间,也要注意样品凝集图形的梯度变化情况。如果前4个孔为100%凝集,标记为“#”或有的标记为“++++”,第5孔为成片、块状的凝集,不是均匀分布,也不是多数血球沉于孔底,这时结果可以结合第4孔为100%的情况,判终点为第5孔。如果判为第4孔则判严了。如果是110°底角的血凝板就不存在这种情况了。第4孔和第5孔的判断是这个试验的关键,判了第4孔则该份血清为阴性,判了第5孔则为阳性,阴阳之差往往就在这一下,不能不引起重视。 □
[1]秦进才,陆淼泉,罗安良.一种实用的钩端螺旋体病快速诊断方法-TR/Patoc玻片凝集试验[J].中华流行病学杂志,1989,10(特刊 3):271~274.
[2]吴子贵,刘宗恩.TR/PatocI型抗原玻凝法快速诊断钩端螺旋体病的研究[J].湖南微生物学通讯,1989,10(特刊3):275~277.
[3]Nakarin J,PradutKanchana S.Evaluation of enzyme-linked immunosorbent assay and indirect hemagglutination assay for detection of leptospiral antibody by using three different antigens[J].J Med Assoc Thai,2004,87(10):1218~1224.
[4]林琳,江斌,吴胜会,等.三种猪瘟抗体检测技术的应用比较[J].福建畜牧兽医,2004,6(3):23~24.
[5]Smits HL,van der Hoorn MA,Goris MG,et al.Simple latex agglutination assay for rapid serodiagnosis of human Leptospirosis[J].Clin Microbiol,2000,38(3):1272.

