低氧诱导因子-1基因在宫颈癌组织中的表达及意义
刘红娥 辜为为
低氧诱导因子-1基因在宫颈癌组织中的表达及意义
刘红娥 辜为为
目的研究HIF-1在宫颈癌组织、正常宫颈组织及宫颈良性病变组织中的表达,并与宫颈癌患者年龄、淋巴结转移与否、临床分期进行比较,探讨其与宫颈癌侵袭/转移的关系。方法应用逆转录聚合酶链式反应(RT-PCR)的方法检测56例宫颈癌组织、正常宫颈组织及20例宫颈良性病变组织中HIF-1 mRNA的表达情况,并应用相关统计学方法进行分析。结果HIF-1 mRNA在宫颈癌组织、正常宫颈组织及宫颈良性病变组织中的表达率分别为62.50%、41.07%、35.00%,宫颈癌与正常宫颈组织(P=0.023)、宫颈癌与宫颈良性病变组织(P=0.001)间的HIF-1αmRNA表达率差异有统计学意义,而正常宫颈组织与宫颈良性病变组织之间的HIF-1αmRNA表达率差异无统计学意义(P=0.091)。HIF-1 mRNA在不同临床分期(P=0.001)及淋巴结转移(P=0.002)中的表达率存在显著差异,但在不同年龄患者的癌组织中HIF-1 mRNA的表达率无差异(P>0.05)。结论HIF-1 mRNA在宫颈癌中的表达率明显高于正常宫颈组织及宫颈良性病变组织。HIF-1与宫颈癌临床分期密切相关,临床分期越晚,其肿瘤组织中HIF-1 mRNA的表达率越高。伴淋巴结转移宫颈癌HIF-1 mRNA表达率高于无淋巴结转移者。HIF-1 mRNA表达率与患者年龄无关。
宫颈癌;低氧诱导因子-1;逆转录聚合酶链式反应
宫颈癌侵袭转移是导致宫颈癌患者死亡的最主要原因。有研究提示低氧诱导因子-1(hypoxia induciblefactor-1,HIF-1)在恶性肿瘤的侵袭转移过程中扮演着十分重要的角色。本研究对HIF-1 mRNA在宫颈癌组织、正常宫颈组织及宫颈良性病变组织中的表达进行检测,并与宫颈癌患者年龄、淋巴结转移与否、临床分期进行比较,探讨其与宫颈癌侵袭转移的关系。
1 材料与方法
1.1 标本来源 标本均来自我院2005年4月至2008年10月期间住院手术切除的宫颈癌、正常宫颈组织及宫颈良性病变组织共132例。其中宫颈良性病变组织20例(宫颈糜烂12例、宫颈息肉4例、宫颈肥大4例)、乳腺癌组织(病理证实为鳞状细胞浸润癌及宫颈腺癌)及正常宫颈组织(因子宫肌瘤行子宫全切患者)各56例。根据2000年国际妇产科联盟(FIGO)宫颈癌分期,0期6例,Ⅰ期31例,II 14例,Ⅲ期5例;伴淋巴结转移36例,无淋巴结转移20例;全部患者术前均未行任何抗癌治疗。所有患者均为女性,宫颈癌患者平均年龄47岁(19~78岁);宫颈良性病变患者平均年龄32岁(22~41岁)。
1.2 RNA提取 按Trizol试剂盒说明书提取组织总RNA:取100 mg冻存的组织标本,加入lml Trizol试剂研磨至浆液,室温静置5 min。加入0.2 ml氯仿快速剧烈摇15 s,室温静置2~3 min,于4℃12000 r/min离心15 min。将上层移至另一EP管中,加入0.2 ml异丙醇和0.2 mlRNA沉淀液,轻柔混匀,室温静置10 min,4℃离心12000 r/min离心10 min,弃上清。用冰冷的75%乙醇lml洗RNA沉淀1~2次,于4℃7500r/min离心 5 min;弃上清,室温凉干5~10 min,溶于40μlDEPC水中。RNA的定量与鉴定,取2 μl RNA用DEPC处理水稀释250倍,混匀后用大型多功能分光光度计测其260 nm、280 nm处的吸光值,计算A260/A280比值及RNA含量。RNA样本用琼脂糖凝胶电泳鉴定。
1.3 逆转录反应 在20 μl的反应体系中加入5×reaction buffer4 μl,oligo(dT)18 Primer(0.5 μg/μl)1 μl,RiboLock TM Ribonuclease inhibitor(20 U/μl)1 μl,10 mM dNTP 2 μl,总RNA2 μg,逆转录酶 M-MLV1 μl,DEPC 水补齐至 20 μl,42℃孵育60 min(逆转录),72℃孵育10 min以终止反应,于冰上降温(灭活逆转录酶)。
1.4 PCR反应 扩增HIF-1基因的引物序列,上游引物:AGAAACCACCTATGACCTGC,下游引物:GTCGTGCTGAATAATACCACTC,扩增产物长度410bp,β-actin为内参照,上游引物:CAACTTCATCCACGTTCACC,下 游 引 物:GAAGAGCCAAGGACAGGTAC,扩增产物长度268bp。25μl的反应体积中加入 cDNA2 μl,LOX 上、下游引物各 1μl,PCR Master Mix12.5μl,去离子水8.5μl混匀后,置于 PCR 仪中,反应条件:95℃预变性10 min 后,95℃30 s,61℃30 s,72℃30 s,40 个循环,最后72℃ 延伸10 min。
1.5 PCR产物鉴定 用1.0%琼脂糖凝胶将提取的RNA进行电泳,在紫外线灯下观察。
1.6 统计分析 计数资料采用χ2检验及四表格确切概率法,采用SPSS 13.0软件进行统计学处理。
2 结果
2.1 HIF-1 mRNA在宫颈癌、正常宫颈组织及宫颈良性病变组织中的表达 HIF-1 mRNA在宫颈癌组织中的表达率为62.50%,而在正常宫颈组织和宫颈良性病变组织中的表达率分别为41.07%、35.00%(图1、图2、图3)。经统计学分析,宫颈癌与正常宫颈组织(P=0.023)、宫颈癌与宫颈良性病变组织(P=0.001)间的HIF-1 mRNA表达率差异有统计学意义,而正常宫颈组织与宫颈良性病变组织之间的HIF-1 mRNA表达率差异无统计学意义(P=0.091)。见表1。
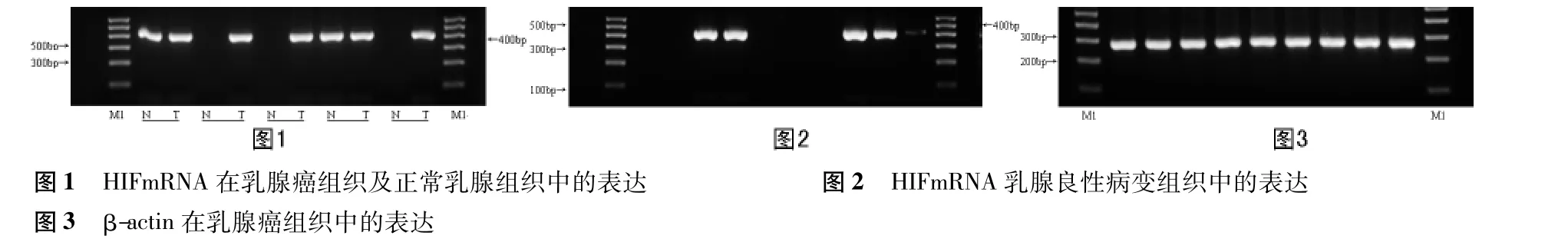
2.2 HIF-1 mRNA与临床病理特征的关系 0、Ⅰ、Ⅱ、Ⅲ期乳腺癌 HIF-1 mRNA表达率分别为 50.00%、41.93%、100.00%、100.00%,统计学分析,Ⅱ、Ⅲ期乳腺癌HIF-1 mRNA的表达率明显高于0、Ⅰ期(P=0.001);伴淋巴结转移宫颈癌HIF-1 mRNA表达率为77.77%,明显高于无淋巴结转移的35.00%(P=0.002);在19~50岁、>50岁的患者中,HIF-1 mRNA的表达率分别为60.00%、66.66%,差异无统计学意义(P>0.05)。见表2。
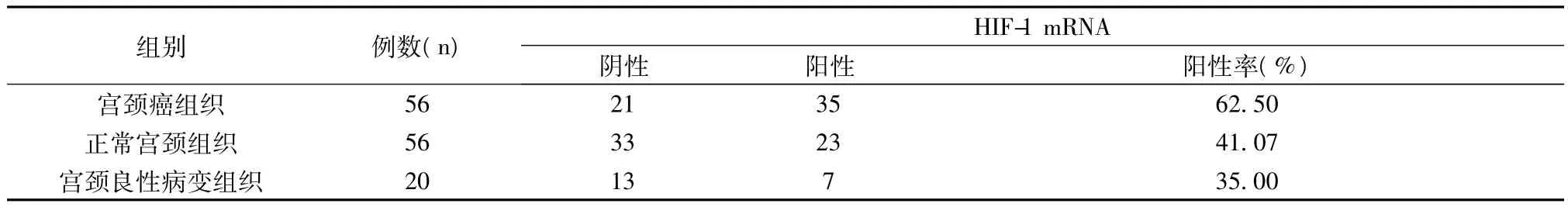
表1 HIF-1 mRNA在宫颈癌、正常宫颈组织及良性病变组织中的表达
表2 HIF-1 mRNA与临床病理特征的关系
3 讨论
HIF-l基因定位于人类染色体14q21-q24,属于bHLH-pas蛋白家族,由120kD的α亚基(HIF-1α)和91/93/94kD的β亚基(HIF-1β)组成。HIF-1α是唯一的氧调节亚单位,通过泛素、蛋白酶体途径降解,缺氧降低泛素化或通过突变阻断泛素化而增加HIF-1α的表达[1]。缺氧条件下,由于降解通路被阻断,HIF-1α迅速与HIF-1β聚合形成有活性的HIF-1二聚体,通过激活其下游靶基因的转录实现其生理学效应[2]。HIF-l与靶基因中的HIF-1结合点结合,促进其转录,引起一系列细胞对缺氧的反应[3]。HIF-1在肿瘤中的生物学功能有促进糖酵解;促进新生血管生成;参与肿瘤细胞的增殖、诱导肿瘤细胞的凋亡;参与红细胞生成及铁代谢[4]。
在本研究中,HIF-1 mRNA在正常宫颈组织及宫颈良性病变组织的表达率分别为41.07%、35.00%,且差异均无统计学意义,提示HIF在宫颈良性病变的发生中作用并不十分明显。而在宫颈癌中HIFmRNA高达58.92%,高于正常宫颈组织及良性病变组织,表明HIF-1的过度表达与宫颈癌的发生有关。HIF-1在不同临床分期患者中的表达不完全相同,Ⅱ期、Ⅲ期宫颈癌患者癌组织中的表达率较0期、Ⅰ期患者升高。该实验结果反映出HIF-1 mRNA表达的变化趋势,即随着宫颈癌病情的进展,HIF-1 mRNA的表达率呈上升趋势。在伴有淋巴结转移的患者中HIF-1 mRNA的表达率明显高于无淋巴结转移患者,提示HIF可能与宫颈癌发生淋巴结转移有关。目前公认肿瘤组织中氧含量的降低是促进肿瘤转移的主要原因之一,这也可能是HIF-1参与肿瘤侵袭转移的主要原因[5]。而HIF-1 mRNA在不同年龄组的宫颈癌患者中的表达率在统计学上无显著差异(P>0.05),表明HIF-1与患者年龄无关。
以上研究表明HIF-1 mRNA在宫颈癌中的表达率明显高于正常宫颈组织及宫颈良性病变组织。HIF-1 mRNA与宫颈癌临床分期密切相关,临床分期越晚,其肿瘤组织中HIF-1 mRNA的表达率越高。伴淋巴结转移宫颈癌HIF-1 mRNA表达率高于无淋巴结转移者。HIF-1 mRNA表达率与患者年龄无关。
[1]Post DE,van Meir EG.A novel hypoxia-inducible factor(HIF)activated oncolytic adenovirus for cancer therapy. Oncogene,2003,22:2065-2072.
[2]Semenza GL.HIF-l:mediator of physiological and pathophysiological responses to hypoxia.Appl Physiol,2000,88:1474-1480.
[3]Isaacs JS,Jung YL,Neckers L.Aryl hydrocarbon nuclear translocator(ARNT)promotes oxygen-independent stabilization of hypoxia inducible factor-l alpha by modulating an Hsp90-dependent regulatory pathway.Biol Chem,2004,279:16128-16135.
[4]Yeo EJ,Chun YS,Cho YS,et al.YC-1:apotential anticancer drug Targeting hypoxia-inducible factor 1.J Nail Cancer Inst,2003,95:516-525.
[5]Liu SC,Minton NP,Giaccia AJ,et al.Antican cer eficacy of systemically delivered anaerobic bacteria as gene therapy vectors targeting tumor hypoxia/necrosis.Gene Ther,2002,9:291-296.
Expression of Hypoxia induciblefactor-1 Gene in cervical cancer and its clinical significance
Objective To study the expression of HIF-1 in human cervical cancer and explore the relationship between HIF-1expression and clinical pathological features(patient’s age,limph node metastasis,clinical stage,).MethodsThe expression of HIF-1 mRNA in 56 cases of human cervical cancer tissues,normal cervical tissues and 20 cases of cervical benign lesion tissues was detected by reverse transcriptase polymerase chainreaction(RT-PCR).ResultsThe expression rate of HIF-1 mRNA in cervical cancer,normal cervical tissues and cervical benign lesion tissue were 62.50%、41.07%、35.00% ,statistical difference was found among cervical carcinoma group,normal cervical tissues group and benign lesion group.The expression of HIF-1 mRNA were associated with clinical stage(P=0.001)and lymph node metastasis(P=0.002),but had no correlation with age and tumor size(P>0.05).ConclusionHIF-1 mRNA expression is increased in cervical cancer tumor tissues compared with normal tissues and cervical benign lesion tissue,HIF-1 is relevant with the occurrence of cervical cancer.The cervical cancer cells proliferation capacity is increase,degree of malignancy is higher and facilitates metastasis occurred which HIF-1 is expressed.
Cervical cancer,HIF-1,RT-PCR
510730广州开发区医院妇产科

