海南产虾蟹壳制取甲壳素的工艺研究
时 杰,刘平怀,刘洋洋,杨 勋,欧阳全林
(海南大学 海南优势资源化工材料应用技术教育部重点实验室,海南 海口 570228)
海南产虾蟹壳制取甲壳素的工艺研究
时 杰,刘平怀*,刘洋洋,杨 勋,欧阳全林
(海南大学 海南优势资源化工材料应用技术教育部重点实验室,海南 海口 570228)
研究酸碱法从海南产虾蟹壳中制取高纯度甲壳素的工艺条件.以甲壳素产品质量为评价指标,通过正交试验确定了最优制备工艺为:废弃虾蟹壳原料经预处理后依次以1.5mol/L盐酸溶液浸泡6 h、质量分数2%NaOH溶液浸泡24 h、质量分数10%过氧化氢溶液浸泡2 h,干燥得成品.结果,采用此工艺制取的甲壳素的质量指标为水分含量5.32%、灰分含量0.34%、氮含量5.98%、甲壳素含量93.7%,达到食品级标准.
虾壳;蟹壳;甲壳素;功能性食品
甲壳素作为机能性健康食品,对人体具有强化免疫、抑制老化、预防疾病、促进疾病痊愈和调节生理机能等五大功能.甲壳素与人体细胞有很强的亲和性,可被体内的酶分解而吸收,对人体无毒性和副作用,加上良好的吸湿性、纺丝性和成膜性,因而广泛地被开发成优良的生物医学、药学材料[1-2];此外,甲壳素还是一种新型的化工材料和环保材料[3-4].
海南具有丰富的海洋生物资源,又地处热带地区,一年四季产虾蟹等甲壳类生物.《海南省海洋经济发展规划》中明确提出海南2010年海水虾蟹养殖产量要达到19万吨.虾和蟹都具有一层几丁质外壳,虾蟹加工或食用后产生的甲壳类常常当作废弃物处理,按40%废弃物计算,海南每年要产生8万吨以上的甲壳类废弃物.长期以来,如此大量的虾蟹等海产甲壳动物废弃物得不到有效的利用,宾馆酒楼每天都有大量的虾蟹壳废弃,特别在沿海一些渔村,有时虾壳蟹壳等废弃物堆积如山,臭气熏天.这不仅严重污染了环境,而且浪费了资源.作者利用虾蟹壳废弃物生产高质量甲壳素,变废为宝,在经济和环保方面有着重要意义.
1 材料与方法
1.1 仪器、试剂与材料
UDK-142全自动凯氏定氮仪(意大利VELP公司);T27傅里叶红外光谱仪(德国Bruker公司);UV2450紫外光谱仪(日本岛津公司);DHG-9071A电热鼓风干燥箱(上海精宏实验设备有限公司);SX2-5-12箱式电阻炉(上海博讯实业有限公司).
盐酸、NaOH为工业级;过氧化氢溶液、硫酸、间苯二酚、甲基红、溴甲酚绿等均为国产分析纯,氨基己糖盐酸盐(安徽天启化工科技有限公司),甲壳素(上海如吉生物发展有限公司,批号090328,为食品级).
虾蟹壳,从市场收集.
1.2 工艺流程
虾蟹壳→预处理(清水洗净,干燥后粉碎)→稀盐酸脱钙→海水洗至中性→清水冲洗→稀NaOH溶液脱蛋白→海水洗至中性→清水冲洗→过氧化氢溶液脱色→清水冲洗→低温烘干→甲壳素产品.
1.3 甲壳素制取工艺优化
1.3.1 脱钙工艺优化
50 g预处理后的虾蟹壳与2 L酸液混合进行脱钙处理.以虾蟹壳脱钙后的灰分含量为指标,对影响其脱钙效果的盐酸浓度、酸浸时间两个因素分别进行单因素试验.盐酸浓度取0.5mol/L、1.0 mol/L、1.5mol/L、2.0 mol/L四个水平,酸浸时间取4 h、6 h、8 h、16 h四个水平.试验重复3次,取平均值.
1.3.2 脱蛋白工艺优化
以脱钙及脱蛋白后干燥产物的氮含量为指标,对影响脱蛋白效果的NaOH质量分数进行单因素试验.50g脱钙后的虾蟹壳与1.5L碱液混合,浸泡24 h.NaOH质量分数取2%、5%、8%、11%四个水平.试验重复三次,取平均值.
1.3.3 脱色工艺优化
以甲壳素产品的色泽为指标,对影响脱色效果的过氧化氢质量分数进行单因素试验.50g脱钙、脱蛋白后的虾蟹壳与1 L过氧化氢溶液混合,浸泡2 h.过氧化氢质量分数取5%、10%、20%、30%四个水平.试验重复3次,取平均值.
1.3.4 正交试验
通过SAS统计分析软件对单因素实验结果进行分析,根据甲壳素产品的灰分含量、氮含量和色泽三个指标确定综合评分,以该综合评分为指标对影响甲壳素产品质量的盐酸浓度、酸浸时间、NaOH质量分数和过氧化氢质量分数四个因素进行正交实验.试验重复3次,取平均值.
1.4 产品理化指标和相关参数的检测与计算
根据中华人民共和国水产行业标准(SC/T3403-2004),对成品甲壳素的水分、灰分及氮含量等主要质量指标进行检测[5].采用 GB/T 5009.3-2003直接干燥法测定水分含量;GB/T 5009.4-2003干法灰化法测定灰分含量;GB/T 5009.5-2003凯氏定氮法测定氮含量.
实验所得甲壳素产品与市售食品级甲壳素分别进行红外及紫外光谱检测,从而比较两者甲壳素含量.
1.5 统计分析
采用SAS(STATISTICAL ANALYSIS SYSTEM)8.0统计软件进行数据处理,用ANOVA过程T-检测法做多重比较,进行盐酸浓度和酸浸时间双因素的方差分析,确定灰分对甲壳素产品质量的显著性水平;用ANOVA过程T-检验法做多重比较,分别进行NaOH和过氧化氢质量分数的单因素方差分析,确定各工艺参数对甲壳素产品质量的显著性水平;正交试验以GLM过程做总模型方差分析,最后选择较优提取条件.
2 结果与分析
2.1 甲壳素制取工艺优化结果
2.1.1 单因素实验
甲壳素工艺单因素实验结果见表1.
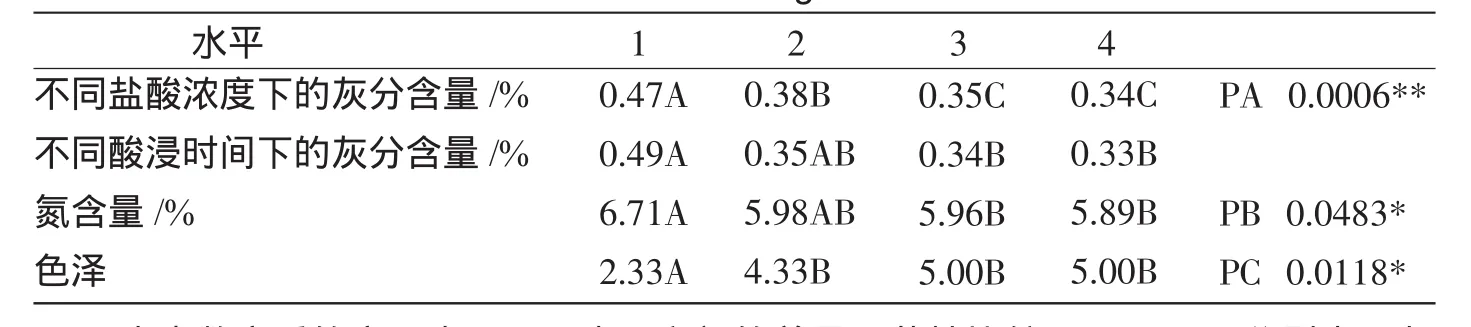
表1 甲壳素工艺单因素实验结果Tab.1 Results of single factor test
由表1可知,盐酸浓度越高脱钙效果越好,浓度大于1.5mol/L后去钙效果无显著提高,同时考虑到盐酸浓度的增大会促进甲壳素主链降解,故选择1.5mol/L.酸浸时间越长脱钙效果越佳,超过6 h后去钙效果无显著提高,故选择6 h.NaOH质量分数越高,洗脱蛋白质的效果越好,超过5%后除蛋白效果无显著性差异,蛋白质的水解已经接近平衡,故选择5%.过氧化氢质量分数越高脱色效果越佳,质量分数为10%时所得甲壳素产品色泽最好,故选择10%.
2.1.2 正交实验
由甲壳素产品灰分含量、氮含量和色泽三个指标对甲壳素产品进行综合评分,评分公式见式(1).其中,灰分和氮含量分数分别为将甲壳素产品的灰分和氮含量值折合至1.000~7.000分所得,色泽分数为目测对甲壳素产品的色泽在1~7分的区间内打分.该公式综合灰分含量、氮含量和色泽三个指标,用三指标P值中的最小值与三指标P值的比值决定对应指标分数在综合分数中的比例,P值越小则该指标分数所占的比例越大.这样可以突出差异显著性大的指标在综合分数中的作用,所得出的综合分数更合理地体现各因素对甲壳素产品质量的影响.最后,以该综合评分为指标对提取过程中影响甲壳素产品质量的盐酸浓度、酸浸时间、NaOH质量分数和过氧化氢质量分数四个因素进行正交实验,正交实验方案及结果见表2.

由表2级差分析可以看出,影响综合评分的因素主次顺序为:盐酸浓度、酸浸时间、过氧化氢质量分数、NaOH质量分数;最佳组合是A4B4D2C1.利用SAS统计软件分析同因素不同水平之间的差异显著性比较结果显示,A3与A4之间差异不显著,但考虑到工业成本及高浓度酸液能导致甲壳素降解,故选择A3;B2与B4之间的差异也不显著,为了缩短生产时间选择B2.综上所述,得出A3B2D2C1为最佳工艺参数,即盐酸浓度1.5 mol/L、酸浸时间6 h、质量分数2%NaOH溶液浸泡24 h、质量分数10%过氧化氢溶液浸泡2 h.在此最佳工艺条件下所得甲壳素产品根据式(2)计算产率为22.25%.

表2 甲壳素工艺正交实验方案及结果Tab.2 Experimental arrangement and test results

2.2 产品质量指标检测结果
2.2.1 质量指标检测
甲壳素质量指标测定结果以及与食品级标准比较情况见表3.

表3 虾蟹甲壳素与食品级甲壳素质量指标的比较Tab.3 Comparison of quality indicators in chitin extracted froMshrimp and crab shell and food grade chitin
2.2.2 红外光谱检测
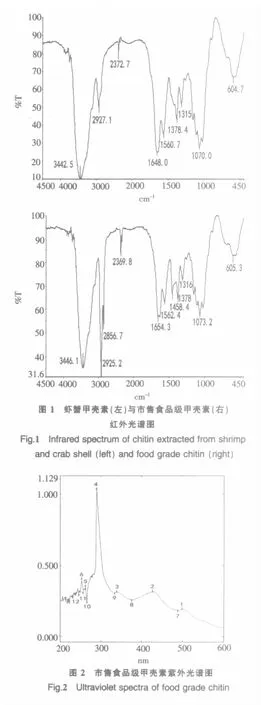
图1中,1 070.0为C-O伸缩振动,1 316.8为酰胺Ⅲ谱带和CH2摇摆,1 378.4为CH弯曲的不对称C2变形,1 458.4为CH2弯曲CH2摇摆,1 560.7为酰胺Ⅱ谱带,1 648.0为酰胺Ⅰ谱带,2 856.7为CH2不对称伸缩,2 927.1为不对称CH3伸缩和不对称CH2伸缩,3 442.2为O-H伸缩,可以看出两图基本一致,其在1 316.8、1 560.7、1 648.0处出峰的差异说明两种样品脱乙酰度略有不同.
2.2.3 紫外光谱检测
按照高英立的方法[6]测定虾蟹甲壳素和市售食品级甲壳素中甲壳素含量.对食品级甲壳素进行紫外吸收光谱扫描如图2得出甲壳素在427 nm处有最大吸收峰,故选择427 nm为检测波长.绘制氨基己糖标准曲线,回归方程y=5.075+177.867x,R2=0.9988.测定虾蟹甲壳素和市售食品级甲壳素供试液的OD值.经计算,市售食品级甲壳素和虾蟹甲壳素中甲壳素含量分别为91.3%和93.7%,虾蟹甲壳素纯度略高于市售食品级甲壳素.
由以上测定结果可以看出,虾蟹壳制取的甲壳素达到水产行业标准SC/T3403-2004的食品级标准.
3 结论
制取甲壳素的最佳工艺条件为:自然温度下废弃虾蟹壳原料依次以1.5mol/L盐酸溶液浸泡6 h、质量分数2%NaOH溶液浸泡24h、质量分数10%过氧化氢溶液浸泡2 h.在此条件下的甲壳素产率为22.25%,采用此工艺制取的甲壳素的质量指标为水分含量 5.32%、灰分含量 0.34%、氮含量5.98%、甲壳素含量93.7%达到食品级标准.
[1]Pillai C K S,Paul W,Sharma C P.Chitin and chitosan polymers:CheMistry,solubility and fiber formation[J]. Progressin Polymer Science.,2009,34(7):641-678.
[2]Ashish Dev,Jithin C.Mohan,Sreeja V,et al.Novel carboxymethyl chitin nanoparticles for cancer drug delivery applications[J].Carbohydrate Polymers.,2010,79(4):1073-1079.
[3]Jayakumar R,Tamura H.Synthesis characterization and thermal properties of chitin-g-poly(-caprolactone)copolymersby using chitin gel[J].International Journal of Biological Macromolecules.2008,43(1):32-36.
[4]Shinsuke Ifuku,Masaya Nogi,MasafuMi Yoshioka,et al. Fibrillation of dried chitin into 10-20 nMnanofibers by a simple grinding method under acidic conditions[J].Carbohydrate Polymers,2010,8(1):134-139.
[5]中华人民共和国农业部.中华人民共和国水产行业标准甲壳质与壳聚糖[S].中国,2005.
[6]高英立,肖蓬,俞长兴,等.甲壳素类化合物含量测定初探[J].分析化学,2001(10):1235.
责任编辑:毕和平
Study on Extraction Technology of Chitin froMLocal Shrimp and Crab Shell
SHI Jie,LIU Pinghuai*,LIU Yangyang,YANG Xun,OUYANG Quanlin
(Ministry of Education Key Laboratory of Application Technology of Hainan Superior Resources Chemical Materials,Hainnan University,Haikou 570228,China)
The extraction conditions of chitin froMshrimp and crab shell were optimized by orthogonal test.The optimal conditions are as follows:The shell was soaked in a 1.5 mol/L HCL solution for 6 hours.The sample is then soaked in 2%NaOH for 24 hours.Then it was soaked in 10%H2O2for 2 hours.The extracted chitin's quality indicators were as follows:moisture content as 5.32%,ash content as 0.34%,nitrogen content as 5.98%,chitin content as 93.7%.It meets the demands of food grade on quality index.
shrimp shell;crab shell;Chitin;functional food
TS 202.3
A
1674-4942(2010)03-0295-05
2010-04-02
海南省重点科技计划项目(080130)
*通讯作者

