急性肾缺血再灌注大鼠肾细胞游离钙水平与细胞凋亡的研究
赵 军,张文岚,孙 玲
(吉林大学第一医院器官移植中心暨泌尿外二科,吉林长春 130021)
急性肾缺血再灌注大鼠肾细胞游离钙水平与细胞凋亡的研究
赵 军,张文岚*,孙 玲
(吉林大学第一医院器官移植中心暨泌尿外二科,吉林长春 130021)
目的观察缺血再灌注损伤对肾细胞游离钙([Ca2+]i)水平和细胞凋亡的影响。方法采用摘除左肾,钳夹大鼠右侧肾蒂,建立急性缺血再灌注肾损伤模型,应用Fura-2/AM荧光指示剂测定缺血再灌注大鼠肾细胞[Ca2+]i水平,流式细胞术检测肾细胞凋亡率。结果缺血再灌注不同时期肾细胞呈现不同程度Ca2+超载,与对照组相比差异显著(P<0.01);肾细胞凋亡率增高,与对照组相比差异显著(P<0.05、P<0.01),有正相关趋势。结论缺血再灌注不同时期肾细胞游离钙([Ca2+]i)水平增高,并与肾细胞凋亡率有正相关趋势,再灌注时间与肾细胞Ca2+超载呈正相关,提示再灌注损伤在加重细胞钙超载同时增加了肾组织细胞凋亡,可能是再灌注损伤肾功能障碍的重要原因。
缺血再灌注;肾组织;细胞钙超载;细胞凋亡
(Chin J Lab Diagn,2010,14:0999)
急性缺血再灌注损伤是公认的移植肾重要的致病因子,不但与移植肾功能延迟恢复的发生密切相关,而且也与肾移植术后急性和慢性排斥反应的发生和进展密切相关[1]。研究显示,肾缺血再灌注损伤机制涉及诸多因素,其中细胞内钙代谢紊乱、细胞内信号传导障碍及细胞膜性结构改变及细胞凋亡是造成肾脏损伤的重要环节。本实验拟就缺血再灌注不同时期肾细胞内钙含量([Ca2+]i)和肾细胞凋亡水平进行研究,为探讨缺血再灌注损伤的发生机制提供实验依据。
1 材料与方法
1.1 实验动物及主要试剂
1.1.1 动物分组 实验动物系吉林大学白求恩医学实验动物部提供,为封闭群动物。取雄性(避免雌激素对缺血的调节作用)Wistar大鼠30只,体重200-250 g。随机分为假手术对照组(Ⅰ组)、缺血1 h组(Ⅱ组)、再灌注1 h组(Ⅲ组)、再灌注2 h组(Ⅳ组)和再灌注24 h组(Ⅴ组)。
1.1.2 试剂 Fura-2/AM购自Calbiochem公司。
1.2 实验方法
1.2.1 手术方法及取材 将Wistar大鼠在20%乌拉坦(按1 g◦kg-1,iv)麻醉下进行手术。腹中线切口,左肾静脉穿刺取血,摘除左肾,以避免健侧的代偿作用。分离右肾动脉、静脉,以无创性动静脉夹夹闭右肾动静脉,1 h后去夹恢复灌流,静脉补给生理盐水20 ml。Ⅰ组:单纯切除左肾,分离右肾动脉、静脉,不进行夹闭右肾动静脉手术。夹闭肾动脉1 h,急性缺血(再灌注损伤阴性对照组,Ⅱ组),分别于夹闭肾动脉1 h时去除动静脉夹,恢复血流再灌注1 h(Ⅲ组)、2 h(Ⅳ组)和24 h(Ⅴ组)取右肾,同时留取血液做肾功能检测。肾上极组织做光镜和电镜检查,其余肾组织按实验要求处理。
1.2.2 肾细胞游离钙浓度([Ca2+]i)测定[2]用荧光标记探针Fura-2/AM标记Ca2+,荧光分光光度仪(日本,F4010型)检测。
1.2.3 细胞凋亡率检测 采用流式细胞仪(美国Coulter公司ILIT-Ⅱ型)检测。
1.2.4 统计学方法 全部实验数据采用SPSS 8.0统计软件,统计数据用±s表示,组间分析采用方差分析和q检验。相关分析采用直线相关分析法。
2 结果
2.1 缺血再灌注肾组织病理改变 肉眼观肾组织在急性缺血及再灌注后肾皮髓质微白并有轻度肿胀,余未见明显大体改变。①光镜下病理改变:急性缺血及再灌注1小时组即可见肾小管上皮细胞发生肿胀、变性;再灌注2小时和24小时组见肾小管上皮细胞肿胀加剧,小管腔变窄,并出现上皮细胞坏死,肾小球基底膜增厚(图1A、B)②电镜结果:急性缺血再灌注肾组织出现系列损伤性变化,近曲肾小管发生变性、小管腔表面微绒毛减少或消失、甚至发生溶解坏死;内质网脱颗粒扩张呈空泡状、线粒体肿胀畸形、嵴断裂;膜性细胞器发生髓样变性;微血管腔明显缩小或内皮细胞溶解;肾小球三层膜明显增厚,足突融合或消失等改变,对照组肾组织细胞超微结构未见异常改变(见图2A-D)。
2.2 缺血再灌注后肾功能 急性缺血再灌注损伤后肾脏功能有不同程度改变,本项实验以血清Cr和BUN水平作为评价肾功能的检测指标。见表1。
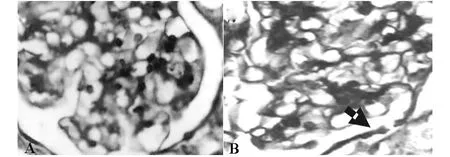
图1 A:正常对照组肾小球400×1;B:缺血再灌注2 h组肾小球基底膜增厚400×
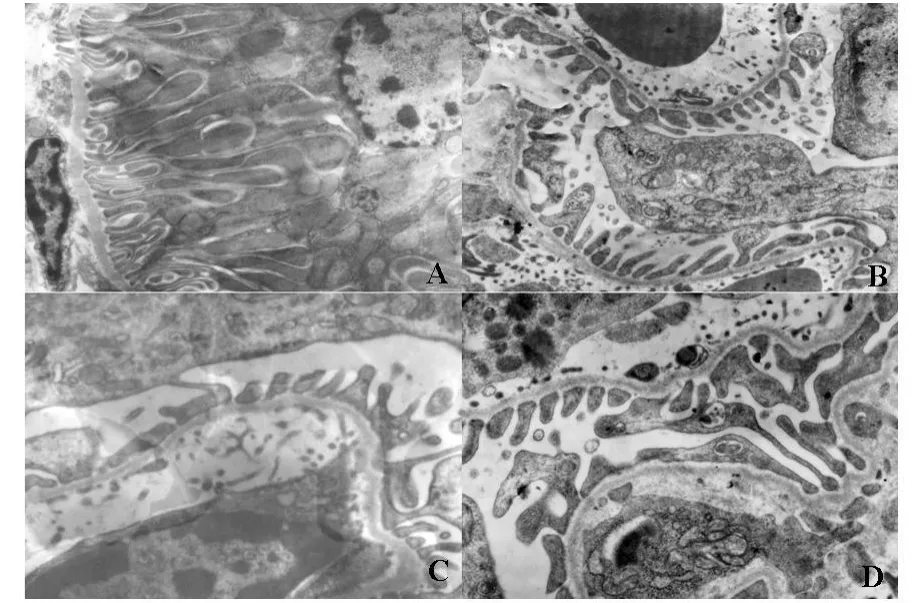
图2 A:再灌注阴性对照组肾小管(TEM×7 500);B:再灌注2 h肾小管(TEM×10 000)C:再灌注阴性对照组肾小球(TEM×12 000);D:再灌注2 h肾小球(TEM×12 000)
表1 肾缺血再灌注前后各组肾功能变化(±s)
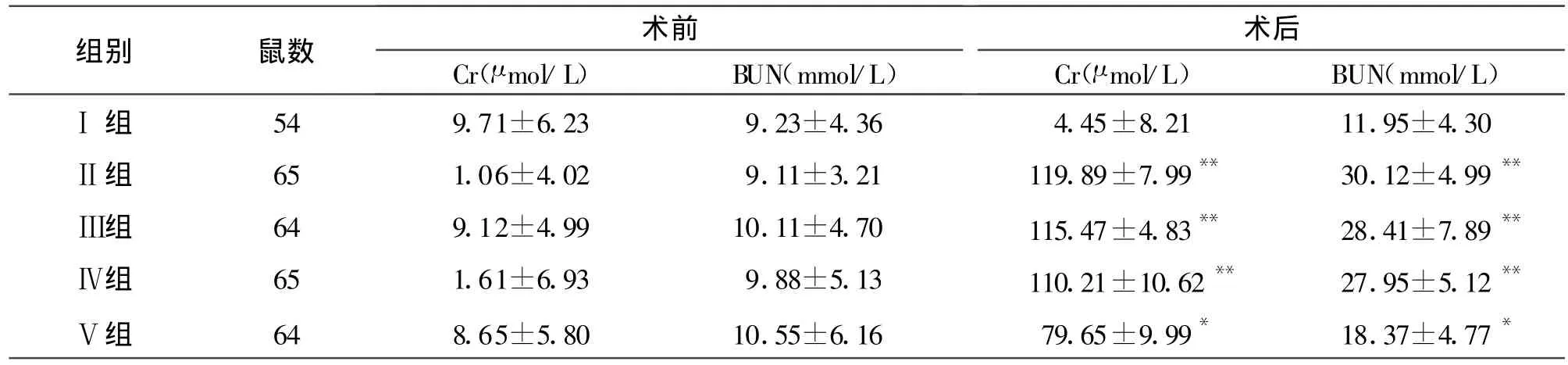
表1 肾缺血再灌注前后各组肾功能变化(±s)
注:实验组与Ⅰ组比较 **P<0.01,*P<0.05
组别 鼠数 术前 术后Cr(μ mol/L) BUN(mmol/L)Cr(μ mol/L) BUN(mmol/L)Ⅰ组 54 9.71±6.23 9.23±4.36 4.45±8.21 11.95±4.30Ⅱ组 65 1.06±4.02 9.11±3.21 119.89±7.99** 30.12±4.99**Ⅲ组 64 9.12±4.99 10.11±4.70 115.47±4.83** 28.41±7.89**Ⅳ组 65 1.61±6.93 9.88±5.13 110.21±10.62** 27.95±5.12**Ⅴ组 64 8.65±5.80 10.55±6.16 79.65±9.99* 18.37±4.77*
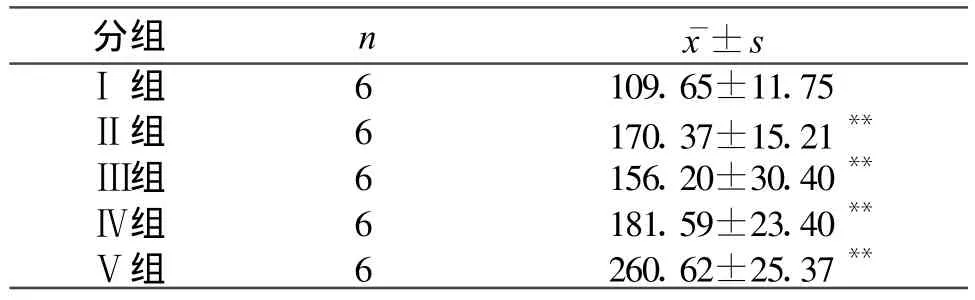
表2 大鼠肾细胞内[Ca2+]i水平(单位:nmol/L)
2.3 急性缺血及再灌注对肾细胞[Ca2+]i的影响应用荧光分光光度仪检测急性缺血及再灌注损伤肾细胞[Ca2+]i均明显增高,尤以再灌注24 h组最为显著(见表2)。
2.4 肾组织细胞凋亡水平 流式细胞仪检测细胞凋亡率(表3),在再灌注各组均可见明显的凋亡峰(见图3),表明再灌注损伤直接造成以细胞凋亡为主的细胞DNA分子水平的病理改变。
表3 急性缺血再灌注损伤大鼠肾细胞凋亡率(±s)
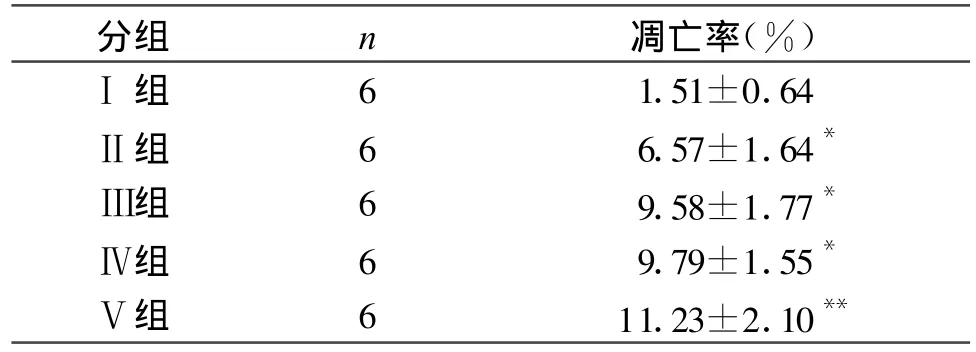
表3 急性缺血再灌注损伤大鼠肾细胞凋亡率(±s)
与对照组Ⅰ组比较*P<0.05,**P<0.01
分组 n 凋亡率(%)Ⅰ组 6 1.51±0.64Ⅱ组 6 6.57±1.64*Ⅲ组 6 9.58±1.77*Ⅳ组 6 9.79±1.55*Ⅴ组 6 11.23±2.10**

图3 流式细胞术检测肾细胞凋亡
2.5 肾损伤程度与细胞凋亡相关性 本研究中细胞凋亡率与肾功能损伤正相关(r=0.69),揭示缺血再灌注损伤中肾功能难以恢复的与细胞凋亡过多有关。
3 讨论
新近的研究证实,缺血再灌注损时细胞钙超载Ca2+通过钙离子依赖钙调蛋白蛋白激酶 II(CaMKII)参与细胞凋亡与坏死的调节[3]。再灌流早期(1 h-2 h),脂膜Ca2+-ATPase活性有所恢复,细胞内钙与缺血期相比略有降低,表明钙外排增多,但仍高于正常对照组。再灌注晚期细胞和细胞器膜性结构损害加重,泵功能进一步降低和细胞内钙池(内脂网、线粒体等)Ca2+释放进入细胞浆,另外,组织液中的Ca2+可通过细胞膜受损部位进入细胞内,而使细胞内[Ca2+]i进一步升高,进而加重肾损害。胞浆Ca2+超载可引起细胞凋亡,凋亡中DNA降解片段现象与内源性Ca2+/Mg2+依赖性核酸内切酶活性增高相一致[4]。在细胞凋亡时亦出现快速持续的Ca2+浓度上升,同时Ca2+可以直接作用于核内转录因子,引起和加重细胞凋亡的发生。细胞Ca2+超载是细胞凋亡发生的原因,亦是细胞凋亡发生的结果,细胞Ca2+超载激活Ca2+依赖性核酸限制性内切酶,将核DNA裂解成 180-200 bp的片段,造成细胞凋亡[5]。缺血再灌注损伤可引起机体组织细胞Ca2+超载,细胞Ca2+超载一方面与组织抗氧化能力降低和脂质过氧化物增多引起的细胞膜钙通道开放有关[6],另一方面也诱导了组织细胞的凋亡。用钙离子拮抗剂可以明显减弱细胞凋亡的超微结构改变、减轻缺血再灌注肾损伤,也证明了[Ca2+]i与缺血再灌注损伤时细胞的凋亡的发生密切相关[7]。肾移植早期血液复流后同样存在缺血再灌注问题[1],尸肾移植时,供肾冷缺血时间与细胞凋亡和缺血再灌注损伤呈正相关[8],本研究从一个侧面反映了移植早期的病理损伤机制与肾组织细胞Ca2+超载和细胞凋亡的发生有关。
本研究结果表明,肾缺血再灌注不同时期肾组织细胞存在钙代谢紊乱、细胞内Ca2+超载和不同程度的肾细胞凋亡,再灌注时间与肾细胞内Ca2+超载呈正相关,并且与细胞凋亡率有正相关趋势,提示再灌注损伤在细胞超微结构水平和信息转导系统中通过不同机制加重细胞钙超载和细胞凋亡。
[1]Lario S,Mendes D,BescosM,et al.Expression of transforming growth factor-beta1 and hypoxia-inducible factor-1alpha in an experimental model of kidney transplantation[J].Transplantation,2003,75(10):1647.
[2]方福德,周 吕,丁 濂,等.现代医学实验技巧全书(下册)[M].北京医科大学中国协和医科大学联合出版社,1995:220-225.
[3]Salas MA,Valverde CA,Sánchez G,et al.The signalling pathway of CaMKII-mediated apoptosis and necrosis in the ischemia/reperfusion injury[J].J Mol Cell Cardiol,2010,48(6):1298.
[4]Marciniak SJ,Ron D.Endoplasmic reticulum stress signaling in disease[J].Physiol Rev,2006,86(4):1133.
[5]Boulares AH,Ren T.Mechanism of Acetaminophen-Induced Apoptosis in Cultured Cells:Roles of Caspase-3,DNA Fragmentation Factor,and the Ca2+and Mg2+Endonuclease DNAS1L3[J].Pharmacol Toxicol,2004,94(1):19.
[6]傅耀文,张文岚,薛立娟,等.缺血再灌注对肾细胞内钙水平与细胞凋亡的影响[J].中华泌尿外科杂志.2004,25(12):834.
[7]Li Z,Nickkholgh A,Yi X,et al.Melatonin protects kidney grafts from ischemia/reperfusion injury through inhibition of NF-kB and apoptosis after experimental kidney transplantation[J].J Pineal Res,2009,46(4):365.
[8]Zhang GX,Kimura S,Murao K,et al.Inhibition of cytochrome c release by 10-N-nonyl acridine orange,a cardiolipin-specific dye,during myocardial ischemia-reperfusion in the rat[J].Am J Physiol Heart Circ Physiol,2010,298(2):H433.
Studies of both intracellular ionized calcium level and apoptosis during acute renal ischemic reperfusion injury
ZHAOJun,ZHANGWen-lan,SUN Ling,et al.(The Department of Urology,Organ Transplantation Center the First Hospital,Jilin University,Changchun130021,China)
ObjectiveEffects of renal ischemic reperfusion injury on intracellular inonized calcium level and apoptosis are observerd.MethodsThe model of rat's acute renal ischemic reperfusion injury was established by both cutting the left kidney and occlusing right kidney pedicle.The renal intracellular[Ca2+]i level and the renal cell apoptosis were measured by using Fura-2/AM fluorescence assay and flow cytometry respectivly.ResultsCompared with the control group,renal intracellular[Ca2+]i level increased significantely(P<0.01)and apoptosis rate increased significantely(P<0.05,P<0.01)at different periods of ischemic reperfusion.ConclusionAt different periods of rat's acute renal ischemic reperfusion injury,renal intracellular[Ca2+]I rises and becomes postive relationship with the apoptosis rate.There is positive relevent between the reperfusion time and renal intracellular[Ca2+]i overloading.Thismay be important reason of renal disfunction due to reperfusion injury.
ischemic reperfusion;intracellular ionized calcium;renal tissue;apoptosis
R692
A
1007-4287(2010)07-0999-03
*通讯作者
2009-02-25)

