转化生长因子-β1在大肠癌中的表达及其临床意义
转化生长因子-β1在大肠癌中的表达及其临床意义
张 梁1,邓益斌1,邓巧莹1,黄永秩2
(右江民族医学院附属医院 1 .检验科;2.病理科,广西 百 色533000)
转化生长因子-β1(TGF-β1)是一类功能复杂的多肽类细胞因子,构成一个多功能的细胞因子超家族,体内几乎所有细胞都能产生并存在其受体。TGF-β1是其成员之一,有资料表明TGF-β1在肿瘤发生、发展及转移过程中起着重要作用[2-4],但TGF-β1由抑癌作用转变成促癌作用的机制尚未十分清楚。因此,本文通过对大肠癌TGF-β1的表达进行研究,探讨TGF-β1在大肠癌诊疗中的临床应用价值。
1 材料与方法
1.1 材料 2005年8月-2008年8月在我院住院手术的62例大肠癌患者为病例组,男48例,女14例,年龄43-81岁,其中结肠癌40例,结肠腺癌22例,对照组为大肠癌患者自身癌旁正常组织,兔抗人TGF-β1一抗及即用型非生物素免疫组化ElivisionTM super试剂盒(福州生物技术开发有限公司)。
1.2 方法 所有标本均经过10%福尔马林固定,常规石蜡包埋,4 μ m厚连续切片,切片经二甲苯脱蜡和梯度酒精水化,蒸馏水洗,经柠檬酸盐高温修复,冷却后用PBS冲洗3次,每次3 min,滴加过氧化酶阻断溶液,室温下孵育10 min,PBS冲洗3次,每次3 min,分别滴加一抗(浓度1∶100;兔抗人TGF-β1),37℃孵育10 min,PBS冲洗3次,每次 3 min,加多聚酶结合物(试剂B)37℃孵育10 min,PBS冲洗3次,每次3 min,DAB室温显色3-5 min,自来水冲洗,苏木素复染,经梯度酒精脱水,二甲苯透明后中性树脂封片,光镜下观察,阴性对照以PBS代替-抗,阳性对照为已知阳性切片。
1.3 染色结果判定 TGF-β1主要位于细胞浆内,部分位于细胞膜上。细胞内具有棕黄色或黄褐色颗粒者为阳性。每例随机观察5个视野,每个视野100个细胞,计数500个细胞中染色细胞阳性数。阴性(-):阳性细胞数<20%或无阳性细胞,与背景颜色一致;阳性(+):阳性细胞数 20%-70%;强阳性(++):阳性细胞数>70%。
1.4 统计学处理 使用统计学软件SPSS13.0进行统计学处理分析,采用 χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1在大肠癌及自身癌旁正常结肠组织中的表达比较 免疫组织化学染色后,两组结果见表1。两组数据比较有显著性意义(P<0.05)。
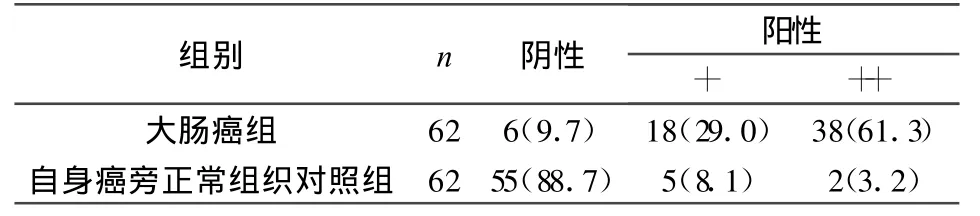
表1 TGF-β1在大肠癌及癌旁正常结肠组织中的表达比较(%)
2.2 TGF-β1表达与淋巴结转移关系 在50例淋巴结转移组中,TGF-β1表达见表2。两组比较有显著性意义(P<0.05)。
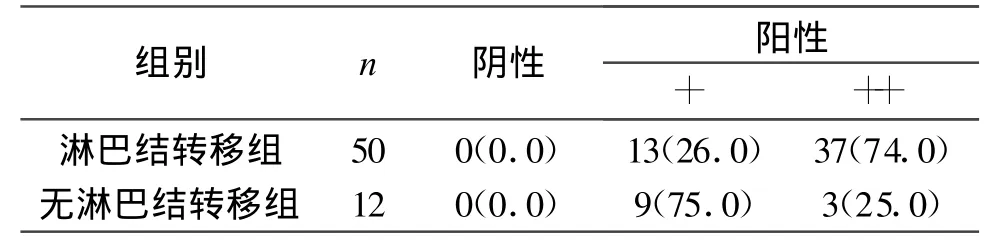
表2 TGF-β1表达与淋巴结转移关系
3 讨论
TGF-β1在胚胎生长发育、细胞分化、增殖及凋亡的调节中发挥重要作用,同时参与细胞外基质的分泌和发育分化等多种生理过程。TGF-β1与肿瘤的发生,肿瘤细胞的浸润及转移有密切关系,并在不同阶段所起的作用不同。在肿瘤的早期阶段,TGF-β1在细胞生长及分化过程中起重要的调节因子作用,可诱导肿瘤细胞凋亡。随着肿瘤的进程,生长环境的变化,TGF-β1成为肿瘤细胞生长、浸润、转移及血管新生的重要刺激因子。有资料表明,TGF-β1随着肿瘤恶性度的增高而表达增加,其作为一个判断肿瘤预后的不良指标[5-8]。随着大肠癌浸润深度的增加,癌组织可以自分泌大量的TGF-β1与自身表面受体结合,从而促进癌组织细胞生长、浸润、转移;并可能通过旁分泌作用发挥其他功能,如诱导新生血管形成,促进细胞外基质合成,抑制机体免疫反应等,为癌组织提供了一个适宜的微环境,从而加速了癌细胞的生长及转移[5-6],本研究结果显示,大肠癌组TGF-β1阳性表达率90.3%,明显高于正常结肠组织组11.3%(P<0.05)。淋巴结转移组的TGF-β1表达强度显著高于无淋巴结转移组(P<0.05),提示TGF-β1可作为反映肠肿瘤侵袭性的参考指标。
有研究认为,TGF-β1具有抑制正常细胞转化为肿瘤细胞的功能,是抑癌基因[7,8]。在本研究中,我们检测到癌旁正常结肠组织,腺瘤组织中TGF-β1仅有微弱表达,而在癌组织中有明显表达。TGF-β1在正常细胞转化为肿瘤细胞的过程中,由于机体的免疫监视机制使TGF-β1大量分泌以阻止正常细胞转化为肿瘤细胞,但肿瘤细胞上TGF-β1受体表达缺失或功能丧失,瘤细胞逃逸TGF-β1的生长抑制作用而周围正常细胞生长被TGF-β1抑制,减少癌细胞增殖的空间限制,为癌细胞的生长创造良好环境[5-8]。肿瘤细胞的无限生长是肿瘤转移的前提。TGF-β1在淋巴结转移组的高阳性率表明了其在肿瘤发生,发展及转移中的复杂作用;推测检测原发肿瘤标本中TGF-β1的水平有可能反映整个肿瘤的一般转移特性。由于TGF-β1在不同组织类型中作用变化很大,故大肠癌与TGF-β1的关系值得进一步探讨。
[1]Shion S R,singh A B,Moorthy K,et al.Smad4 regulates elaudirr 1 expression in a transforming growth factorbeta independent manner in colon cancer cells[J].Cancer Res,2007,67(4):1571.
[2]王 勇,许建明.转化生长因子β1-Smad信号通路与结肠癌研究进展[J].中华肿瘤防治杂志,2008,15(13):1036.
[3]张佩怡,禹 晶,王燕颖,等,TGF-β1和MPO在结肠肿瘤中的表达及意义[J].胃肠病学和肝病学杂志,2008,17(4):297.
[4]于金海,所 剑.转化生长因子TGF-β1和Smad4在老年结肠癌中的表达[J].中国老年学杂志,2008,28(20):2022.
[5]李志刚.转化生长因子β1信号传导与结直肠癌[J].中国普通外科杂志,2007,16(4):372.
[6]王燕颖,孙丽芳,陈学英,等.TGF-β1与P53在结肠肿瘤中的表达及意义[J].临床消化病杂志,2008,20(4):230.
[7]Jung B,Smith E J,Doetolero R T,et al.Influence of target gene mutations on survival,stage and histology in sporadic microsatellite unstable colon cancers[J].Int J Cancer,2006,118(10):2509.
[8]Munoz N M,u PTON m,Rojas A,et al,Transforming grouth factor beta type 11 inactivation induces the malignant transformation of intestinal neplasms in iniated bu A pc mutation[J].Cancer Res,2006,66(20):9837.
1007-4287(2010)09-1468-02
2009-11-28)

