饲料中硒的测定—氢化物发生原子荧光光谱法
杜英秋,廖 辉,马永华,陈国友,苏 萍,单 宏
(黑龙江省农业科学院农产品质量检验中心,哈尔滨 150086)
硒是动物成长所必须的重要微量元素之一,它存在于肝、肾、肌肉和肌体的所有细胞中,硒的缺乏会导致畜禽机体功能异常和死亡,也会影响动物的繁殖过程[1-5]。饲料是畜禽硒的良好来源,而饲料中硒的含量主要受地区土壤影响,我国2/3以上地区属于缺硒地区,这些地区的配合饲料中硒含量比较低,在这些缺硒和严重缺硒的地区几乎所有动物饲料中都添加硒[6-8]。由于动物对硒的需要量和中毒量相差不大,硒的过量同样会对动物机体造成不良影响,甚至毒害作用。因此,为了防止硒缺乏症的发生,同时又防止硒过量,各国都对畜禽饲料的含硒量做了规定,准确控制动物硒的摄入量[9]。测定硒的常用方法有荧光法、原子吸收法和比色法等,荧光法虽然准确但繁琐,并且所用试剂DAN毒性大且需进口;原子吸收法、火焰法灵敏度低,石墨炉法有严重的基体干扰;比色法虽然简便但灵敏度低[10]。目前,农业部行业标准中尚无饲料中硒的测定方法,国标方法中测定硒采用的是荧光法[11-13]。本文利用原子荧光光谱法测定饲料中硒的含量,灵敏度高,检出限低,可以准确的测得饲料中硒的含量,为饲料中硒的添加提供可靠的数据保障。
1 材料与方法
1.1 仪器
AFS-230E双道原子荧光光度计(北京海光仪器公司);硒空心阴极灯(北京有色金属研究总院);可调式电热板,所用的玻璃仪器需用25%的硝酸浸泡过夜,用超纯水清洗干净。
1.2 试剂
硒标准储备液:1 000 μg·mL-1(国家标准物质中心);硒标准工作液:将硒标准储备液用10%HCl逐级稀释至 0.25 μg·mL-1;硼氢化钾溶液(15 g·L-1):称取硼氢化钾7.5 g溶于5 g·L-1的氢氧化钾中,定容至500 mL;硝酸、高氯酸、盐酸均为优级纯试剂;铁氰化钾溶液(100 g·L-1):称取铁氰化钾10.0 g溶于水后定容至100 mL,临用前现配;标准物质:GBW0010(大米)、GBW0018(鸡肉);试验所用水均为超纯水。
1.3 方法
1.3.1 样品前处理
①配合饲料、浓缩饲料、单一饲料:称取试样1.0 g(精确至0.0001 g)于250 mL锥形瓶中,加入硝酸10 mL,锥形瓶上放上小漏斗用于消煮试样时起回流作用,放置过夜。次日,进行低温(本试验电热板电压为170 V)消煮,硒为挥发元素,温度过高会导致硒的损失。当消煮体积减少到5 mL左右,取下稍冷,向其中加入2.5 mL高氯酸,继续低温加热,先是产生棕色烟,继续加热冒白烟,消化液为无色透明或是浅色近透明,液体体积剩余2 mL左右,取下稍冷,然后向其中加入5 mL浓度为6 mol·L-1的盐酸,继续低温加热,至剩余2 mL左右时取下,冷却,转移至25 mL容量瓶中,再向容量瓶中加入2.5 mL铁氰化钾,2.5 mL浓盐酸,定容,混匀待测。
②高含量硒样品、预混饲料:这些样品中硒的含量比较高,很多样品的硒含量达到2 mg·kg-1以上,所以样品必须经过稀释后才可以测定。具体如下,样品消煮部分同①至加入5 mL浓度为6 mol·L-1的盐酸后继续低温加热,至剩余2 mL左右时取下,冷却。然后将消解液转移至25 mL容量瓶中直接定容。定容后根据样品中硒的含量进行稀释,根据稀释的体积向其中加入盐酸和铁氰化钾溶液,保证稀释液中盐酸的浓度为10%,摇匀待测。
③以石粉为载体的预混料:称取试样1.0 g(精确至0.0001 g)于250 mL锥形瓶中,加入硝酸15 mL(加入硝酸时,先逐滴加入,至不再产生气泡后,再将剩余硝酸加入,否则硝酸与其中的石粉载体反应过于剧烈),放置过夜,接下来的步骤同①。
1.3.2 标准系列的配制
吸取硒标准工作溶液,加入浓盐酸2.5 mL,铁氰化钾(100 g·L-1)溶液 2.5 mL,用纯水定容至25 mL,配制成含硒为0.0、2.0、5.0、10.0、20.0、50.0 ng·mL-1的标准系列,标准曲线最好现用现配,如放置时间过长会使测定结果偏高。放置30 min后测定。
1.3.3 仪器参考条件
结果见表1。
1.3.4 测定
光度计开机后按仪器参考条件进行设定,预热30 min后,依次测定标准系列、样品空白和样品部分。
1.3.5 检出限与线性范围
在给定的仪器工作条件下,对空白溶液与试验用标准溶液交替测定12次,进行仪器检出限测定,结果见表2。
检出限的测定[12]:检出限(ng·mL-1)=C×3б/A
其中,C-试验溶液的浓度;б-12次测定空白溶液荧光强度值的标准偏差;A-试验溶液的平均荧光强度值。计算得出硒的检出限为0.02 ng·mL-1,饲料称取1.0000 g,定容至25 mL,得到样品的最低检出限为 0.5 μg·kg-1。

表1 仪器条件Table 1 Condition of instrument
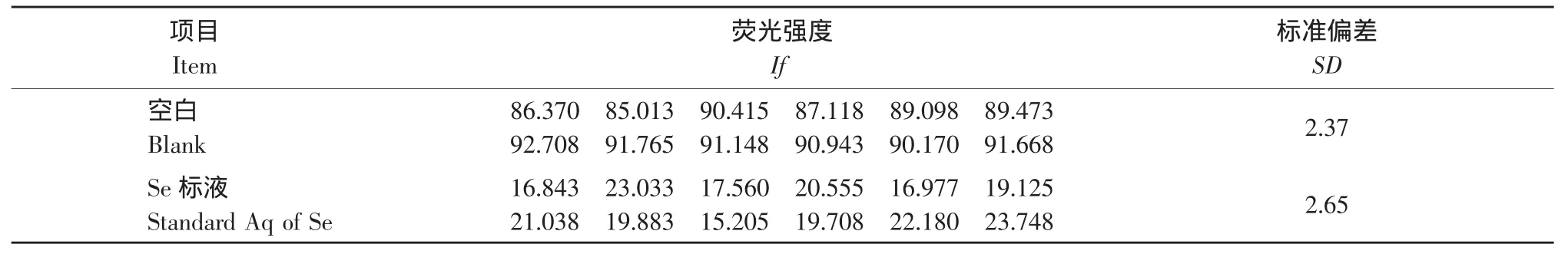
表2 检出限数据Table 2 Data of detection limit
在仪器给定的工作条件下,对标准系列测定的If值以及回归方程见表3。
从表3数据可知,标准曲线在0~50 ng·mL-1内,相关系数达到0.9999,曲线线性良好。

表3 标准曲线Table 3 Standard curve
2 结果与分析
2.1 干扰及其消除方法
Al、Fe、Ca、Mg、Na、 K、Ti及 Cl-、F-、NO3-、SO42-、PO43-不干扰硒的测定。在 4 mol·L-1HCl酸度、Fe3+的加入量为 8 mg·L-1时,0.1 g·mL-1Se,下列元素在如下浓度不干扰测定:Ni 2 000 μg·mL-1、Cu 400 μg·mL-1、Pb 1 500 μg·mL-1、As 100 μg·mL-1、Sb 140 μg·mL-1、Bi 70 μg·mL-1、Sn 140 μg·mL-1、Ge 19 μg·mL-1、Hg 15 μg·mL-1、Te 0.5 μg·mL-1、Ag 0.2 μg·mL-1、Au 0.2 μg·mL-1、Pd 0.2 μg·mL-1。氢化物发生原子吸收法中观察到Sn对Se测定有严重干扰,而氢化物原子荧光法中未发现。对于基体成分复杂,而Se的含量较低的样品,可采用萃取,巯基棉吸附,离子交换等分离富集方法来消除干扰。
2.2 硼氢化钾溶液浓度的选择
作为预还原剂硼氢化钾的浓度选择很重要,对不同浓度0.5%、1.5%、3.0%、4.0%的硼氢化钾溶液进行试验,结果见表4。
对于预还原剂硼氰化钾,如果浓度太低,还原能力弱,灵敏度低,浓度过高时,标液荧光强度增加,但是空白也随着增加,而且产生的大量氢气会对样品的测定产生气体干扰。最后选择1.5%为最适宜的硼氰化钾浓度,在此浓度下,所测得的曲线见表3,线性好,曲线各点的If值可以满足试验需要。
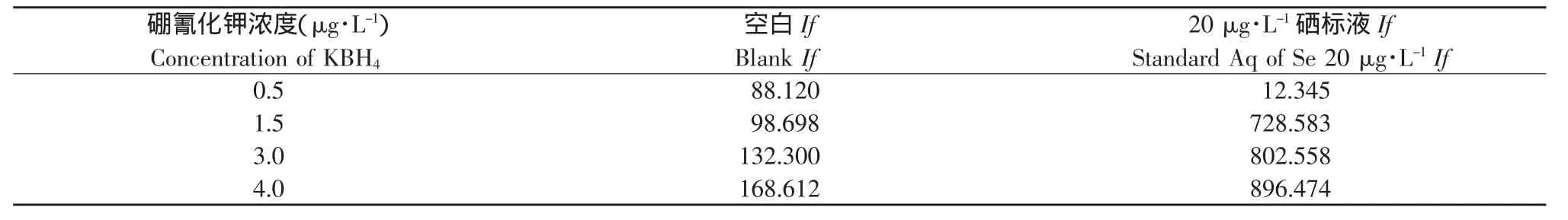
表4 硼氢化钾溶液浓度的选择Table 4 Choice of the concentration of KBH4
2.3 载流介质及载流浓度的选择
在样品的前处理部分,加入6 mol·L-1的盐酸,将消化液转移至容量瓶,加入的也是盐酸,为了减少酸种类不同造成的系统误差,载流的选择为盐酸。对于载流浓度的选择,本试验选择了5%、10%、20%、30%的盐酸溶液分别为载流进行试验,结果见表5。
从表5可知,随着载流浓度的变化,If值没有明显变化。经过消化和定容后的样品中酸度约为10%,为了减少仪器由于酸度不同造成的系统误差,选择浓度为10%的盐酸溶液为载流是最合适的。
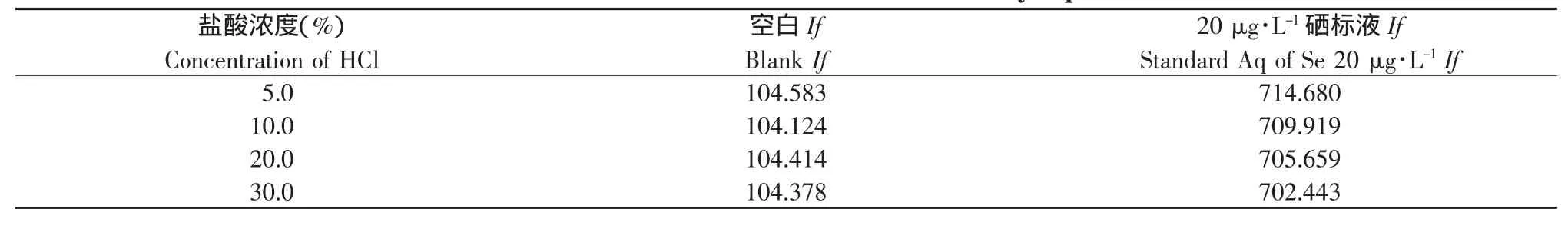
表5 载流浓度的选择Table 5 Choice of the concentration of carry liquid
2.4 测定结果
按照本试验测定方法,对饲料样品进行5次平行消化处理、测定,结果的精密度、重复性、准确性和根据稳健统计对可疑值的判断结果见表6。
相对标准偏差(Relative Standard Deviation,RSD),也称变异系数(Coefficient of Variation,CV)。试验分析时,常用RSD表示精密度,它是表示测量的再现性,是保证准确度的先决条件。从检测数据可知,分别对饲料1、饲料2检测的5组数据,RSD分别为3.12%和2.08%,说明此方法下,对样品进行检测,随机误差小,检测数据再现性高,这是检测数据准确的前提保证。
本试验中,以国家标准物质GBW0010和GB W0018作为质控样,它们的标准值分别为0.061±0.015、0.49±0.06(mg·kg-1),从表7可知检测结果均处于标准值的允许范围之内,完全符合规定,且RSD较小,数值之间的重复性高,即做到了精确又做到了准确。
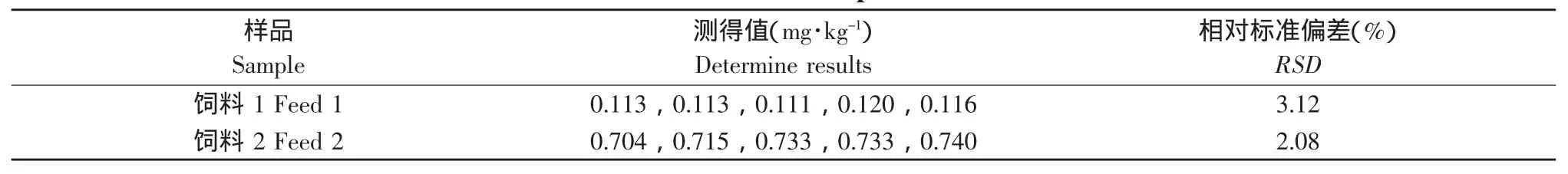
表6 精密度试验Table 6 Test of the precision
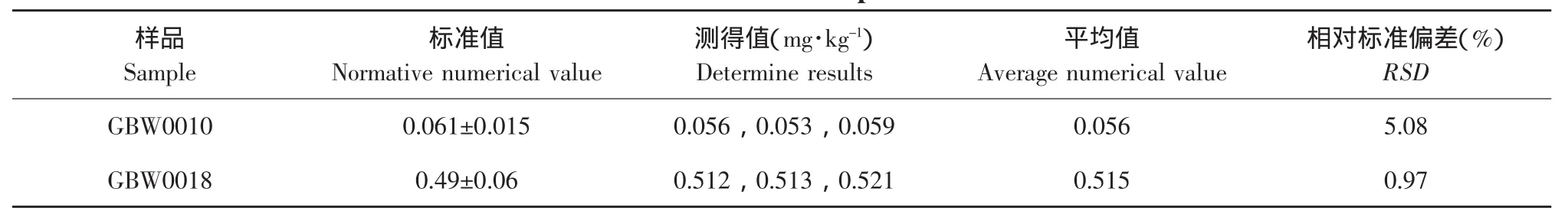
表7 准确度试验Table 7 Test of the precision
2.5 回收率试验
向供试的国家标准物质和饲料样品中分别添加标准溶液,在同样试验条件下,做添加回收率试验,回收率结果见表8。
加标回收是指在前处理过程中,向固体样品中加入标准物质,然后一起消解,最后变成溶液,然后测定含量,来确定样品的回收效果。做加标回收率的目的主要是为了验证所用方法的准确性和可靠性,可以判断在进行样品处理时是否会造成分析组分的损失或带来分析组分的沾污。其计算公式为:

结果处于90%~110%为合格。从表8可知,向国家标准物质和饲料1中添加硒标准物质,在此方法下检测数据均处于90%~110%之间,说明此方法整个分析过程合理、可靠。
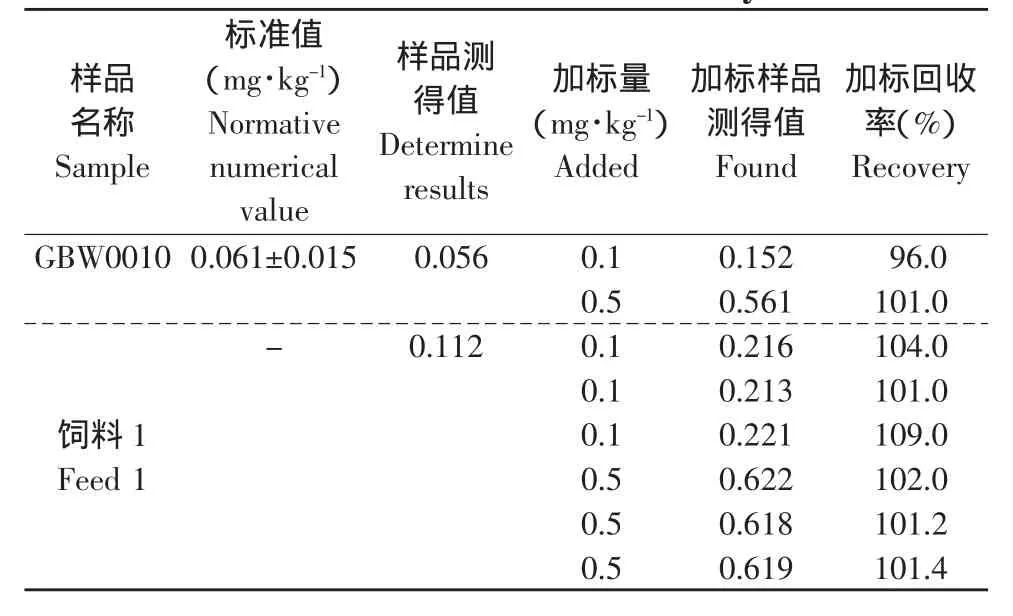
表8 添加回收率试验Table 8 Test of the added recovery rate
3 讨论与结论
本文采用电加热湿法消化、氢化物发生原子荧光光谱法测定饲料中的硒,在严格控制消化温度的基础上,分析优化了硼氢化钾溶液的最佳浓度、载流介质和载流浓度等因素对试验结果的影响,并通过国家标准物质和添加回收率试验验证该方法对饲料样品中硒测定的准确性、重复性、可靠性。
a.与测定硒的常用方法荧光法、原子吸收法和比色法相比,荧光法繁琐,且所用试剂DAN毒性大;原子吸收法、火焰法灵敏度低,石墨炉法有严重的基体干扰;比色法灵敏度低。此方法弥补了上述方法的不足,具有无毒、灵敏、准确等优点。针对目前饲料中硒测定的行业标准还为空白,更可为制定此行业标准提供方法准备。
b.通过本试验,找到了应用AFS-230S测定饲料中硒的最佳方法∶光电倍增管负高压为290 V,原子化器高度为8 mm,灯电流为70 mA,载气流量为400 mL·min-1,屏蔽气流量为 1 000 mL·min-1,读数时间为11 s,测量方式为标准曲线法,延时时间为1.0 s,读数方式为峰面积。
c.通过测定发现不同饲料中硒含量差距很大,该方法适合不同类型饲料硒的测定,能够满足日常工作的需要,是检测和监测饲料中硒含量的一种良分析方法,具有很好的可行性和实用性,能起到严把质量关的作用,为人民的饮食和健康保驾护航。
[1]金明昌,汪开毓.不同硒水平对幼鲤生产性能和免疫功能的影响[J].营养饲料,2008,44(5)∶32-36.
[2]袁施彬,余冰.硒添加水平对氧化应激仔猪生产性能和免疫功能影响的研究[J].畜牧兽医学报,2008,39(5)∶677-681.
[3]潘翠玲,黄克和,赵玉鑫,等.不同硒源对蛋鸡血硒含量及抗氧化能力的影响[J].南京农业大学学报,2008,31(2)∶91-96.
[4]胡东志,唐保国.硒的营养作用及对动物生殖性能影响的研究进展[J].湖南畜牧兽医,2008(3)∶1-3.
[5]李士平,王安,单安山.锌、硒、碘对蛋鸡蛋黄着色效果的影响[J].东北农业大学学报.2004,35(3):329-333.
[6]王钟翊,李前勇,邓科敏,等.渝西地区饲料中硒含量的调查[J].饲料工业,2008,29(5)∶60-61.
[7]张厂,郭福有.硒在鸡饲粮中的应用研究进展[J].广东农业科学,2007(8)∶70-72.
[8]周秀霞.硒在畜禽营养中的应用及发展前景[J].饲料博览,2007(9)∶49-52.
[9]何若方,李绍钰,李静,等.动物产品中硒富集的研究[J].饲料工业,2008,29(12)∶57-58.
[10]宋凡.氢化物发生-原子荧光光谱法测定饲料添加剂及预混料中微量元素硒[J].新饲料,2008(8)∶29-30.
[11]高建忠,张庆华.氢化物发生-原子荧光光谱法测定虾中的硒含量[J].安徽农业科学,2008,36(21)∶9095-9096.
[12]赵其波,陈平,刘琼,等.用原子荧光法检测家蚕体内硒的含量及其分布[J].蚕业科学,2007,33(3)∶482-485.
[13]谷历文,覃毅磊.氢化物原子荧光光度法测定食品、化妆品中砷含量[J].东莞理工学院学报,2004,11(3)∶31-33.

