黑穗醋栗花中RNA提取方法的比较研究
赵 慧,李兴国,于泽源
(东北农业大学园艺学院,哈尔滨 150030)
从植物中提取较高质量的总RNA是顺利进行基因表达模式,克隆基因等各种分子生物学研究的基础。常用的RNA提取方法有异硫氰酸胍法[1]、盐酸胍法[2]、苯酚法[3]、SDS 法[4]、CTAB 法[5]、LiCi尿素法[6]、热硼酸法[7]、改良Bugos法[8-9]等。植物组织中的多酚、多糖和蛋白质以及其他代谢物质均能影响RNA的提取[10]。由于不同植物不同组织,甚至同一植物不同发育期,植物所含化学成分不同,影响植物RNA提取的因素亦不同,因此应该针对植物材料的具体特点选择适宜的总RNA提取方法。黑穗醋栗是虎耳草科茶 藨 子 属小灌木,从当前的研究来看,关于黑穗醋栗分子生物学领域的研究报道较少,本研究的宗旨是筛选出适合黑穗醋栗花中总RNA的提取方法,为黑穗醋栗分子生物学领域的研究提供理论依据和技术支撑。
1 材料与方法
1.1 材料
1.1.1 植物材料
在黑穗醋栗(布劳得)盛花期,采摘完整的花朵,迅速投入液氮中冷冻备用。
1.1.2 试剂
CTAB、DEPC、SDS、氯化锂、β-巯基乙醇、醋酸钠、EDTA、Tris苯酚等购自上海生物工程公司;琼脂糖为西班牙原装;DNaseⅠ、RNase抑制剂、反转录试剂盒等购于PROMEGA公司;其他的化学试剂均为国产分析纯。
1.1.3 试验耗材及仪器
所用试剂瓶和塑料耗材均预先用0.1%DEPC水处理24 h以上,50~60℃烘干,并高压灭菌20 min。研钵150℃烘干4 h后低温冷冻,所需试剂均用0.1%DEPC水配制,并湿热灭菌20 min避免RNase污染。仪器为琼脂糖水平电泳槽,琼脂糖电泳仪,高速低温冷冻离心机,电子天平,超低温冰箱,电热恒温水浴锅,漩涡振荡器,超净工作台等。
1.2 方法
1.2.1 CTAB法
参照温鹏飞葡萄果皮中RNA的提取[5]。
1.2.2 植物RNA提取
RNA提取试剂盒(天泽公司植物RNA out编号3080-10的试剂盒,略有改动)。
取0.2 g样品液氮研磨成粉后迅速放入预冷离心管中后加入1 mL A溶液匀浆,加入0.3 mL溶液B和0.2 mL氯仿。充分振荡混匀。12 000 r·min-1离心3 min后移入新的离心管中,加入0.5 mL溶液C和0.2 mL氯仿充分振荡混匀。12 000 r·min-1离心3 min后移入新的离心管中,加入1/2体积的溶液D,振荡混匀后离心20 min,弃上清75%乙醇洗涤2次,沉淀用40 μL DEPC水溶解待用。
1.2.3 硼砂-SDS法
参照许平等总RNA的提取[11],略有改动。1.5 mL离心管中加入0.6 mL SDS提取液,0.06 mL β-巯基乙醇,0.4 mL Tris苯酚和0.3 mL氯仿,取样品0.2 g液氮研磨后迅速加入离心管中,用漩涡振 荡 器 振 荡 约 3 min,10 000 r·min-1离 心5 min,取上清,加入0.3 mL Tris苯酚和0.3 mL氯仿,用漩涡振荡器剧烈振荡2 min,10 000 r·min-1离心5 min,取上清。等体积氯仿重复抽提一次取上清,加入等体积10 mol·L-1氯化锂和1/2体积的无水乙醇,冰浴10 min,1 000 r·min-1离心10 min,沉淀RNA。沉淀加300 μL DEPC水,30 μL 3 mol·L-1醋酸钠和 900 μL无水乙醇,冰浴 10 min,12 000 r·min-1离心 10 min,弃上清,75%乙醇洗涤2次,沉淀用40 μL DEPC水溶解待用。
1.2.4 Trizol法
取0.2 g样品液氮速冻研磨后,迅速加入1 mL Trizol试剂,充分摇匀,室温放置5 min,加入0.2 mL氯仿:异戊醇(24:1)剧烈震荡15 s,室温放置2 min。4℃ 12 000 r·min-1离心 15 min,取上清,弃沉淀,上清转入新离心管中。加入0.5 mL异丙醇,混匀,室温放置10 min。4℃12 000 r·min-1离心10 min,弃上清,沉淀用75%乙醇洗涤2次,40 μL DEPC水溶解待用。
1.2.5 合成
按照PROMEGA反转录试剂盒的说明对硼砂-SDS法提取的总RNA进行反转录,方法如下:在tube-1 中 加 入 总 RNA,8.0 μL 和 oligo dT(20 μmol·L-1)2.0 μL,70 ℃水浴 5 min 后直放到 42 ℃水浴1~2 min。在200 μL tube-2中加入下列成分:5.0 μL,M-MLV(5×Buffer);1.25 μL,10 mol·L-1d NTP mix;1.0 μL,rRNAsin(40 U);1.0 μL,MMLVRT(200 U);4.75 μL,DEPC 和 tube-1 体系相加为25 μL。42℃水浴1~2 min。保持42℃,两管混合42℃,60 min;70℃,15 min。最后-20℃保存。
2 结果与分析
2.1 凝胶电泳分析
2.1.1 不同提取方法的黑穗醋栗花朵RNA样品的凝胶电泳分析
取 3 μL RNA 样品与 2 μL 6×Loading buffer混合后进行1.0%琼脂糖凝胶电泳,电压为120 V,电流100 mA,功率256 W的条件下电泳15 min,在紫外凝胶成像系统上观察RNA条带的清晰度和完整性并拍照。可见利用CTAB提取的总RNA可以看出18S和28S条带,但是降解严重(见图1-A)。Plant out RNA试剂盒琼脂糖凝胶电泳检测后呈现两条清晰的条带,分别为28S和18S RNA,二者亮度比约为2:1,条带无明显降解(见图1-B)。利用硼砂-SDS法提取的RNA,28S和18S两条带型清楚,而且28S rRNA无论在质量和亮度上均是18S rRNA的两倍。两条带之间无弥散现象,排除RNase污染,未发生明显降解现象(见图1-C)。Trizol法提取黑穗醋栗花的总RNA无任何条带,表明该方法不适用于黑穗醋栗花总RNA提取(见图1-D)。
2.1.2 cDNA检测
进行1.0%琼脂糖凝胶电泳,电压为120 V,电流100 mA,功率256 W的条件下电泳30 min,在紫外凝胶成像系统上观察cDNA条带并拍照。反转录可得500~1 000 bp之间的弥散cDNA条带。
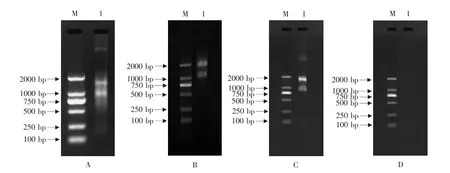
图1 黑穗醋栗花朵总RNA电泳Fig.1 Agarose gel electrophoresis of blackcurrant flower total RNA isolated with different methods

图2 反转录Fig.2 cDNA
2.2 RNA样品的质量检测分析
紫外分光光度计定量测定和纯度分析见表1。取2 μLRNA样品稀释50倍,在紫外分光光度计测定230、260和280 nm波长下OD值,计算出OD260/OD280和OD260/OD230的值以确定提取的黑穗醋栗RNA的纯度。
通过如下公式计算产率:
RNA 样品的产率(μg·g-1)=OD260×N(样品稀释倍数)×40(μg·mL-1)×V(mL)/样品重(g)。

表1 不同提取方法得到黑穗醋栗花朵中总RNA的OD值和得率Table 1 OD value and yield of the blackcurrant total flower RNA isolated with different methods
排除Trizol法未提取出黑穗醋栗花朵中的RNA,分别对其他3种方法所得的RNA的OD值进行比较,CTAB法所得的RNA的纯度较低,D260/D280为1.62,植物RNA提取试剂盒法提取的RNA纯度较高,OD260/OD280为1.9,硼砂-SDS法提取的纯度最高,OD260/OD280达到2.06,这说明用此方法提取的总RNA纯度高,经计算得出总RNA产率达 61.60 μg·g-1,说明硼砂-SDS法提取的黑穗醋栗花朵中的总RNA可用于分子克隆试验研究。
综合纯度,完整性和产量等因素,认为硼砂-SDS法最适合黑穗醋栗花朵中总RNA的提取。其余方法提取出的总RNA OD260/OD280和OD260/OD230的值都小于2.0,说明存在蛋白质、酚类、多糖的污染,总 RNA 得率不足 60 μg·g-1。
3 讨论
RNA提取的影响因素有很多,不同植物或者同一植物不同器官的组分和含量就有很大的差异。酚类化合物、多糖、蛋白质和未知次级代谢产物是影响植物组织RNA提取的几个主要干扰因素[12]。近年来有关木本植物RNA提取的方法有很多的文献报道[10,13-15],但是在植物材料匀浆时,这些富含酚类物质会释放出来,氧化后使匀浆液变为褐色,并随氧化程度的增加而加深,这一现象被称为褐化效应(Browning effect)。被氧化的酚类化合物(如醌类)能与RNA稳定地结合,从而影响RNA的分离纯化。黑穗醋栗花朵和其他的木本植物相似,体内含有较多的次级代谢物质,严重影响RNA的提取,因此去除酚类化合物是该样品RNA提取的一关键因素。
常用的RNA提取方法CTAB法很适合于糖类含量高[5],富含酚类化合物多的样品[16],但试验发现CTAB法提取的时间较长,虽然可以提取出RNA,但该方法操作复杂繁琐,需2 d才能完成而且降解严重。Trizol提取过程简单方便,适用于提取很多种植物叶片的RNA,但是却不适合去除次生代谢物含量高的样品,在黑穗醋栗的花朵中没有明显的效果,不适合该种样品的RNA提取。而Plant out RNA试剂盒用时较短,但纯度较SDS法低,且价格相对昂贵。
4 结论
硼砂-SDS法,结合了各种方法的优点,用硼砂取代Tris-HCL,克服了Tris对DEPC的敏感,无法用DEPC处理的缺憾。其次利用高盐LiCl可以选择沉淀总RNA使部分多糖留在溶液中而不随RNA沉淀下来,这样极大地降低了沉淀中多糖的含量。而试验中SDS、氯仿等又是蛋白质变性剂,可以明显的使RNase丧失活性[11]。并且硼砂-SDS法试验成本较低,试剂配制简单。可为其他果树花期次级代谢物含量较高的花朵的总RNA提取提供参考。
[1] 卢圣栋.现代分子生物学实验技术[M].北京:高等教育出版社,1993:35-148.
[2] Logemann J,Schell J,Willmitzer L.Improved method for the isolation of RNA from plant tissues[J].Anal Biochem,1987,163(1):16-20.
[3] Calau G A,Legockla B,Greenway S C,et al.Cotton messenger RNA sequences exist in both polyadenylated and nonpolyadenylated forms[J].J B iol Chem,1981,256:2551-2560.
[4] Vandriessche E S,Becckmans S,Dejaegere R,et al.Thiourea:the arrtioxidant of choice for the purification of proteins from phenolrich plant tissues[J].Anal Biochem,1984,141(1):184-188.
[5] 温鹏飞.葡萄与葡萄酒中黄烷醇类多酚和果实原花色素合成相关酶表达规律和研究[D].北京:中国农业大学,2005:5.
[6] 卢圣栋.现代分子生物学实验技术[M].北京:中国协和医科大学出版社,1993:135-149.
[7] WancY,WilkinsTA.Amodifiedhotboratemethodsignificantlyenhance the yield of high quality RNA from cotton(Gossypium hirsutum L.)[J].Anal Biochem,1994,223(1):7-12.
[8] 徐昌杰,陈昆松,张波,等.柑橘组织RNA提取方法研究[J].果树学报,2004,21(2):136-140.
[9] 孙长悦.梨组织RNA提取方法研究[J].北方园艺,2009(3):19-21.
[10] 林金科,开国银.茶树RNA的提纯与鉴定[J].福建农林大学学报:自然科学版,2003,32(1):70-73.
[11] 许平,车代弟,王金刚,等.观赏山梨叶片总RNA的提取及质量分析[J].东北农业大学学报,2008,39(3):43-38.
[12] 李宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报,1999(1):36.
[13] 裴东,谷瑞升.几种提取木本植物中RNA方法的改进[J].植物生理学通讯,2002,38(4):362-365.
[14] 周怀军,张洪武,安连荣,等.落叶树RNA提取方法对比研究[J].河北农业大学学报,2003,6(3):62-64.
[15] 王玉成,薄海侠,杨传平,等.总RNA提取方法的建立[J].东北林业大学学报,2003,31(5):99-100.
[16] 陈长宝,朱树华,周杰.改良CTAB法提取成熟肥城桃果实总的RNA[J].山东农业科学,2009(5):102-104.

