黄瓜植株衰老过程中根系内生理生化指标变化
商庆梅,秦智伟,周秀艳
(东北农业大学园艺学院,哈尔滨 150030)
黄瓜(Cucumis sativus L.)是我国种植范围最广、面积最大的蔬菜之一,在我国农业生产中占据十分重要的经济地位。根系的萌发和衰老对地上部植物的生长发育起着决定性的作用。有关黄瓜的衰老,已有的研究大多集中在对黄瓜叶片及采后果实衰老的研究上[1-2],由于根系埋藏在黑暗的土壤中,研究难度较大,所以目前对根系衰老的研究较少。另外,以往研究黄瓜衰老的试材多为处于黑暗、高温、干旱等胁迫条件下的幼苗,而对正常田间管理条件下成株根系的衰老研究报道却较少。
本试验对两个生育期不同的黄瓜品种在正常田间管理条件下植株发育过程中根系内的主要生理生化指标进行测定,试图探明黄瓜植株发育过程中根系衰老的变化规律,为进一步开展黄瓜衰老问题的研究奠定了基础。
1 材料与方法
1.1 供试材料
本试验以黄瓜品种D0313(早熟,生育期110 d左右)和649(晚熟,生育期130 d左右)为材料,种子由东北农业大学园艺学院黄瓜课题组提供。
1.2 栽培基质与方法
试验采用桶栽法。采用30 cm×25 cm的塑料桶(在塑料桶的底部和侧面钻直径约0.5 cm的小孔若干个),每桶装入混合基质(体积比为田园土:蛭石:河砂=2:1:1,混合均匀)12.5 kg,每桶施入牛粪肥20 g,复合肥10 g,代森锌0.5 g。在全生育期内施硫酸钾和尿素各1次,每桶施入5%的硫酸钾和尿素各100 mL,叶面喷施微肥和Ca2+肥1次。
试验于2008年5月9日播种,5月14日分苗,6月12日黄瓜幼苗长至3叶1心期定植,采用随机区组排列,3次重复,正常田间管理。
1.3 取样时期与方法
植株生长至30 d和60 d时,分别进行第1次和第2次取样,以后每隔15 d取样1次,直到120 d植株接近枯死时为止,共取样6次。每次选取有代表性的植株3株,将植株的根系用水小心冲洗干净并吸干表面水分后,取长度约为3 cm的侧根若干段,之后将其剪碎,混合均匀,用于各项指标的测定,3次重复。
1.4 测定项目与方法
根系活力测定采用TTC比色法[3];可溶性蛋白质含量测定采用考马斯亮蓝G-250染色法[4];丙二醛(Malondialdehyde,MDA) 含量测定采用硫代巴比妥酸(Thiobarbituric acid,TBA)显色法[5];超氧化物歧化酶(Superoxide,SOD)活性测定采用氮蓝四唑(Nitroblue tetrazolium,NBT)法[6];过氧化物酶(Peroxidase,POD)活性测定采用愈创木酚比色法[7]。
2 结果与分析
2.1 黄瓜植株衰老过程中根系活力的变化
结果见图1。
根系活力的下降,会导致根系吸收营养和合成生理活力物质的能力降低。由图1可知,从整个生育期来看,黄瓜品种649的根系活力显著高于D0313。D0313和649根系活力均呈现先升高后下降的趋势。当植株生长至30 d时,D0313和649根系活力分别为 0.174 和 0.305 mg·g-1·h-1,此时,649根系活力比 D0313 高 0.131 mg·g-1·h-1。当植株生长至120 d时,D0313和649根系活力分别为 0.052 和 0.164 mg·g-1·h-1,649 比 D0313 高 0.112 mg·g-1·h-1。D0313和649根系活力分别在植株生长至60和75 d时达到最大值,并且60和75 d也是D0313和649根系活力开始下降的时间。D0313根系活力不仅下降的时间比649早,而且下降的速度也明显快于649。
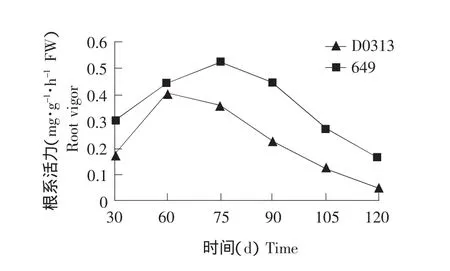
图1 黄瓜植株衰老过程中根系活力的变化Fig.1 Change of root vigor of cucumber during senescence
2.2 黄瓜植株衰老过程中根系内可溶性蛋白质含量的变化
结果见图2。
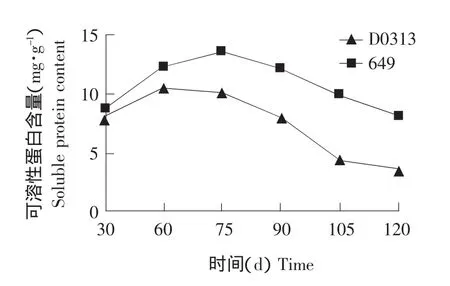
图2 黄瓜植株衰老过程中根系内可溶性蛋白质含量变化Fig.2 Change of soluble protein content of cucumber root during senescence
蛋白质含量的降低是衰老过程的一个显著标志。由图2可知,总体看来,D0313和649植株发育过程中根系内可溶性蛋白质含量的变化均呈现先上升后下降的趋势。在植株发育的前期,根系内可溶性蛋白质含量随着植株的生长而升高,说明前期可溶性蛋白质代谢以合成为主。而后期随着植株的衰老,可溶性蛋白质含量下降,说明此时可溶性蛋白质以分解代谢为主。在植株的整个发育过程中,黄瓜品种649根系内可溶性蛋白质含量始终高于D0313,并且随着植株的衰老,两个品种根系内可溶性蛋白质含量差异越显著。当植株生长至30 d时,D0313和649根系内可溶性蛋白质含量分别为8.091和8.685 mg·g-1,649仅比D0313高0.594 mg·g-1。而当植株生长至120 d时,D0313和649根系内可溶性蛋白质含量分别为3.612和8.195 mg·g-1,此时 649 比 D0313 高 4.583 mg·g-1。D0313比649根系内可溶性蛋白质含量开始下降的时间早且速度快。D0313和649根系内可溶性蛋白质含量开始下降的时间分别在植株生长至60和75 d,D0313比649早约15 d。
2.3 黄瓜植株衰老过程中根系内MDA含量的变化
结果见图3。
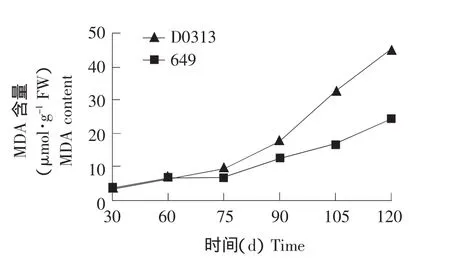
图3 黄瓜植株衰老过程中根系内MDA含量的变化Fig.3 Change of MDA content of cucumber root during senescence
植物器官衰老时,会发生膜脂过氧化作用,MDA是膜脂过氧化的最终分解产物之一。如图3所示,从植株生长发育的整个过程来看,黄瓜品种D0313和649根系内MDA含量变化呈现前期缓慢上升,后期快速上升的趋势。D0313较649根系内MDA含量开始升高的时间早且速度快。植株生长至60 d时,D0313与649根系内MDA含量差异逐渐显著。植株生长30 d时,D0313和649根系内MDA 含量分别为 3.39 和 3.04 μmol·g-1,D0313 仅比 649 高 0.35 μmol·g-1。而当植株生长至 120 d时,D0313和649根系内MDA含量分别为45.30和24.25 μmol·g-1,D0313 比 649 高 21.05 μmol·g-1,此时,D0313根系内MDA含量是649的1.87倍。
2.4 黄瓜植株衰老过程中根系内POD活性的变化结果见图4。
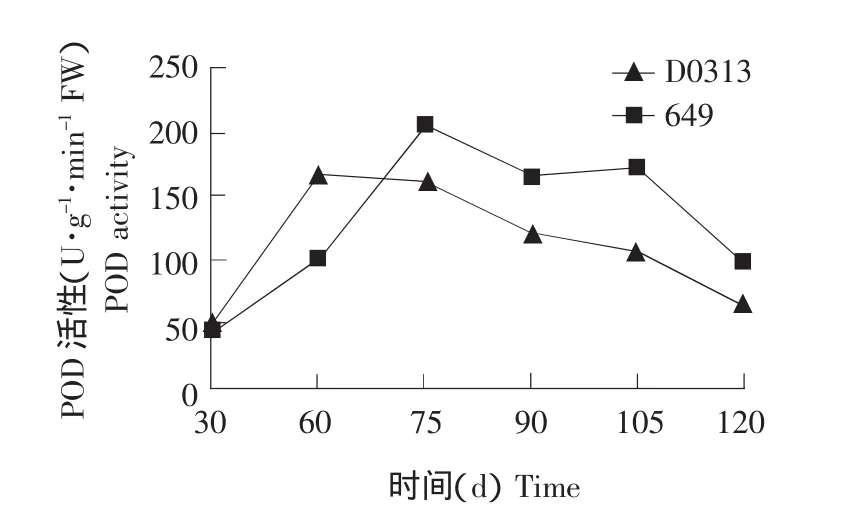
图4 黄瓜植株衰老过程中根系内POD活性的变化Fig.4 Change of POD activity of cucumber root during senescence
由图4可知,植株生长30~60 d时,D0313根系POD活性快速升高,这可能是由于在该时期D0313根系内膜脂过氧化作用已经启动,POD活性快速升高以清除根系内产生的MDA,这是根系的一种自我保护活动。60~75 d时,D0313根系内POD活性仍保持较高水平,说明此时POD仍能较好的清除MDA等膜脂过氧化产物。75 d后,POD活性开始快速下降,D0313根系内的MDA含量快速上升,植株衰老进程加快。植株生长的30~75 d期间,649根系内POD活性变化呈上升趋势,且上升速度为30~60 d期间较慢,60~75 d期间较快,说明649根系内膜脂过氧化作用可能是在60~75 d期间启动,所以,649膜脂过氧化作用启动时间可能比D0313晚15 d。75~105 d时,649根系内POD活性保持在较高水平。105~120 d,POD活性快速下降,说明此时649根系衰老速度加快。
2.5 黄瓜植株衰老过程中根系内SOD活性的变化结果见图5。
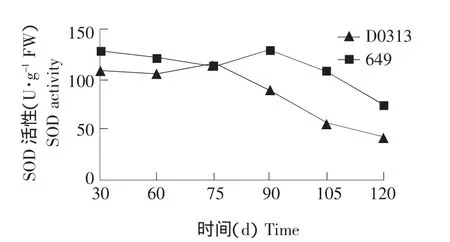
图5 黄瓜植株衰老过程中根系内SOD活性的变化Fig.5 Change of SOD activity of cucumber root during senescence
SOD是细胞内自由基清除系统中一个关键酶,与植物衰老及抗逆性密切相关[5]。由图5可知,从整个生育期来看,黄瓜品种D0313和649根系内SOD活性变化趋势大致相似,均为前期变化平稳,后期剧烈下降。从总体上看,649根系内SOD活性高于D0313。植株生长至30 d时,D0313和649根系内SOD活性分别为109.76和 127.59 U·g-1,649比D0313高17.83 U·g-1。当植株生长至120 d时,D0313和649根系内SOD活性分别为41.70和72.69 U·g-1,649 比 D0313 高 30.99 U·g-1。D0313和649根系内SOD活性开始快速下降的时间分别为植株生长至75和90 d,D0313比649早约15 d。D0313根系内SOD活性下降速度显著快于649。D0313和649根系内SOD活性在开始下降前都有一个小幅上升过程,这可能是根系对衰老的一种适应性反应。
3 讨论与结论
根系是连接土壤与植物地上部之间物质交换的重要桥梁,一个强壮的根系是支撑和哺育蓬勃茂盛株冠的基础[8]。根系衰老导致根系功能衰退是引起全株衰老的重要原因之一。试验通过对D0313和649两个不同生育期黄瓜品种的试验研究结果表明,在黄瓜的生长发育全过程中,根系内各项生理生化指标呈规律性变化。两个黄瓜品种根系内可溶性蛋白质含量、根系活力及POD活性均呈现先升高后下降的趋势,MDA含量呈现上升趋势;在植株生长后期,随着植株的衰老,根系内MDA含量快速增加,而根系活力、可溶性蛋白质含量、POD和SOD活性则快速下降。黄瓜品种D0313在植株生长至60 d时,根系活力与根系可溶性蛋白质含量均开始下降,而品种649在75 d时开始下降,D0313均比649早约15 d,并且下降速度也明显比649快。但两个黄瓜品种的根系活力变化均较可溶性蛋白质含量变化显著。D0313和649根系内SOD开始快速下降的时间分别在植株生长至75和90 d,D0313比649早约15 d,并且下降速度也显著快于649。因此,可以将根系活力和SOD活性作为鉴定黄瓜根系衰老的生理生化指标,并将其应用于抗衰老品种的筛选及鉴定。
[1] 孙艳,梁宇柱,陈敬东,等.黄瓜叶片衰老过程中抗坏血酸含量与生理指标关系的研究[J].西北植物学报,2008,28(3):512-516.
[2] 龚国强,于梁,周山涛.低温对黄瓜果实超氧化物歧化酶(SOD)的影响[J].园艺学报,1996,23(1):97-98.
[3] 郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:31-33,106-108.
[4] 李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:184-186.
[5] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:211-214.
[6] 郑炳松.现代植物生理生化研究技术[M].北京:气象出版社,2006:41-42.
[7] 张宪政.作物生理研究法[M].北京:农业出版社,1992.
[8] 严小龙.根系生物学原理与应用[M].北京:科学出版社,2007.

